Piscirickettsiose hos oppdrettslaks i Norge
Piscirickettsiose, forårsaket av bakterien Piscirickettsia salmonis, er en alvorlig sykdom hos oppdrettslaks. Her presenterer vi tre tilfeller av piscirickettsiose hos oppdrettlaks i Norge, med fokus på histopatologiske forandringer. Formålet er å dele relevant informasjon om sykdomsfunn med fiskehelsepersonell og bidra til økt kunnskap og oppmerksomhet om piscirickettsiose.
Veterinærpatolog, Pharmaq Analytiq, Oslo
Veterinærpatolog, PhD, Dipl.ECVP, Pharmaq Analytiq, Oslo
Veterinærpatolog, PhD, Dipl.ECVP, Pharmaq Analytiq, Oslo
Veterinær, STIM AS
Veterinær, STIM AS
Innledning

Piscirickettsiose forårsakes av bakterien Piscirickettsia salmonis; en gram negativ, fakultativ intracellulær, kokkoid bakterie. Sykdommen er også kalt salmonid rickettsial septicaemia (SRS). Denne sykdommen ble først identifisert i Chile på slutten av 1980-tallet og har siden forårsaket betydelige tap i oppdrettsnæringen der (1). Piscirickettsiose er også beskrevet i Canada, Irland og Skotland (2), og har blitt påvist sporadisk i oppdrettsnæringen i Norge siden 1988. Sykdommen er ikke listeført i Norge, men Mattilsynet har som mål å hindre spredning og etablering av sykdommen (3).
Kliniske tegn på piscirickettsiose kan variere. Alvorlig affisert fisk kan være mørke i fargen, vise sløvhet og manglende appetitt, ukoordinert svømming og svømming nær overflaten (4-6). Ytre tegn kan være bleke gjeller, petekkiale blødninger ved finnebasis og gatt (2). Infiserte fisk kan også ha hudlesjoner som kan variere fra små områder med opphøyde skjell til hemoragiske hudsår diffust spredt over hele kroppen (4-6). Høy dødelighet kan være eneste tegn på sykdom ved akutte infeksjoner (1,2). Ved obduksjon er det vanlig å se grågule områder subkapsulært i leveren, blødninger i indre organer, svømmeblære og skjelettmuskulatur, og svullen nyre og milt (1,2). Forandringene kan være omfattende og ha betydelig negativ innvirkning på fiskens helse og velferd.
Sykdommen har vist seg å være vanskelig å bekjempe i Chile (7). Vaksinering mot piscirickettsiose har vist dårlig effekt i Chile, mest sannsynlig grunnet bakteriens evne til å replikere i vertens immunceller (8). Det er ingen tilgjengelige vaksiner mot sykdommen i Norge og EU. Grunnet den dårlige effekten av vaksinering har piscirickettsiose ført til høyt antibiotikaforbruk i Chile (9). Bakteriens følsomhet for antibakterielle midler er varierende (9).
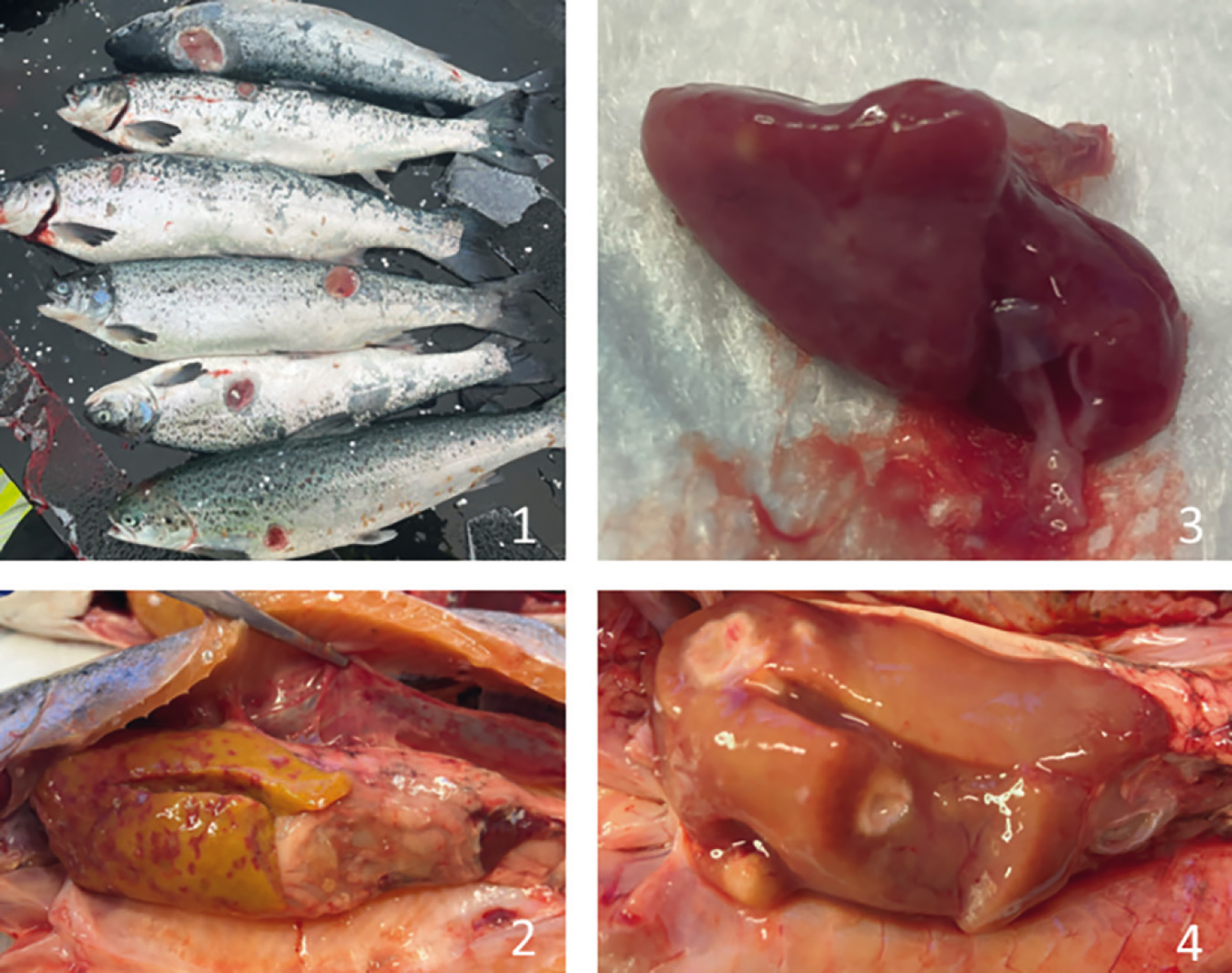
Figur 1-4: Bilder som viser makroskopiske funn hos laks med påvist piscirickettsiose.
Figur 1: Laks med sår i huden.
Foto: Julia Thyra Wood Eidsmo.
Figur 2: Multifokale blødninger i svømmeblære og multifokale grålige leverlesjoner med hyperemisk/hemoragisk randsone.
Foto: Lea Knapperholen Rønning.
Figur 3: Hjerte med multiple lyse lesjoner i hjertemuskulaturen.
Foto: Lea Knapperholen Rønning.
Figur 4: Lever med multiple lesjoner (byller).
Foto: Lea Knapperholen Rønning.
Materiale
I løpet av november i 2024 fikk Pharmaq Analytiq tilsendt prøvemateriale fra laks, fra tre sjølokaliteter i nærheten av hverandre i Troms fylke. Lokalitetene vil bli referert til som lokalitet 1-3 i det følgende.
Kliniske tegn
Innsendende fiskehelsetjeneste meldte om svimere, økt dødelighet, små hudsår og byller/kremgule knuter på indre organer (Figur 1-4). Atferden til svimere var unormal, med sirkling helt oppe i vannoverflaten, kveilende svømming og «blinkere» i dypet med tapt likevekt. Dette ble tolket som forenlig med en sentralnervøs påvirkning. Byller ble av fiskehelsetjenesten i hovedsak observert i lever og hjertemuskulatur, men enkeltindivider hadde slike forandringer i nyret. Flere individer hadde uttalt forekomst av punktblødninger i svømmeblæreveggen, og en del av fiskene hadde tydelige gjelleforandringer i form av multifokale lyse områder.
Diagnostiske undersøkelser
Ved bakteriologisk dyrking utført av innsender fra byller (lever, hjerte og nyre) ble det påvist både blandingsflora og Vibrio splendidus på BAS og Marinagar, noe som tolkes som sekundære funn.
Vev fra fire hjerter og ett nyre fra lokalitet 1, 20 hjerter fra lokalitet 2, og 20 hjerter, syv nyrer og syv hudlesjoner fra lokalitet 3, ble sendt inn for påvisning av agens med polymerase chain reaction (PCR). I tillegg ble det sendt inn organpakker (gjelle, hjerte, lever, nyre, milt, pylorus-blindsekker, tarm, hud, muskel og pankreas) fra henholdsvis syv, fem og fem fisk fra de tre lokalitetene for histopatologisk undersøkelse. Hjernevev fra én fisk ble også sendt inn fra lokalitet 3. Histologisnittene ble farget med hematoxylin og eosin (H&E) og analysert av veterinærpatologer hos Pharmaq Analytiq.
Figur 5-10: Histologi (H&E) fra organer fra laks med påvist piscirickettsiose:
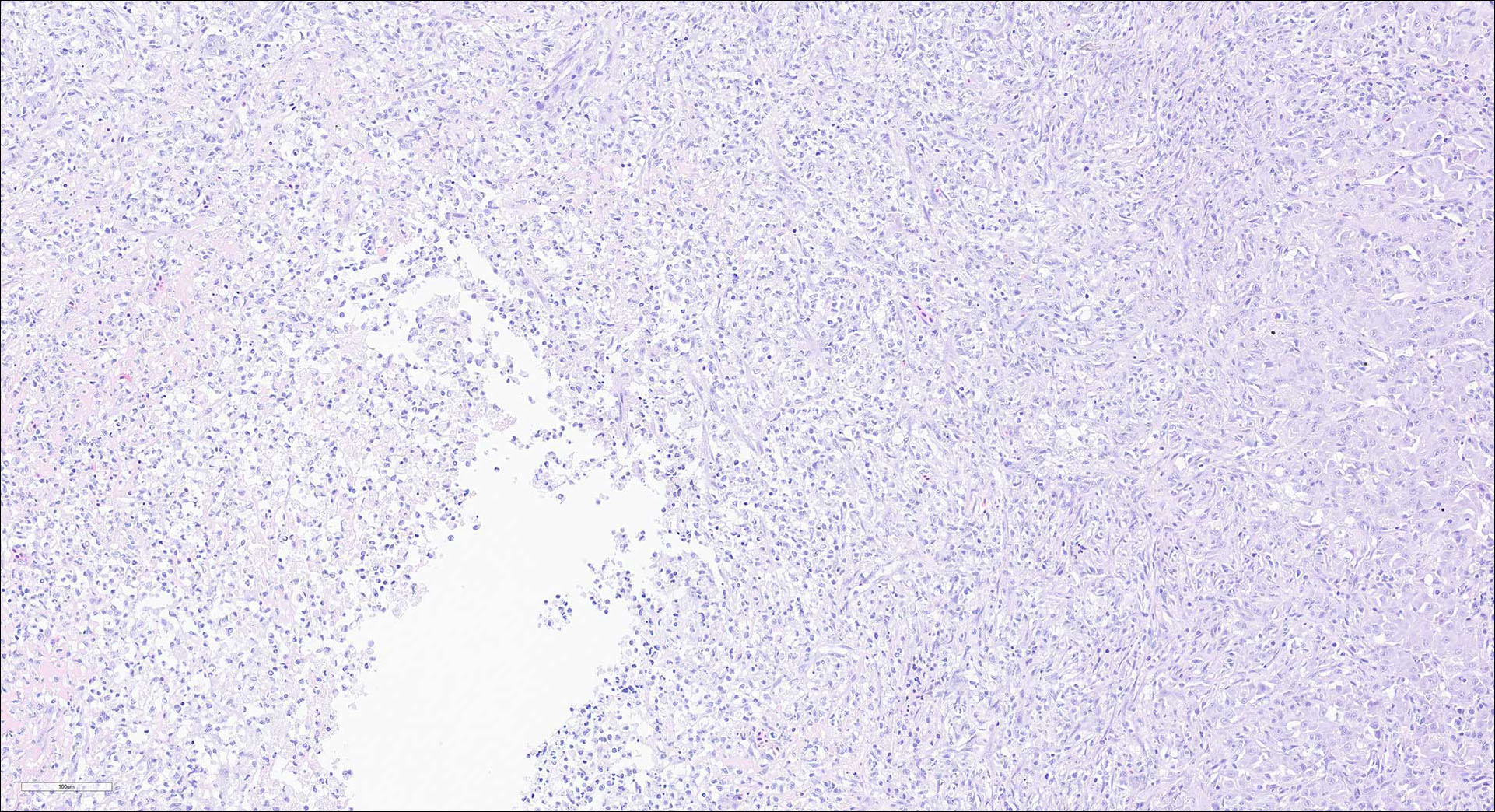
Figur 5: Lever. Nekrose og betennelse sentralt i byll omgitt av fibrinoid materiale, betennelse, fibroplasi. Noe tilnærmet normalt levervev kan sees i høyre kant av bildet.
Foto: Kai-Inge Lie
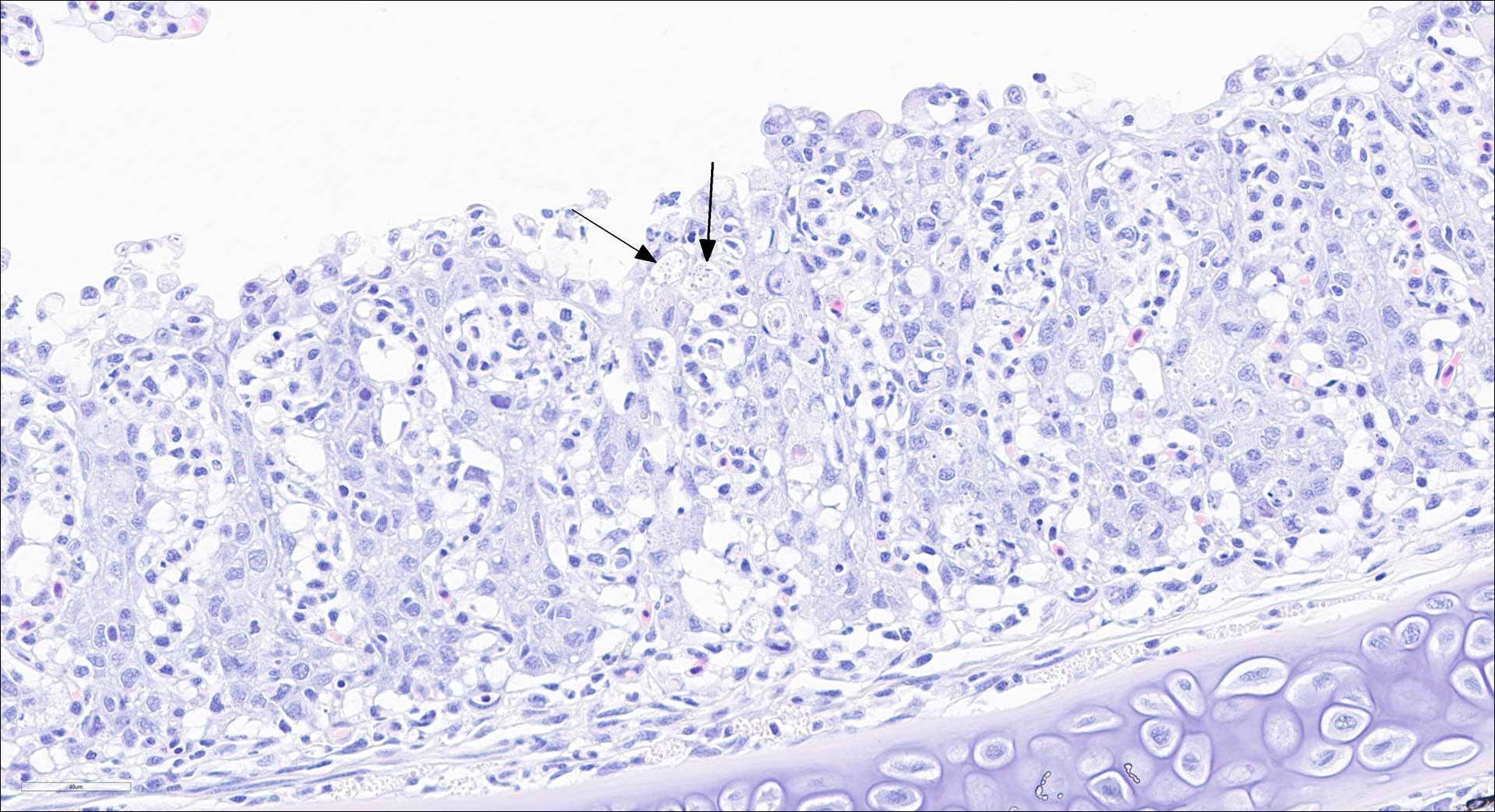
Figur 6: Gjelle. Gjellebetennelse med intracellulære bakterier (piler).
Foto: Kai-Inge Lie
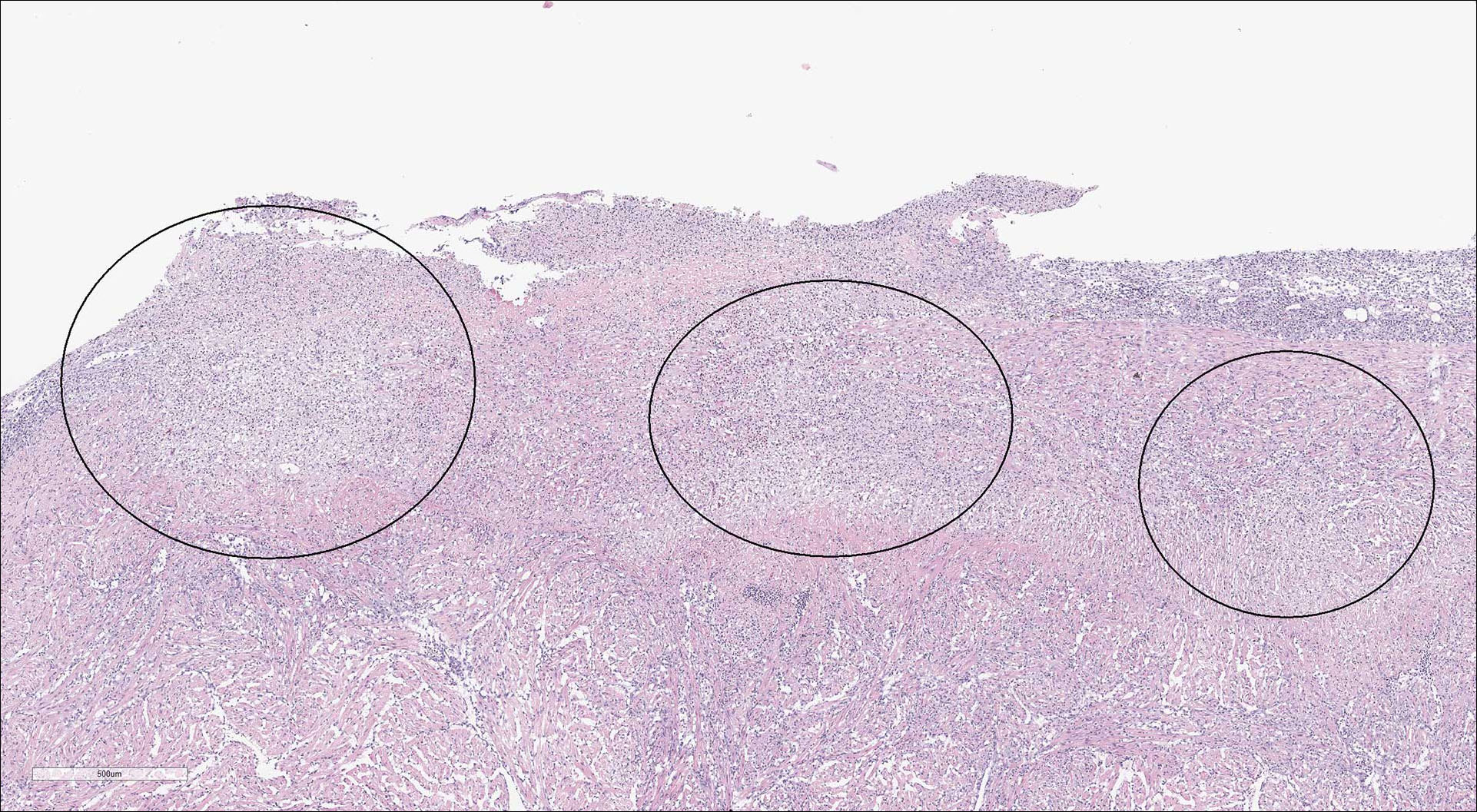
Figur 7: Hjerte. Epikarditt og multifokale byller (sirkler) i kompakt hjertemuskulatur.
Foto: Páll Gretarsson
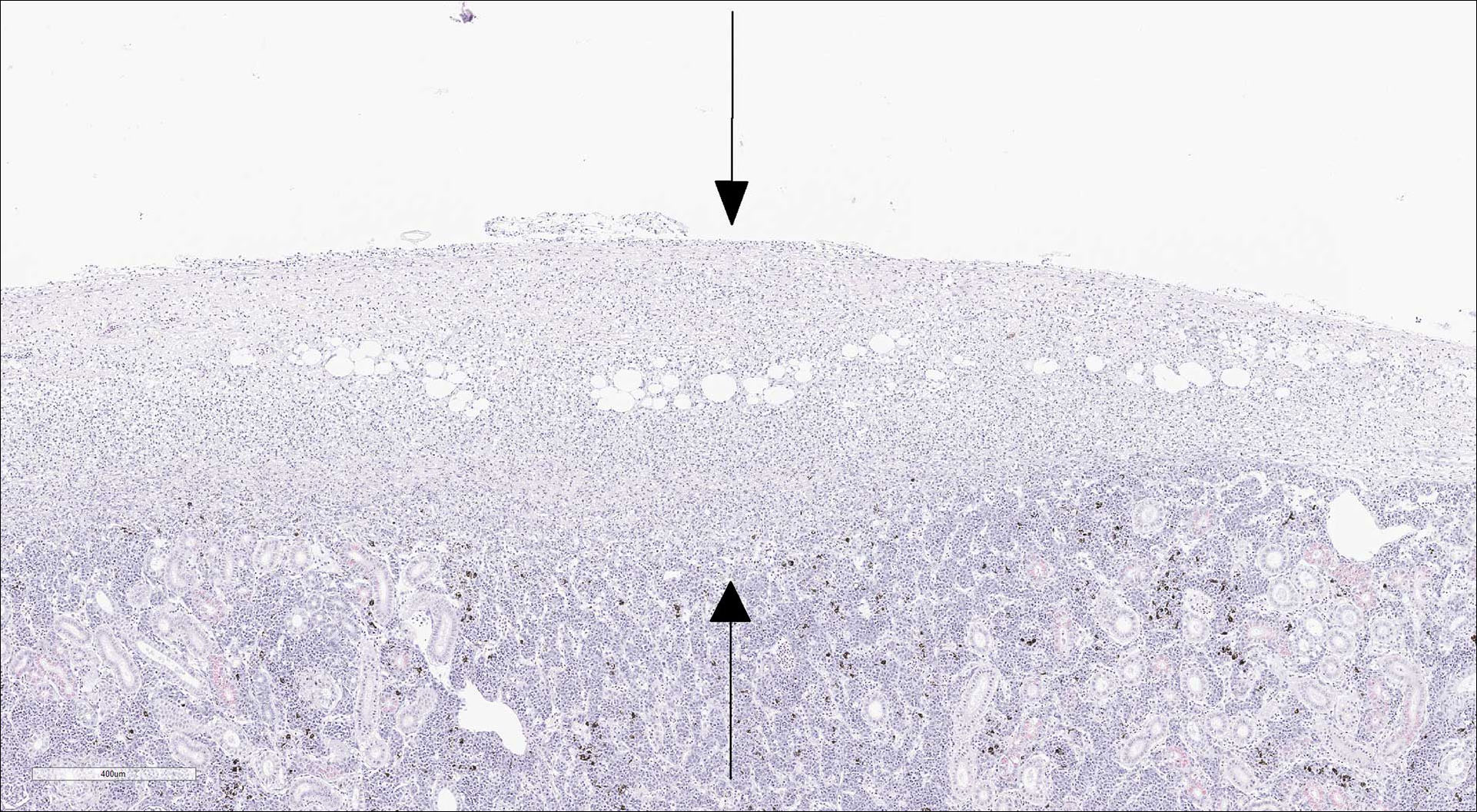
Figur 8: Nyre. Betennelse (mellom piler) i nyrekapsel.
Foto: Páll Gretarsson
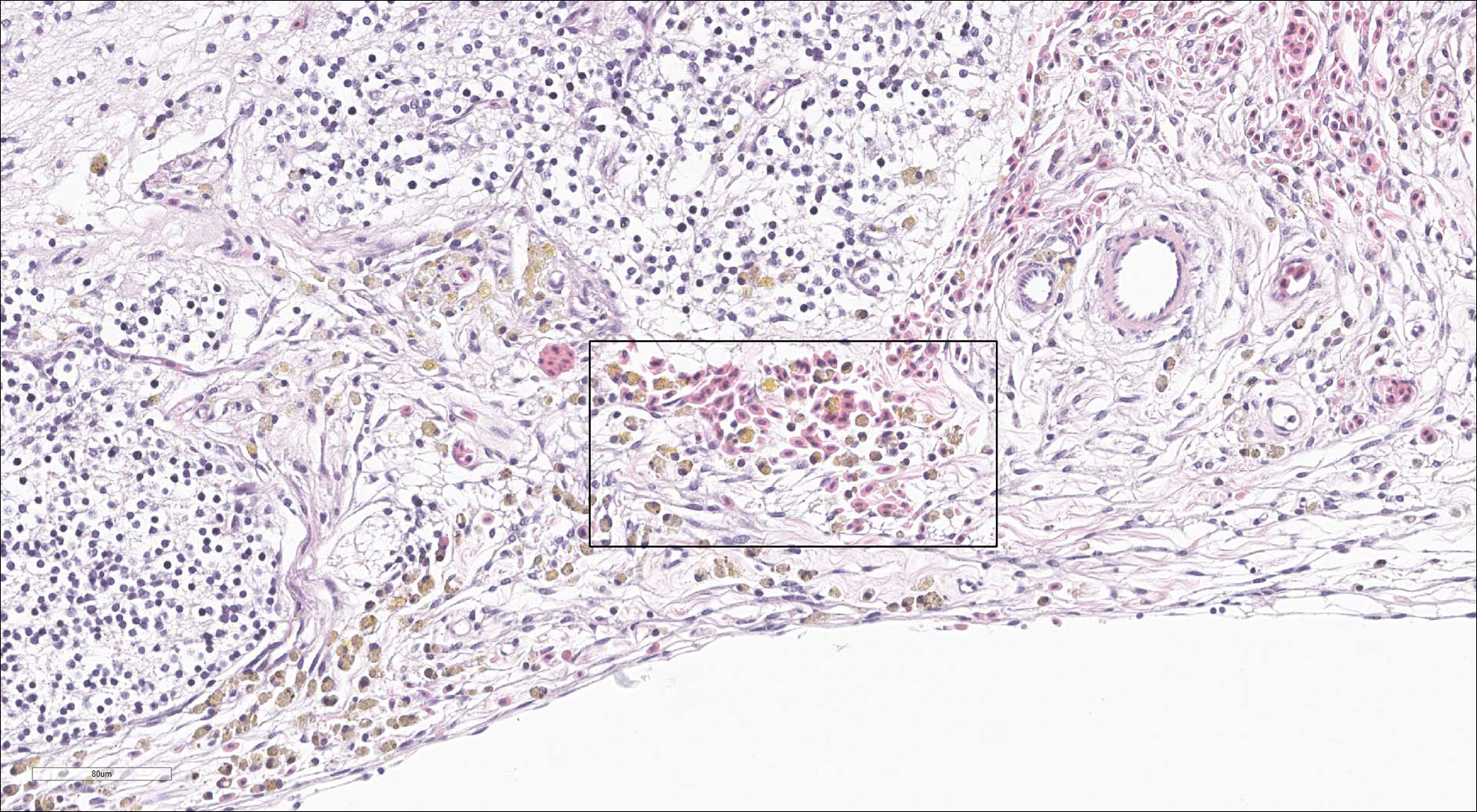
Figur 9: Hjerne. Blødning (boks).
Foto: Marianne Kraugerud
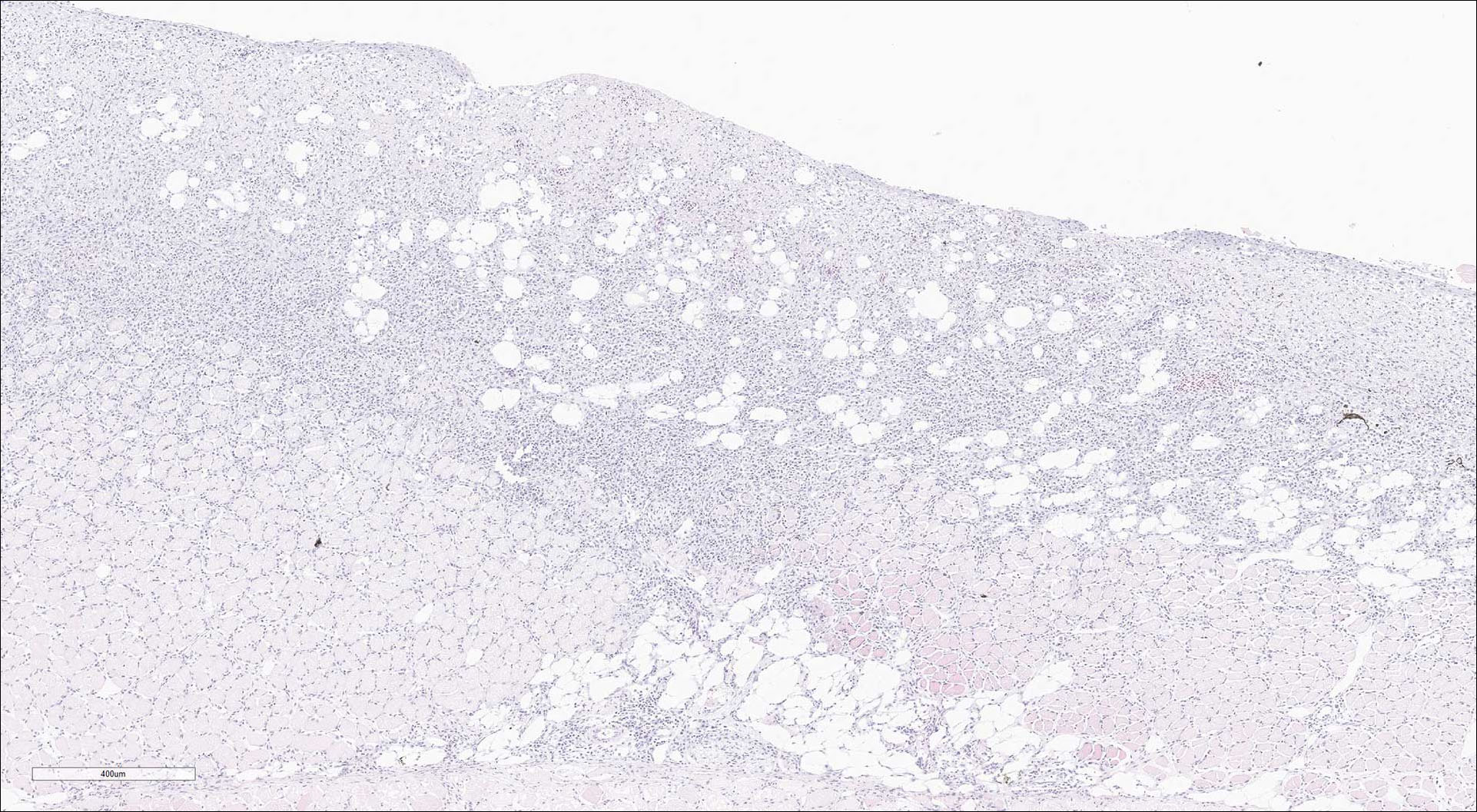
Figur 10: Hud og overfladisk skjelettmuskulatur. Uttalt, kronisk betennelse.
Foto: Marianne Kraugerud
Resultater
Bakterien Piscirickettsia salmonis ble påvist med PCR i alle analyserte vev fra lokalitet 1, 17/20 hjertevev lokalitet 2, og 6/20 hjertevev, 5/7 nyrer og 5/7 hudlesjoner fra lokalitet 3.
Materialet fra lokalitetene viste lignende histopatologiske forandringer (Figur 5-10). Flere fisker hadde multifokal nekrotiserende fibrinopurulent myokarditt og epikarditt. Betennelsen var av varierende alvorlighetsgrad, og noen fisker hadde fokalt ekstensive områder med suppurativ betennelse i hjertemuskulaturen. Flere fisker hadde fokalt ekstensive områder med suppurativ betennelse i levervevet (byller), hvorav noen viste kroniske forandringer som fibrose og kapseldannelse. Noen fisker hadde også multifokal levernekrose. I tillegg ble det funnet overfladiske belegninger på leveren med fibrin og nøytrofile granulocytter. Hudlesjoner, av varierende varighet, som involverte underliggende skjelettmuskulatur ble funnet hos flere fisker. Milde multifokale blødninger i underhuden og skjelettmuskulaturen ble også observert hos noen fisker. I hjernevevet var det betennelse og blødning med pigmentavleiring (mest sannsynlig hemosiderin). Gjelleforandringer var også utbredt. Dette inkluderte multifokal hyperplasi, betennelse i hyperplastisk vev, nøytrofil betennelse i filamentet og trombose i lameller. Betennelse i nyrekapselen ble observert hos noen fisker. I flere områder med betennelsesforandringer, inkludert milt, gjelle, hud og lever, ble det funnet kokkoide bakterier som i stor grad var intracellulære.
Diskusjon
De histopatologiske funnene viser alvorlige betennelsesforandringer og en kronisk systemisk bakterieinfeksjon. Funnene er i tråd med tidligere rapporter fra andre land (oppsummert i litteraturstudie (2)), og viser betydelig implikasjon for fiskens helse. Andre studier har også beskrevet patologiske forandringer i hjernevev med granulomatøs meningitt, tromber og uttalt hemoragisk meningoencephalitt (10,11). Patologiske forandringer kan også oppstå i pankreas, ovarier, testikler, øyne, pseudobranker og i tarmslimhinne (4,6). Bakterien sees vanligvis intracellulært i makrofager (6). Ved akutte tilfeller av piscirickettsiose kan det oppstå multifokale nekroser i det hematopoetiske vevet i nyrene, noe som kan resultere i anemi (2).
Diagnostisering krever påvisning av bakterien, sammen med makro- og mikroskopiske funn i fiskens organer. Påvisning av bakterien skjer vanligvis med PCR (12). Pharmaq Analytiq anbefaler PCR-prøver fra nyre, milt og lever. For histopatologi anbefales full organpakke for å vurdere grad og utbredelse av sykdommen. Det er også mulig å dyrke bakterien, men ettersom bakterien er fakultativ intracellulær, krever dette cellekultur, eller agar som inneholder cystein (13).
Konklusjon
Våre data viser tilfeller med piscirickettsiose hos oppdrettslaks på minst tre lokaliteter i Norge i 2024. Pharmaq Analytiq er kjent med flere tilfeller av piscirickettsiose påvist av annet laboratorium høsten 2024 (14), noe som viser en bekymringsfull trend. Sammenhengen med svært høye sjøtemperaturer (18 ˚C) i området og et historisk høyt lusepress kan nevnes som en mulig sammenheng og noe å være oppmerksom på for fremtiden. Det er ikke ønskelig med etablering av sykdommen i Norge og derfor viktig med overvåking og økt oppmerksomhet rundt piscirickettsiose.
Referanser
Mauel MJ, Miller DL. Piscirickettsiosis and piscirickettsiosis-like infections in fish: a review. Vet Microbiol 2002;87:279-89.
Rozas M, Enríquez R. Piscirickettsiosis and Piscirickettsia salmonis in fish: a review. J Fish Dis 2014;37:163-88.
Veterinærinstituttet. Piscirickettsiose. Oppdatert 16.01.2024. https://www.vetinst.no/sykdom-og-agens/piscirickettsiose (02.12.2024).
Branson EJ, Diaz-Munoz DN. Description of a new disease condition occurring in farmed coho salmon, Oncorhynchus kisutch (Walbaum), in South America. J Fish Dis 1991;14:147-56.
Fryer JL, Hedrick RP. Piscirickettsia salmonis: a Gram-negative intracellular bacterial pathogen of fish. J Fish Dis 2003;26:251-62.
Schäfer JW, Alvarado V, Enríquez R, Monrás M. The “Coho salmon syndrome”(CSS): a new disease in Chilean salmon, reared in sea water. Bull Eur Assoc Fish Pathol 1990;10:130.
Ibieta P, Tapia V, Venegas C, Hausdorf M, Takle H. Chilean salmon farming on the horizon of sustainability. Review of the development of a highly intensive production, the ISA crisis and implemented actions to reconstruct a more sustainable aquaculture industry. I: Sladonja B, ed. Aquaculture and the environment: a shared destiny. Rijeka: InTechOpen, 2011:215-46.
Rozas-Serri M. Why does Piscirickettsia salmonis break the immunological paradigm in farmed salmon? Biological context to understand the relative control of piscirickettsiosis. Front Immunol 2022;13:856896.
Miranda CD, Godoy FA, Lee MR. Current status of the use of antibiotics and the antimicrobial resistance in the Chilean salmon farms. Front Microbiol 2018;9:1284.
Skarmeta AM, Henríquez V, Zahr M, Orrego C, Marshall SH. Isolation of a virulent Piscirickettsia salmonis from the brain of naturally infected coho salmon. Bull Eur Assoc Fish Pathol 2000;20:261-4.
McCarthy U, Steiropoulos NA, Thompson KD, Adams A, Ellis AE, Ferguson HW. Confirmation of Piscirickettsia salmonis as a pathogen in European sea bass Dicentrarchus labrax and phylogenetic comparison with salmonid strains. Dis Aquat Organ 2005;64:107-19.
Aravena P, Pulgar R, Ortiz-Severín J, Maza F, Gaete A, Martínez S et al. PCR-RFLP detection and genogroup identification of Piscirickettsia salmonis in field samples. Pathogens 2020;9:358.
Makrinos DL, Bowden TJ. Growth characteristics of the intracellular pathogen, Piscirickettsia salmonis, in tissue culture and cell-free media. J Fish Dis 2017;40:1115-27.
iLaks. Sjelden sykdom påvist i Norge igjen. 20. november 2024. https://ilaks.no/sjelden-sykdom-pavist-i-norge-igjen/ (02.12.2024).