Spinal araknoidaldivertikkel hos hund
Artikkelen beskriver diagnostikk og behandling av en engelsk setter, intakt hannhund, 16 måneder gammel med bakbeinshalthet forårsaket av lumbosakral spinal araknoidaldivertikkel (SAD), sannsynlig Type 3. Forfatterne er ikke kjent med at lumbosakral SAD er rapportert hos hund. Denne kasuistikken understreker viktigheten av å inkludere spinaldivertikler som en differensialdiagnose også hos unge hunder med cauda equina syndrom og korsryggsmerter.
Spesialist i smådyrsykdommer, hund og katt, Evidensia Oslo Dyresykehus
Europeisk spesialist i kirurgi (DipECVS), MS i fysiologi, Evidensia Oslo Dyresykehus
Innledning
Spinal araknoidaldivertikkel (SAD) er fokal akkumulering av cerebrospinalvæske (CSF) i subaraknoidalrommet og kan føre til ryggmargskompresjon og påfølgende myelopati (1). Terminologien spinal araknoidalcyste er tidligere blitt brukt, men regnes som unøyaktig ettersom disse lesjonene mangler epitellag (2,3). SAD forekommer humant og hos selskapsdyr inkludert hund og katt (1,4-6). Denne tilstanden ansees som sjelden hos hund (7). Vanligst affiserte ryggmargssegmenter er de cervikale og torakolumbale (1,6,8-11). Etiologien er ukjent, men det er beskrevet kongenitale og ervervede årsaker (6,7,12). Kliniske tegn avhenger av lokalisering og kan inkludere proprioseptiv ataksi, hypermetri, øvre motornevron parese og fekal- og urinveisinkontinens (1,7).
Denne artikkelen beskriver diagnostikk og behandling av lumbosakral SAD, sannsynlig Type 3, hos en hund.
Kasuistikk
Anamnese
En engelsk setter, intakt hannhund på 16 måneder ble henvist for videre utredning grunnet halthet venstre bakbein. Halthet hadde oppstått akutt etter skitur seks uker tidligere og var innledningsvis beskrevet som 5/5 grader. Hunden hadde hofteleddsdysplasi (HD) grad D, etter klassifisering fra Norsk Kennel Klub (NKK), og var ifølge eier svært aktiv. Allmenntilstanden var god, og appetitt, urinering og defekering var uten avvik. Konservativ behandling med hvile ble forsøkt og hunden ble da haltfri, men fikk tilbakefall etter aktivitetsøkning. Ved klinisk undersøkelse etter en uke var hunden uten tegn til halthet eller nevrologiske avvik, men viste tydelig tegn på smerte ved ekstensjon av venstre hofte. Behandling ble igangsatt med meloksikam (Metacam®, Boehringer Ingelheim) 0,1 mg/kg po sid i 14 dager samt ro, og det ble foretatt kontroller to og fire uker etter innledende undersøkelser. Ved første kontroll var det ingen tegn til bedring. Hunden var haltfri i ro og etter hvile, men haltet etter aktivitet. Betydelig smerte ble fremdeles utløst ved ekstensjon av venstre hofte. Røntgen ble tatt av hofter (ventrodorsal projeksjon) og lumbale og sakrale columna (lateral og ventrodorsal projeksjon), som viste HD og tegn til Morgans linje (krumlinjet osteofyttdannelse kaudolateralt på lårhalsen) forenelig med degenerativ leddsykdom (DJD) (Figur 1). Hunden ble deretter forsøksvis behandlet med annet ikke-steroid antiinflammatorisk legemiddel (NSAID), firokoksib (Previcox®, Boehringer Ingelheim Vetmedica GmbH) 7 mg/kg po sid i 14 dager. Ved andre kontroll var det fremdeles ikke tegn til klinisk bedring og hunden ble henvist for videre utredning.
Klinisk undersøkelse
Ved klinisk undersøkelse viste hunden god allmenntilstand og normalt hold med vekt 25 kg. Mental status ble vurdert som normal, uten tegn til kranialnerveavvik. Hjertefrekvensen var 96/min, lik femoralispulsen som var jevn, fyldig og rytmisk. Respirasjonsfrekvensen var 20/min og lungelyder var normale ved auskultasjon thorax, uten bilyd fra hjertet. Buken var myk og indolent ved palpasjon. Rektaltemperaturen var 38,4 °C. Ved mønstring var hunden ikke halt i skritt, trav eller galopp. Det var ingen tegn til ataksi, men hunden viste tegn til noe stiv bakbeinsgange i form av bred bakbeinsstilling i trav. Videre undersøkelse av bevegelsesapparatet ble utført. Det var ikke tegn til smerte ved dorso-, ventro- eller sidefleksjon av nakke, ved palpasjon av columna eller ved dorso- eller sidefleksjon av halen. Frambeina hadde god og symmetrisk muskelfylde med normal propriosepsjonsrefleks. Tilbaketrekningsrefleks og m. exstensor carpi radialis refleks var også normale. Alle frambeinsledd hadde god bevegelighet og var uten tegn til smerte ved fleksjon eller ekstensjon. Bakbeina viste mildt muskelsvinn over lår bilateralt. Palpasjon av m. iliopsoas var uten smerte. Propriosepsjonsrefleks, tilbaketrekningsrefleks, m. tibialis cranialis refleks, patellarrefleks og perinealrefleks var normale. Fleksjon og ekstensjon av tær, haser og knær var uten tegn til smerte og uten tegn til leddfylning ved palpasjon. Knær hadde negativ kranial skuffebevegelse og negativ tibial kompresjonstest. Ved ekstensjon av høyre hofte ble det påvist redusert bevegelighet da den kunne ekstenderes til cirka 75 grader, noe som utløste moderat smertereaksjon. Ved forsøk på ekstensjon av venstre hofte ble det umiddelbart utløst kraftig smertereaksjon med beinet kun ekstendert til cirka 15 grader.
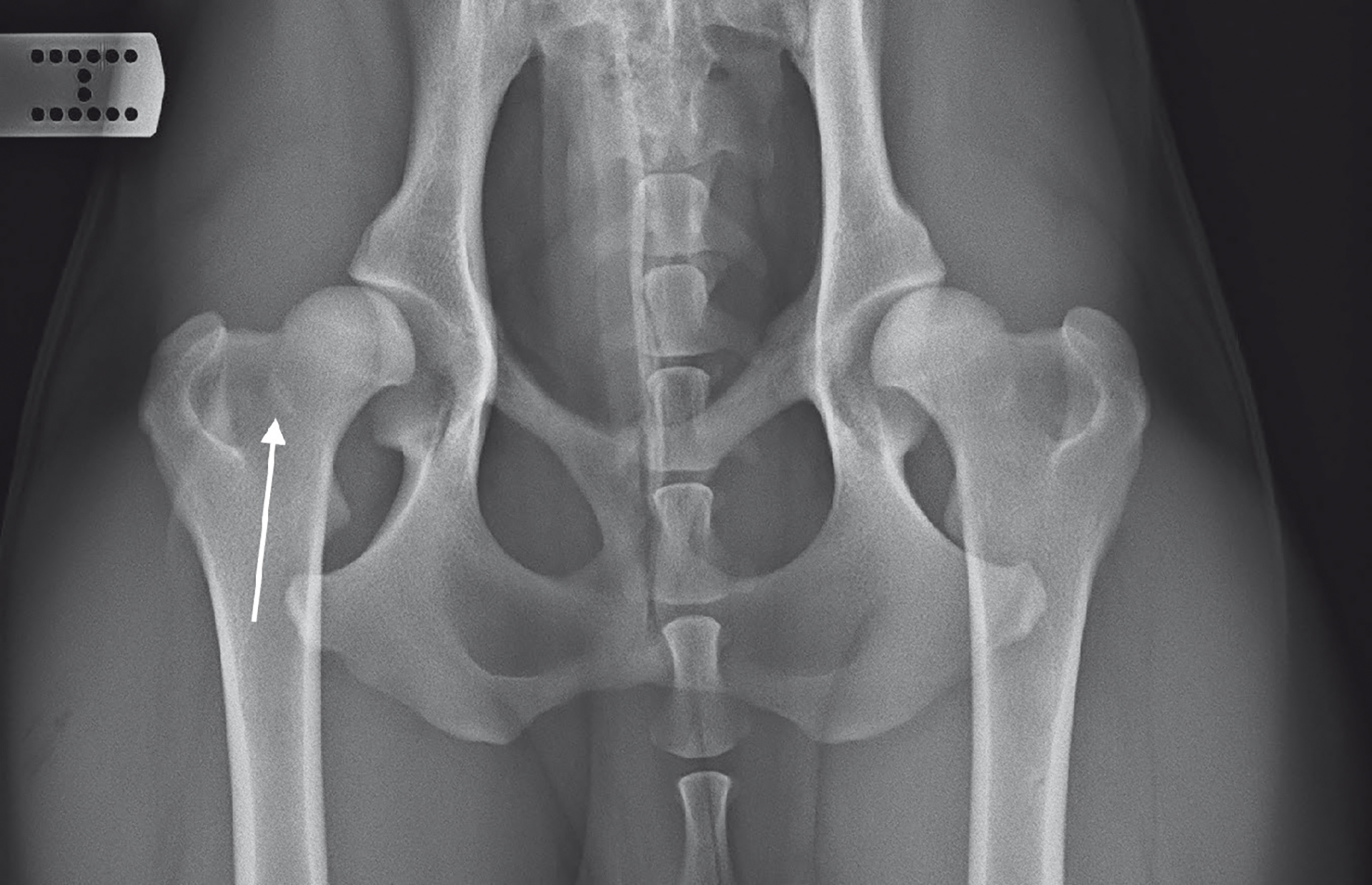
Figur 1. Morgans linje (hvit pil) forenelig med degenerativ leddsykdom (DJD).
Foto: Evidensia Åssiden Dyreklinikk.
Diagnostisk plan
Det ble på bakgrunn av anamnese og klinisk undersøkelse anbefalt magnetresonanstomografi (MRI) av lumbosakrale rygg og hofter.
Bildediagnostikk og diagnose
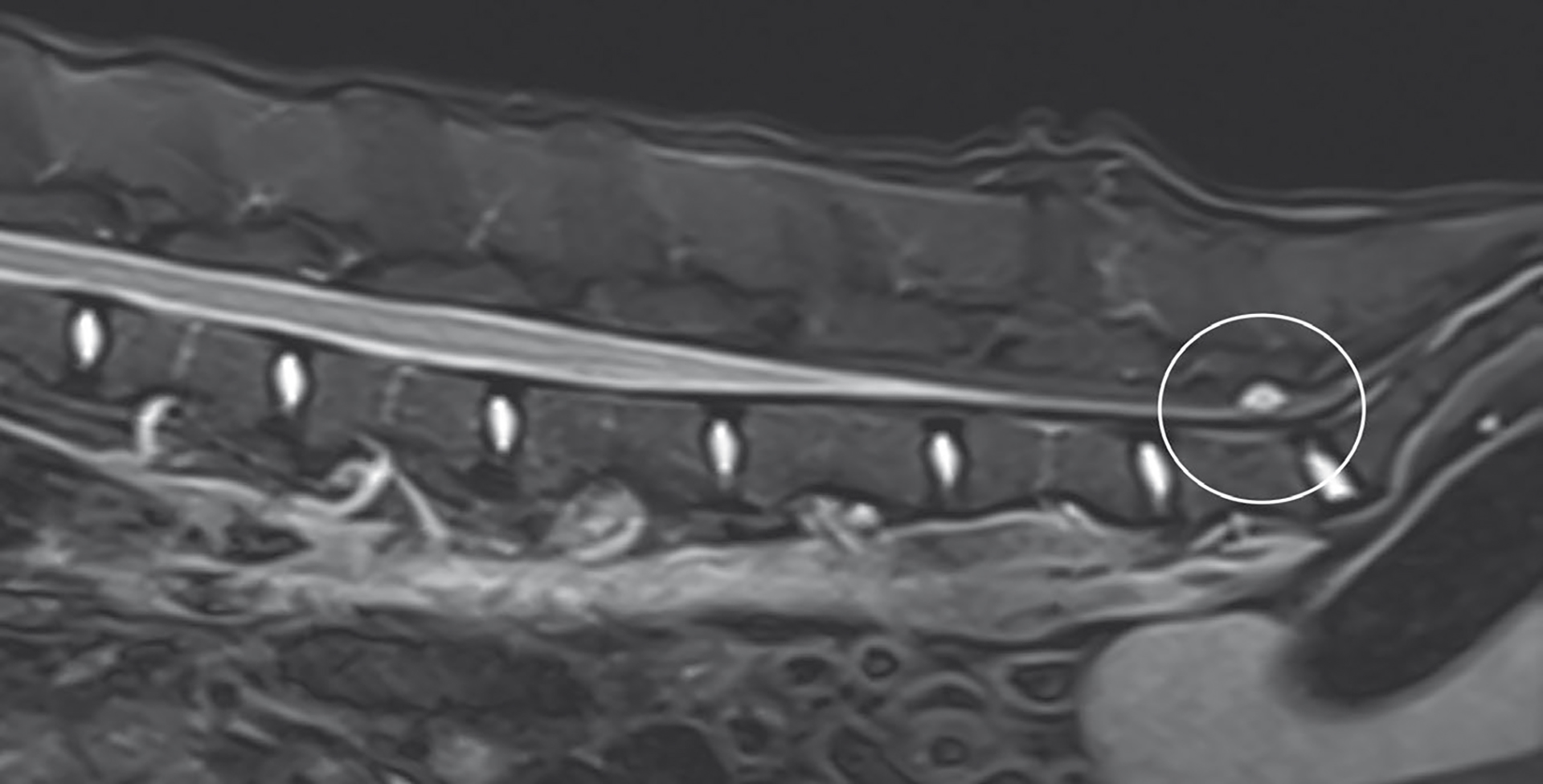
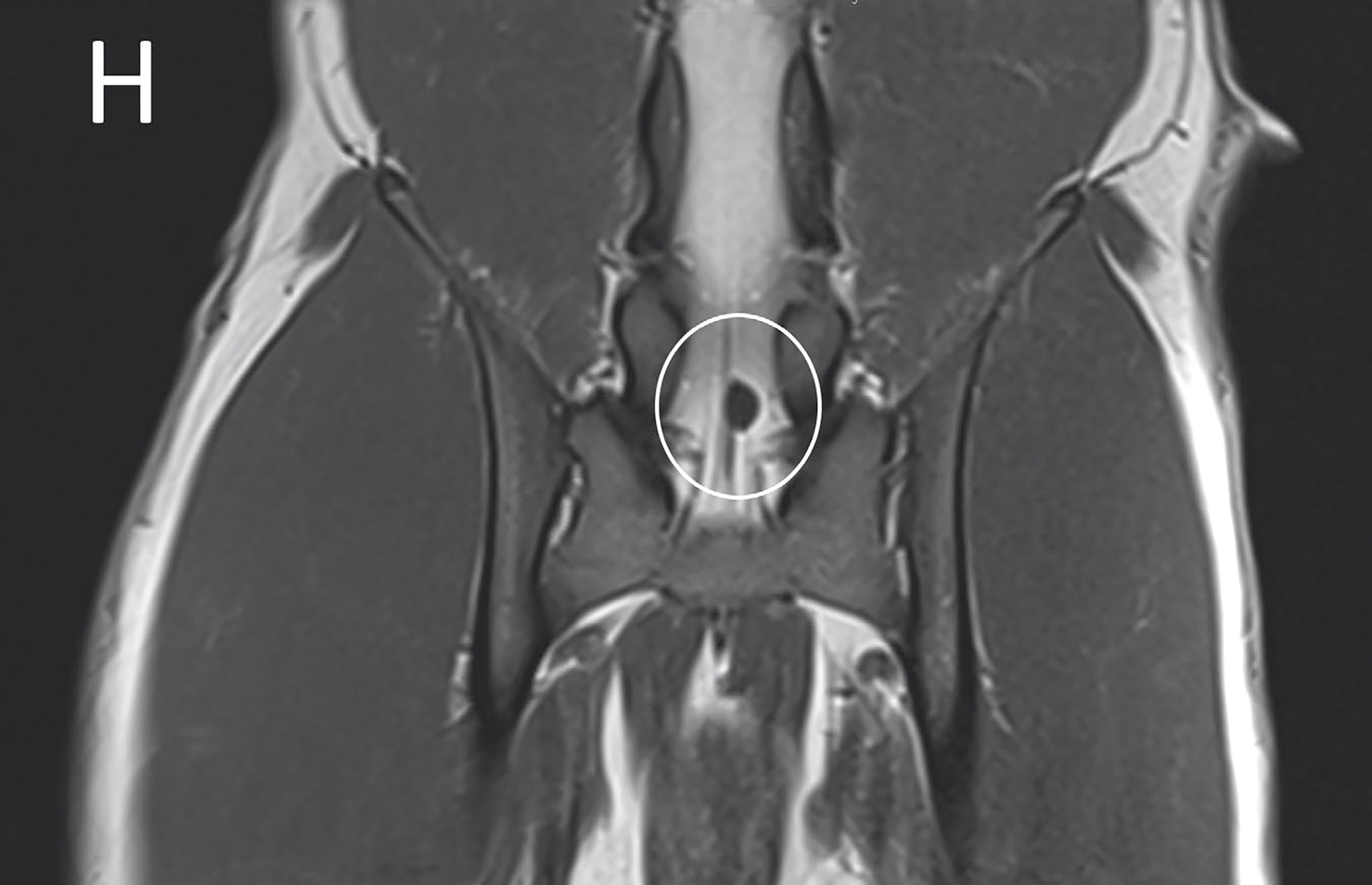
Ekstern avlesning av MRI viste cystisk struktur på 0,7 cm x 0,5 cm dorsalt i lumbosakrale vertebralkanal forenelig med intradural SAD, sannsynlig Type 3 (Figur 2), med mild venstresidig lateralisering (Figur 3). Kaudale torakal- og lumbalkolumna var uten anmerkning. Hofteleddene var mildt sublukserte, uten økt T2-signal rundt pelvismuskulaturen.
Figur 2. Cystisk struktur (hvit sirkel) dorsalt i lumbosakrale vertebralkanal.
Foto: Gjengitt med tillatelse fra VetLabs.
Figur 3. Cystisk struktur (hvit sirkel) med mild venstresidig lateralisering i lumbosakrale vertebralkanal.
Foto: Gjengitt med tillatelse fra VetLabs.
Behandling
Diagnosen SAD, sannsynlig Type 3, med mild venstresidig lateralisering lokalisert dorsalt i venstre cauda equina, ble ansett som sannsynlig årsak til smerte og halthet lokalisert til venstre bakbein. Det ble anbefalt kirurgisk behandling med dorsal laminektomi og durotomi eller durektomi. Kirurgisk prosedyre, oppfølging, mulige intra- og postoperative komplikasjoner samt prognose ble gjennomgått med eier som samtykket til videre behandling.
Preoperative undersøkelser
Det ble utført generell klinisk undersøkelse preoperativt. Det ble tatt blodprøve (klinisk kjemi og hematologi) som viste, med unntak av glukose, resultater innenfor normale referanseintervaller. Blodglukosen var 9,67 mmol/L (øvre referansegrense for denne analysemetoden:7,95 mmol/L). Resultatet ble vurdert som et mildt avvik og ble ikke tillagt klinisk betydning. Hunden ble klassifisert som ASA (American Society of Anesthesiologists)-klasse 1.
Operasjon
Pasienten ble sedert med medeto-midin (Domitor vet®, Orion) 12 µg/kg og metadon (Insistor®vet, VetViva Richter) 0,2 mg/kg im og ble tilført isoton elektrolyttoppløsning (Ringer-acetat, Fresenius Kabi Norway AS) 10 mg/kg/time iv. Anestesien ble indusert med propofol (PropoVetTM, Zoetis) 1,2 mg/kg iv. Pasienten ble intubert med Sheridan® tube størrelse 10 og lagt på ventilator med trykk på 20 cmH2O. Anestesien ble vedlikeholdt med isofluran (Isofluran®, Baxter) 1,5 %. Pasienten ble premedikert med cefalotin (Cefalotin Navamedic®, Navamedic ASA) 20 mg/kg iv og robenakoksib (Onsior®, Elanco) 1mg/kg. Under inngrepet ble pasienten behandlet med fentanyl (Fentadon® vet, Eurovet) 3-10 µg/kg/time iv.
Etter aseptisk forberedelse ble det lagt lokalbedøvelse dorsalt over intervertebralområdet L7/S1 med lidokain (Lidokain Mylan®, Mylan) 1 mg/kg. Dorsal midtlinjedisseksjon ble utført ned til L7/S1, etterfulgt av dorsal laminektomi som avdekket cauda equina (i kaudale halvdel av L7 og kraniale halvdel av S1). Fettvev ble forsiktig fjernet og en cystisk lesjon ble identifisert dorsalt og kraniolateralt mot venstre side. Durektomi ble utført og det ble gjennomført grundig undersøkelse med ytterligere fjerning av fettvev rundt nerverøtter uten at det ble identifisert videre tegn til cystevev. Området ble skyllet med isoton elektrolyttoppløsning (Natriumklorid 9 mg/mL, Fresenius Kabi Norway AS). Morfinepidural (Morfin Epidural®, Orifarm Healthcare) 0,1 mg/kg ble påført lokalt før fascien ble lukket med 2-0 polydioxanone (PDS®). Lokalbedøvelse med bupivakainhydroklorid (Marcain®, Aspen) 0,2 mg/kg ble påført før subkutant vev ble suturert med 2-0 polydioxanone (PDS®) og intrakutant vev ble suturert med 2-0 poliglecaprone 25 (Monocryl®).
Postoperativ behandling
Oppvåkning fra narkosen foregikk uten komplikasjoner. Pasienten ble oppstallet i ett døgn for monitorering og støttebehandling. Den var urolig og virket noe kvalm på ettermiddagen etter operasjonen og ble behandlet med trazodone (Apo-Trazodone®, Apotex Inc.) 5 mg/kg po og prevomax (Maropitant®, Dechra) 1 mg/kg iv. Postoperativ behandling utover dette var smertelindring med metadon (Insistor®vet, VetViva Richter) 0,2 mg/kg im hver fjerde time. Intravenøs væske ble seponert på kvelden da pasienten kviknet til, spiste med god appetitt og urinerte som normalt. Dagen etter operasjonen framsto pasienten som vedvarende kvikk. Den var noe stiv når den reiste seg, men gikk deretter i skritt og trav uten tegn til halthet. Propriosepsjonsrefleks, tilbaketrekningsrefleks, m. tibialis cranialis refleks, patellarrefleks og perinealrefleks var normale. Pasienten ble sendt hjem på behandling med firokoksib (Previcox®, Boehringer Ingelheim Vetmedica GmbH) 7 mg/kg po sid i 14 dager og tramadol (Tralieve® vet, Dechra) 2,4 mg/kg po to til tre ganger daglig i fem dager. Det ble anbefalt rolige turer i bånd de første fire ukene, for deretter gradvis økning i turlengde med fem minutter i uken fram til kontroll etter seks uker. Det ble anbefalt oppstart fysioterapi etter en uke.
Kontroll seks uker postoperativt
Eiers vurdering var at det hadde gått bra med hunden etter operasjonen. Det hadde ikke blitt sett tegn til halthet og mønstring viste ikke tegn til halthet i skritt, trav eller galopp. Hunden hadde noe stiv bakbeinsgange i form av bred bakbeinsstilling i trav, noe som også var synlig før operasjonen. Propriosepsjonsrefleks, tilbaketrekningsrefleks, m. tibialis cranialis refleks, patellarrefleks og perinealrefleks var normale. Det var ingen smerte forbundet med palpasjon av columna. Det ble påvist noe stivhet ved ekstensjon av begge hofter, da spesielt venstre, men full ekstensjon var mulig. Progresjonen ble oppfattet som god og det ble anbefalt gradvis opptrening over de neste fire ukene. Det ble anbefalt fôring med Hills® j/d.
Kontroll seks måneder postoperativt
Siden forrige kontroll hadde aktivitetsnivået gradvis blitt økt og eier opplevde at hunden fungerte bra uten tegn til halthet eller stivhet, med unntak av én episode. Stivhet hadde oppstått tidlig i forløpet etter å ha løpt i full spurt etter sykkel i cirka15 minutter. Hunden var merkbart stiv i bakbena dagen etter hendelsen, men kom seg innen et par dager uten behandling. Kliniske tegn ble mistenkt å kunne relateres til HD og det ble valgt å starte behandling med bedinvetmab (Librela®, Zoetis). Hunden ble siden dette beskrevet som svært aktiv og ble luftet tre ganger om dagen som inkluderte kontrollerte 5-9 km løpeturer (uten å trekke i bånd) tre ganger i uken. Den hadde også blitt sluppet i hundepark for korte løpeturer uten tegn til halthet eller stivhet etter hvile. Innen besøket hadde pasienten fått to behandlinger med bedinvetmab (Librela®, Zoetis) 0,6 mg/kg sc, og det var seks uker siden forrige behandling. Eier merket ikke tydelig forskjell i bevegelsesmønster med eller uten behandling. Ved mønstring ble det sett noe stiv bakbeinsgange i trav som tidligere. Propriosepsjonsrefleks, tilbaketrekningsrefleks, m. tibialis cranialis refleks, patellarrefleks og perinealrefleks var normale. Det var ingen smerte forbundet med palpasjon av columna. Det ble fremdeles påvist noe stivhet ved full ekstensjon av begge hofter, noe som utløste mild grad av smerte. Det ble diskutert videre behandling med bedinvetmab (Librela®, Zoetis), noe eier ønsket å avvente ettersom hunden fungerte bra i hverdagen. Eier ønsket å teste ut en rolig opptrening til jakt og starte behandling igjen ved behov.
Diskusjon
Kongenitale og ervervede kategorier av SAD er beskrevet (6). En hypotese er at araknoidal proliferasjon danner en enveisventil som tillater CSF å strømme inn i et område som respons på trykkendringer i CSF, men ikke ut igjen (6,7,12). Dette fører til gradvis utvidelse og kompresjon av ryggmargen, noe som kan støtte opp om kongenital etiologi til tross for aldersspenn for utvikling av kliniske tegn (7). Ervervede årsaker til SAD er blitt foreslått å kunne oppstå sekundært til skiveprolaps, ryggmargstraume og inflammatorisk ryggmargsykdom (1,6,7).
Klassifisering av meningeale divertikler er tilpasset fra humanmedisin (6,7,13). Type 1 SAD er ekstradural uten involvering av nerverøtter. Type 2 SAD er ekstradural med involvering av nerverøtter, og Type 3 SAD er intradural (14). Hos hund er hovedsakelig Type 3 SAD rapportert (1,3,6,8-10,13,15,16), og var mistenkt hos pasienten i denne kasuistikken. Det finnes også ekstradurale cyster som ikke er meningeale og betegnes som synovial- og ganglioncyster (6).
SAD kan forekomme langs hele ryggraden, men sees oftest cervikalt hos store hunderaser og torakolumbalt hos små hunderaser (1,6). De fleste lesjonene (83 % -90 %) er lokalisert dorsalt eller dorsolateralt i ryggmargen (1,6,13). De er oftest enkeltstående, men multiple divertikler er blitt beskrevet og i noen tilfeller kan de være forgrenet (8). Pasienten i denne kasuistikken hadde en enkel SAD lokalisert dorsalt med mild venstresidig lateralisering, noe som samsvarer med tidligere publiserte funn. Kaudal lumbal og lumbosakral lokalisering er derimot svært uvanlig. Kaudal lumbal (L6-L7) SAD er beskrevet hos to franske bulldogger i en kasuistikk fra 2018 uten at dette tidligere er rapportert (17). Ekstradural synovialcyste lokalisert lumbosakralt er beskrevet hos tre schæferhunder i 2016 (18). Store, eldre hunderaser er overrepresentert når det gjelder torakolumbale og lumbosakrale synovialcyster (median alder på 84 måneder i tre studier) og er forbundet med degenerasjon av ryggradens fasettledd. (18,19,20). I noen av disse tilfellene er det også påvist overgangsvirvel (”lumbal transitional vertebrae”, LTV) (20), noe som har vist seg å være forbundet med høyere grad av lumbosakral sykdom (21). Forfatterne er ikke kjent med at intradural lumbosakral SAD, som var mistenkt hos pasienten i denne kasuistikken, er beskrevet hos hund i litteraturen.
Mops, rottweiler og fransk bulldog er rasene vanligst affisert og kan indikere genetisk predisposisjon (1,3,8,9,11,12,15,22). Pasienten i denne kasuistikken var en engelsk setter hannhund. Hannhunder er overrepresentert (1,3,22). Årsaken til det er ukjent og det er foreløpig uklart hvilken rolle hormoner spiller i utvikling av SAD (7,13). Gjennomsnittsalder ved presentasjon av kliniske tegn i en stor retrospektiv studie var 36 måneder (1), mens en mindre studie viste at hunder med cervikal SAD var yngre med gjennomsnittsalder på 31 måneder, sammenliknet med 74 måneder for hunder med torakulumbal SAD (16). Til sammenlikning var pasienten i denne kasuistikken 16 måneder ved presentasjon.
Det er ukjent hvilken rolle samtidig spinalsykdom spiller ved diagnosetidspunktet for SAD, og om SAD er hovedårsaken til kliniske tegn eller om andre sykdomsprosesser også bidrar (7). En studie viste at 21,3 % av hundene, hovedsakelig mops (33,3 %) og fransk bulldog (61,5 %), hadde nevrologisk sykdom diagnostisert i samme eller nærliggende område (1). En annen studie viste at 11,3 % av franske bulldogger hadde SAD som hovedårsak til nevrologiske tegn, mens samtidig spinalanomali ble identifisert hos 64 % av SAD tilfellene (11). I en studie om mopser med torakolumbal SAD, hadde 58 % skiveprolaps i samme eller nærliggende område (22). Disse funnene kan tyde på at samtidig spinalsykdom kan spille en rolle i SAD-utvikling, og at predisposisjon hos enkelte raser kan være relatert til høyere forekomst av nærliggende segmentsykdom sammenliknet med andre raser (1,7,11,22). Samtidig spinalsykdom kan inkludere skiveprolaps, vertebrale misdannelser, spinal stenose, fibrokartilaginøs emboli eller myelitt av ukjent opprinnelse (1). Syringomyeli er i to studier påvist hos 50 % av hunder med SAD (23), hos 58,3 % av hunder med cervikalt SAD og hos 82 % av hunder med torakolumbalt SAD (12). Pasienten i denne kasuistikken hadde ingen annen kjent ryggmargssykdom, men hadde HD grad D.
Kliniske tegn avhenger av lesjonens lokalisering og er som regel sakte progredierende, uten tegn til smerte (6). Hos hunder med SAD kan kliniske tegn avvike noe fra andre ryggmargssykdommer grunnet dorsal lokalisering av det fleste lesjonene (1). Det vanligste kliniske tegnet i en studie (1) var proprioseptiv ataksi, påvist hos 92,6 % av pasientene. I samme studien hadde 21,3 % av pasientene hypermetri. Parese er mindre vanlig og kan ofte relateres til samtidig spinalanomali (7). Øvre motornevrons fekalinkontinens og/eller urinveisinkontinens rapporteres oftest hos hunder med torakolumbale lesjoner (7,13), med en totalforekomst på 8 % - 8,2 % (1,13). Til sammenlikning presenterte pasienten i denne kasuistikken med venstre bakbeinshalthet og hovedfunn ved klinisk undersøkelse var smerte samt kraftig redusert bevegelse ved ekstensjon av venstre hofte. Dette er ikke typiske funn for hunder med SAD, men reflekterer lumbosakral lokalisering av lesjonen og utvikling av påfølgende cauda equina syndrom.
Bildediagnostikk med myelografi, CT- myelografi eller MRI er nødvendig for å stille SAD diagnosen (6,8,13). Typiske funn beskrevet ved myelografi og CT- myelografi er dilatert tåreformet ansamling av kontrast i subaraknoidalrommet som kan føre til fokal ryggmargskompresjon (1,8,9). MRI ansees som den foretrukne bildemodaliteten fordi den tillater vurdering av ryggmargsparenkymet og kan fange opp komorbiditeter som ødem, syringomyeli og adheranser (6,8,13). På MRI vises SAD som en T2-vektet (T2W) hyperintens, T1-vektet (T1W) hypointens, ”fluid attenuated inversion recovery” (FLAIR) hypointens utvidelse av subaraknoidalrommet forenelig med CSF, og kan ha det karakteristiske tåreformede utseende på sagittale bilder, likt det som er sett ved myelografi og CT- myelografi (7). Bruk av høyfelts MRI kan gi ytterligere bildesekvenser og kan være nyttig for å fastsette omfanget av SAD (24,25). En studie som brukte sekvensen ”half-fourier acquisition single-shot turbo spin-echo pulse” (HASTE) viste mer enn en dobling av SAD-diagnoser sammenliknet med T2W sekvens alene (24). En annen studie som brukte sekvensen ”3D constructive interference in steady state” (3D-CISS) økte også påvisning av SAD og ble foretrukket over HASTE grunnet færre artefakter, bedre differensiering mellom CSF og ryggmarg, samt evne til å fange opp araknoidale adheranser (25). MRI ble utført for videre diagnostikk hos pasienten i denne kasuistikken og ekstern avlesning viste cystisk struktur på 0,7 cm x 0,5 cm dorsalt i lumbosakrale vertebralkanal, med mild venstresidig lateralisering (Figur 3). Bildeoppløsningen i dette tilfellet gjorde det vanskelig å avgjøre om lesjonen var intradural eller ekstradural. Forstyrrelse av det reduserte signalet til cauda equina på nivå med den cystiske lesjonen, økt T2W signal på nivå med nerveroten og mangel på nerverotsforskyvning indikerte at lesjonen sannsynlig var intradural. Ytterligere diagnostikk som kan støtte opp om diagnosen og utelukke annen patologi inkluderer CSF-analyse og histopatologi (7). CSF er imidlertid ofte normal (1,7,13). Histopatologi av kirurgisk fjernet divertikkel viser fravær av epitellag og vanligvis fibrose og bindevevsproliferasjon (1,3,6-9). Histologi av divertikkel ble ikke utført hos pasienten i denne kasuistikken da vevet ble utilsiktet ødelagt ved fjerning.
Behandling er i hovedsak kirurgisk for å oppnå dekompresjon av ryggmargen (6,7,10,13,22,26). Avhengig av lokalisering av SAD kan teknikker involvere hemilaminektomi, dorsal laminektomi og ”ventral slot” som utføres sammen med prosedyrer som durektomi, marsupialisering, durotomi, shuntplassering og vertebral stabilisering (26). En studie sammenliknet medisinsk og kirurgisk behandling og utfall hos 96 hunder (10). Medisinsk behandling ble gitt til 52 % av hundene, hvorav prednisolon ble brukt som førstevalg hos 44/50 hunder. Median oppfølging ved 16 måneder viste at 26 % forbedret seg på prednisolon. Median oppfølging ved 23 måneder viste derimot at 84 % forbedret seg etter kirurgisk behandling og støtter kirurgi som foretrukket behandling hos pasienter med SAD. En studie rapporterte kirurgiske teknikker brukt ved singel torakolumbal SAD hos 57 hunder og umiddelbar, samt kortsiktig utfall mellom teknikkene (26). Innen 3-5 uker postoperativt viste 84 % av hundene bedring og det ble ikke sett betydelig forskjell på kirurgiske teknikker. Alvorlige kirurgiske komplikasjoner var sjeldne. En viktig faktor ved behandling av SAD er risikoen for tilbakefall og reformering av divertikkelen postoperativt (26). En studie rapporterte tilbakefall av kliniske tegn hos 25 % av pasientene uten kjent årsak, grunnet begrenset langtidsoppfølging (16). En annen studie om sent tilbakefall av nevrologiske tegn etter SAD kirurgi inkluderte syv hunder og en katt (27) viste en median tid for tilbakefall på 20,5 måneder. 3/8 pasienter viste reformering av SAD, mens de resterende pasientene opplevde tilbakefall av kliniske tegn som ikke var relatert til SAD. En studie om kort- og langtidsoppfølging av 25 mopser etter SAD kirurgi (22) viste at 80 % hadde vellykket kortsiktig postoperativt utfall (6 måneder), mens 86 % viste forverring på lang sikt (12 måneder eller mer). Studien viste at mops har generelt dårlig langtidsprognose, sannsynligvis relatert til andre patofysiologiske mekanismer, da de er eldre ved diagnosetidspunktet og har høy grad av samtidig spinalsykdom (22). Hos pasienten i denne kasuistikken ble det utført dorsal laminektomi i tillegg til durektomi. Den kom seg raskt etter inngrepet og hadde ikke hatt ytterligere tegn til venstre bakbeinshalthet innen oppfølging ved seks måneder. Pasienten hadde hatt en episode med stivhet i bakbein etter intens aktivitet som var mistenkt relatert til HD, men som opphørte etter et par dager uten behandling. Den ble senere gitt bedinvetmab (Librela®, Zoetis) og hadde hatt to behandlinger innen seks måneder, uten at eier merket forskjell i bevegelsesmønsteret. Venstre hofte hadde betydelig bedre bevegelighet ved de kliniske undersøkelsene, samtidig som pasienten var mildt stiv ved full ekstensjon av begge hofter, noe som var mistenkt å kunne relateres til HD.
Sammendrag
En 16 måneder gammel engelsk setter uten samtidig nærliggende spinalsykdom ble diagnostisert med svært uvanlig lokalisering av en cystisk struktur lumbosakralt. De fleste meningeale cyster hos hund er klassifisert som Type 3 spinal araknoidaldivertikkler (SAD) og er intradurale (1,6,8-10). Det er også rapportert ekstradurale cystiske strukturer hos hund som ikke er meningeale: synovialcyster eller ganglioncyster. Disse lesjonene forekommer hovedsakelig i den cervikale eller torakolumbale delen av ryggraden (1,6,18-20). Rasene rottweiler, fransk bulldog og mops er overrepresentert når det gjelder Type 3 SAD. Hos fransk bulldog og mops er det også påvist høy grad av samtidig spinalsykdom, noe som kan spille en rolle for ervervet utvikling (1,7,11,22).
Hos denne pasienten ga MRI mistanke om Type 3 SAD grunnet forstyrrelse av det reduserte signalet til cauda equina på nivå med den cystiske lesjonen, økt T2W signal på nivå med nerveroten og mangel på nerverotsforskyvning. Ung alder og mangel på nærliggende segmentsykdom i ryggraden gjorde diagnosene synovial- eller ganglioncyste mindre sannsynlig, men mangel på histopatologi av den fjernede lesjonen var begrensende for diagnostikken. Kliniske tegn (venstre bakbeinshalthet, betydelig redusert bevegelighet og kraftig smerte ved forsøk på ekstensjon av venstre bakbein), samsvarte med anatomisk lokalisering av lesjonen. Pasienten responderte godt på kirurgisk fjerning av den cystiske strukturen og var ved oppfølging etter seks måneder uten tegn til halthet. Det ble imidlertid fortsatt vurdert mild stivhet og smerte i forbindelse med full ekstensjon av begge hofter, noe som var mistenkt å kunne relateres til HD.
Summary
A 16-month-old English Setter without concurrent spinal disease was diagnosed with a lumbosacral cystic structure, which is considered a rare localization. Most meningeal cysts in dogs are classified as Type 3 spinal arachnoid diverticula (SAD) and are intradural (1,6,8-10). Non-meningeal extradural cystic structures are also reported in dogs such as synovial cysts and ganglion cysts. These lesions mainly occur in the cervical and thoracolumbar spine (1,6,18-20). Overrepresented breeds for Type 3 SAD include Rottweilers, French Bulldogs and Pugs. In the French Bulldog and Pug there has also been shown a high degree of concurrent spinal disease which may play a role in acquired development (1,7,11,22).
In this patient, Type 3 SAD was suspected from MRI which showed disruption of the decreased signal of the cauda equina at the level of the cystic lesion, increased T2W signal at the level of the nerve root and lack of nerve root displacement. Young age and the abscence of concurrent segmental spinal disease made the diagnosis of a synovial or ganglion cyst less likely; however, the lack of histopathology of the removed lesion was a limiting factor for diagnosis. Clinical signs (left hindlimb lameness, significantly reduced range of motion and severe pain when attempting to extend the left hindlimb) were consistent with the anatomical localization of the lesion. The patient responded well to surgical removal of the cystic structure and was without lameness at six-month follow-up. There was however still mild stiffness and pain on full extension of both hips, which was suspected to be related to hip dysplasia.
Etterskrift
Takk til Evidensia Åssiden Dyreklinikk for henvisning av pasienten. Takk til Tony Pease, amerikansk spesialist i radiolog (DipACVR) ved VetLabs for MRI bilder brukt i artikkelen.
Referanser
Mauler DA, De Decker S, De Risio L, Volk HA, Dennis R, Gielen I et al. Signalment, clinical presentation, and diagnostic findings in 122 dogs with spinal arachnoid diverticula. J Vet Intern Med 2014;28:175-81.
Parker AJ, Adams WM, Zachary JF. Spinal arachnoid cysts in the dog. J Am Anim Hosp Assoc 1983;19:1001-8.
Jurina K, Grevel V. Spinal arachnoid pseudocysts in 10 rottweilers. J Small Anim Pract 2004;45:9-15.
Shamir MH, Shahar R, Aizenberg I. Subarachnoid cyst in a cat. J Am Anim Hosp Assoc 1997;33:123-5.
Galloway AM, Curtis NC, Sommerlad SF, Watt PR. Correlative imaging findings in seven dogs and one cat with spinal arachnoid cysts. Vet Radiol Ultrasound 1999;40:445-52.
Lowrie ML, Platt SR, Garosi LS. Extramedullary spinal cysts in dogs. Vet Surg 2014;43:650-62.
Smith CJ, Guevar J. Spinal subarachnoid diverticula in dogs: a review. Can Vet J 2020;61:1162-9.
Rylander H, Lipsitz D, Berry WL, Sturges BK, Vernau KM, Dickinson PJ et al. Retrospective analysis of spinal arachnoid cysts in 14 dogs. J Vet Intern Med 2002;16:690-6.
Gnirs K, Ruel Y, Blot S, Begon D, Rault D, Delisle F et al. Spinal subarachnoid cysts in 13 dogs. Vet Radiol Ultrasound 2003;44:402-8.
Mauler DA, De Decker S, De Risio L, Volk HA, Dennis R, Gielen I et al. Spinal arachnoid diverticula: outcome in 96 medically or surgically treated dogs. J Vet Intern Med 2007;31:849-53.
Mayousse V, Desquilbet L, Jeandel A, Blot S. Prevalence of neurological disorders in French bulldog: a retrospective study of 343 cases (2002-2016). BMC Vet Res 2017;13:212.
De Frias JM, De Decker S, De Stefani A, Llabres-Diaz F. Description and clinical relevance of the variable conformation of canine spinal arachnoid diverticula. Vet Radiol Ultrasound 2024;65:344-51.
da Costa RC, Cook LB. Cystic abnormalities of the spinal cord and vertebral column. Vet Clin North Am Small Anim Pract 2016;46:277-93.
Nabors MW, Pait TG, Byrd EB, Karim NO, Davis DO, Kobrine AI et al. Updated assessment and current classification of spinal meningeal cysts. J Neurosurg 1988;68:366-77.
Flegel T, Müller MK, Truar K, Löffler C, Oechtering G. Thoracolumbar spinal arachnoid diverticula in 5 pug dogs. Can Vet J 2013;54:969-73.
Skeen TM, Olby NJ, Muñana KR, Sharp NJ. Spinal arachnoid cysts in 17 dogs. J Am Anim Hosp Assoc 2003;39:271-82.
de Nies KS, Edwards RA, Bergknut N, Beukers M, Meij BP. Caudal lumbar spinal cysts in two French Bulldogs. Acta Vet Scand 2018;60:14.
Schmökel H, Rapp M. Lameness caused by an extradural lumbosacral foraminal synovial cyst in three German Shepherd Dogs. Vet Comp Orthop Traumatol 2016;29:83-8.
Dickinson PJ, Sturges BK, Berry WL, Vernau KM, Koblik PD, Lecouteur RA. Extradural spinal synovial cysts in nine dogs. J Small Anim Pract 2001;42:502-9.
Sale CSH, Smith KC. Extradural spinal juxtafacet (synovial) cysts in three dogs. J Small Anim Pract 2007;48:116-9.
Morgan JP, Bahr A, Franti CE, Bailey CS. Lumbosacral transitional vertebrae as a predisposing cause of cauda equina syndrome in German Shepherd Dogs: 161 cases (1987-1990). J Am Vet Med Assoc 1993;202:1877-82.
Alisauskaite N, Cizinauskas S, Jeserevics J, Rakauskas M, Cherubini GB, Anttila M et al. Short- and long-term outcome and magnetic resonance imaging findings after surgical treatment of thoracolumbar spinal arachnoid diverticula in 25 Pugs. J Vet Intern Med 2019;33:1376-83.
Shivapour SK, Volk HA, Watts V, De Decker S. Cine balanced fast field echo magnetic resonance imaging of canine spinal arachnoid diverticulae pulsation. Vet J 2019;248:86-90.
Seiler GS, Robertson ID, Mai W, Widmer WR, Suran J, Nemanic S et al. Usefulness of a half-fourier acquisition single-shot turbo spin-echo pulse sequence in identifying arachnoid diverticula in dogs. Vet Radiol Ultrasound 2012;53:157-61.
Tauro A, Jovanovik J, Driver CJ, Rusbridge C. Clinical application of 3D-CISS MRI sequences for diagnosis and surgical planning of spinal arachnoid diverticula and adhesions in dogs. Vet Comp Orthop Traumatol 2018;31:83-94.
Jones B, Behr S, Shaw T, Capello R, Jeffery N, Liebel FX et al. Surgical techniques used in the management of intra-arachnoid diverticula in dogs across four referral centres and their immediate outcome. J Small Anim Pract 2022;63:520-5.
Alcoverro E, McConnell JF, Sanchez-Masian D, De Risio L, De Decker S, Gonçalves R. Late-onset recurrence of neurological deficits after surgery for spinal arachnoid diverticula. Vet Rec 2018;182:380.