Akutt lungeødem hos jakthunder («Jakthundødem»)
Denne artikkelen beskriver en kasuistikk og tar for seg tilgjengelig litteratur for å belyse etiologi, patofysiologi og kliniske funn ved jakthundødem. Kasuistikken beskriver kardiovaskulære og hemodynamiske forandringer ved jakthundødem ved hjelp av ekkokardiografi, røntgen og biokjemiske analyser. Formålet er å formidle kunnskap om årsak, diagnostikk og behandlingsmuligheter for pasienter med «jakthundødem».
Veterinær, Spesialistkandidat, AniCura Dyresykehus Sørlandet
Veterinær, Spesialistkandidat, AniCura Dyresykehus Sørlandet
Veterinær, PhD, Spesialist i smådyrsykdommer, hund og katt
Master of Companion Animal Cardiology (MS CACS), AniCura Dyreklinikken Telemark
Innledning
«Jakthundødem» er en tilstand der hunden utvikler akutt lungeødem under eller like etter at den har vært med på jakt. Disse pasientene har dyspné og dårlig allmenntilstand og fraktes derfor ofte til veterinær grunnet behov for øyeblikkelig hjelp. Tilstanden kan føre til at hundens mulighet til å delta på jakt senere vil være begrenset, noe som kan gå ut over livskvaliteten til mange av disse individene. Gjentakende problemer med jakthundødem vil dessuten føre til at hundens bruksverdi blir nedsatt, noe som kan være av betydning for eier. I klinisk praksis er det derfor viktig å kjenne til denne tilstanden, særlig i distrikter med en høy andel jakthunder.
Tilstanden er lite kjent utenfor Sverige og Norge (1). Årsaken kan være at det er raser som er sjeldnere, eller ikke brukes til jakt i andre land enn Sverige og Norge. Drever er en rase som stammer fra Sverige og er lite utbredt utenfor Norden. Arvbarheten for «jakthundødem» ble undersøkt hos denne rasen i en studie. Studien var basert på spørreskjema sendt til eiere av avkom etter affiserte og friske foreldreindivider i Sverige. Det ble funnet en økt risiko for «jakthundødem» dersom et av individets foreldre hadde hatt sykdommen. Totalt 23,3 % av avkom fra syke foreldre og 6,7 % av avkom fra friske foreldredyr utviklet lungeødem knyttet til deltagelse på jakt (2).
I en annen studie ble 16 hunder med «jakthundødem» undersøkt (1). Fire av hundene ble avlivet grunnet dyspné, og det ble utført postmortal undersøkelse av disse. Det var ingen makroskopiske endringer i hjertet til hundene, men mikroskopisk ble det funnet multiple foci med subendokardial nekrose i venstre ventrikkels myokard. Lungene ble undersøkt hos tre av fire hunder. Alle hadde forandringer forenlig med akutt, alvorlig lungeødem. En hund hadde også fibrøse fortykkelser i alveolene, noe som kan tyde på ødem over en lengre periode.
Patofysiologi
Lungeødem defineres som en unormal akkumulering av ekstravaskulær væske i lungeparenkymet (2). Hjertesvikt er den vanligste årsaken til lungeødem. Svikt oppstår når patologi i hjertet fører til opphopning av blod i den pulmonale sirkulasjonen. Økt vaskulært hydrostatisk trykk i de pulmonale kapillærene fører til at væske siver ut i det interstitielle vevet og lungeødem utvikles (3).
Det identifiseres sjeldent primær kardiologisk patologi hos hunder som får «jakthundødem». De fleste studiene gir imidlertid holdepunkter for at ødemet kan ha en nevrogen opprinnelse (1,4,5). Under jakt er det antatt at lungeødemet utløses av spenningen og stresset som hunden opplever. Dette fører til et høyt nivå av katekolaminer. Det er ikke sikkert kartlagt hvordan økte katekolaminer fører til dannelsen av lungeødem, men humant er det foreslått flere teorier som belyses nedenfor (1,5,6).
Det er også foreslått at fysisk utmattelse med hypoglykemi kan bidra til å utløse lungeødemet ved å stimulere frigjøring av katekolaminer (1,5,7). Det kan heller ikke utelukkes at «jakthundødem» er et postobstruktivt lungeødem. Denne teorien anses imidlertid som mindre sannsynlig, da den blant annet ikke forklarer funn av subendokardial nekrose post mortem (1,5,8).
En teori forklarer mekanismen bak ødemet ved at hjertets muskelceller skades direkte av katekolaminene. Takotsubo kardiomyopati (TK) hos humane pasienter er et eksempel på denne patologiske mekanismen. TK er en reversibel hjertelidelse som er antatt å bli utløst av emosjonelle eller fysisk stressende hendelser (6,9). En hypotese forklarer ødemet ved at katekolaminene øker både det systemiske og pulmonale trykket. Venstre ventrikkel klarer ikke å pumpe effektivt mot den økte systemiske motstanden. Dette fører til økt trykk i lungesirkulasjonen og lungeødem grunnet økt hydrostatisk trykk (6,10). Økt hydrostatisk trykk kan imidlertid ikke alene forklare sammensetning til ødemvæsken i lungene i mange tilfeller. En tredje teori forklarer derfor at det oppstår skade på den alveolære membranen i lungekapillærene grunnet det økte hydrostatiske trykket i lungesirkulasjonen. Ødem er da et resultat av både økt hydrostatisk trykk og vaskulær skade (6,11).
De hemodynamiske endringene beskrevet ovenfor blir imidlertid ikke alltid påvist ved «jakthundødem». En fjerde hypotese forklarer derfor mekanismen bak ødemet ved at den sympatiske aktiviteten i CNS påvirker den pulmonale vaskulaturen i lungene direkte. Ødemet utvikles dermed uavhengig av øvrige systemiske endringer (6,12).
Kasuistikk
Signalement og anamnese
Ei 10 år gammel intakt drevertispe hadde jaktet i omtrent tre timer i ulendt terreng da eier ved hjelp av GPS oppdaget at hunden hadde stoppet opp. Eier fant raskt frem til hunden og kunne konstatere at den var nedstemt og pustet raskt og tungt, men hostet ikke. Tispa hadde hatt tilsvarende episoder tidligere år. De kliniske tegnene hadde da gått over uten medisinsk behandling. Denne gangen vurderte eier de kliniske tegnene mer uttalte og oppsøkte derfor dyrlege. Eier opplyste at hunden tidligere på dagen hadde spist og drukket, urinert og defekert som vanlig. Hunden var vaksinert årlig og hadde fått ormekur ved behov.
Triage
Ved ankomst til klinikken hadde hunden uttalt dyspné, var nedstemt, men responsiv og ambulant. Tispa ville helst ligge i brystleie med utstrakt hode. Hunden ble vurdert som Manchester Triage System Score 3 av 5 (potensielt livstruende) (13,14). Score 3 betyr at det haster med å få undersøkt og behandlet pasienten. Hunden fikk derfor tilført oksygen ved hjelp av en maske straks den kom inn i klinikken. Butorfanol ble ikke administrert på dette tidspunktet da hunden var svært rolig.
Klinisk undersøkelse
Hundens kapillærfylningstid var < 2 sekunder, og slimhinnene var lys rosa og fuktige. Pulsen var 140/minutt. Kvaliteten var sterk, og det var god korrelasjon mellom hjertestøtene ved hjertebasis og i arteria femoralis. Det ble ikke observert distensjon eller pulsering i vena jugularis. Respirasjonen var kostoabdominal med en respirasjonsfrekvens på 56/minutt. Det var ingen hvesing, stertor eller stridor. Ved auskultasjon var det knitring over kaudodorsale lungefelt på begge sider. Buken hadde ikke økt omfang, og var myk og indolent ved palpasjon. Hunden hadde ingen nevrologiske avvik, og muskulaturen var ikke øm eller svullen. Temperaturen rektalt var
38,5 ˚C. Det ble ikke påvist andre avvik ved den kliniske undersøkelsen.
Grunnet hundens kliniske tegn og resultat av den kliniske undersøkelse, var det naturlig å starte med å undersøke blodprøver, urinprøver og røntgenundersøkelser av thorax.
Blodprøver
Blodprøvene ble analysert på klinikkens Idexx Procyte, Catalyst One og VetStat maskiner. En standard biokjemisk og hematologisk analyse ble utført, i tillegg til at CRP, kortisol, laktat, T4/TSH og blodgass ble målt. Frossent serum og EDTA-plasma ble sendt til Laboklin laboratoriet i Tyskland for analyse av muskelenzymer, hjertemarkørene ProBNP og Troponin I og katekolaminene metanefrin og normetanefrin.
Det ble påvist en mild non-regenerativ anemi, metabolsk acidose med kompensatorisk respiratorisk alkalose, mildt økt laktat, moderat økt CRP og et stressleukogram. Nyreverdiene var normale. Både muskelenzymene og Troponin I var markert forhøyet. Normetanefrin var mildt økt, mens metanefrin var normalt (Tabell 1).
Urinprøver

Figur 1. Urinprøver fra jakthund med akutt oppstått lungeødem. Prøven til høyre på bildet er tatt like etter at eier fant hunden i skogen og prøven til venstre er tatt ved ankomst klinikken 1 time senere.
Foto: Kirsti Bjørndal
Urinprøvene ble analysert ved klinikkens Idexx VetLab UA og Sedivue maskiner. Hundens eier hadde med seg en urinprøve som ble tatt like etter at han fant hunden i en forkommen tilstand (Figur 1). Urinen hadde brunlig misfarging, var isostenurisk med mildt forhøyet pH (Tabell 2). Supernatanten forble brunlig etter sentrifugering. For å differensiere mellom hemoglobinuri og myoglobinuri ble plasmafargen vurdert. Denne var klar, noe som indikerte at brunfargen på urinen var forårsaket av myoglobin. Ved undersøkelse av urinsedimentet ble det funnet både røde og hvite blodceller.
En time senere ble det tatt en ny urinprøve som var gul og hadde lavere spesifikk vekt og pH. Leukocytose og hematuri var imidlertid fortsatt til stede.
Resultater jaktdagen |
4 dager senere |
14 dager senere |
Referanse-intervaller |
|
|---|---|---|---|---|
Kliniske parametere |
||||
Blodtrykk (mmHg) |
113/67 |
110/89 |
115/85 |
120/80 |
Puls (pr. min) |
140 |
100 |
90 |
70-120 |
Respirasjon (pr. min) |
56, abdominal |
12, kostal |
12, kostal |
12-30 |
Allmenntilstand |
Nedstemt, sternalt leie med utstrakt hode |
Kvikk, alert, responsiv |
Kvikk, alert, responsiv |
- |
Hematologi | ||||
RBC (1012/L) |
5,44 |
6,16 |
6,17 |
5,65-8,87 |
HCT (%) |
34,0 |
39,4 |
39,0 |
37,3-61,7 |
HGB (g/dL) |
11,8 |
13,1 |
13,3 |
13,1-20,5 |
WBC (109/L) |
17,7 |
6,79 |
4,54 |
5,05 – 16,76 |
Neutrofile (109/L) |
15,8 |
4,87 |
2,28 |
2,95-11,64 |
Lymfocytter (109/L) |
1,32 |
1,51 |
1,79 |
1,05-5,10 |
Monocytter (109/L) |
0,52 |
0,31 |
0,25 |
0,16-1,12 |
Eosinofile (109/L) |
0,02 |
0,10 |
0,00 |
0,06 – 1,23 |
Blodgass | ||||
pH |
7,2 |
7,3 |
- |
7,3-7,4 |
HCO3 (mmol/L) |
11,7 |
17,2 |
- |
20,0-29,0 |
pCO2 (mmHg) |
30,0 |
39,0 |
- |
32,0-49,0 |
SaO2 (%) |
60 |
90 |
- |
94-100 |
tCO2 (mmol/L) |
18,3 |
12,6 |
- |
21,0 – 31,0 |
pO2 (mmHg) |
39,0 |
68,0 |
- |
32,0 – 49,0 |
AnionGap (mmol/L) |
>30 |
- |
- |
10-20 |
Klinisk kjemi og endokrinologi | ||||
ALT (U/L) |
2 |
210 |
82 |
10-125 |
ALP (U/L) |
190 |
343 |
143 |
23-212 |
CK (U/L |
9132 |
148 |
- |
< 200 |
AST (U/L) |
798 |
34 |
- |
< 51 |
LDH (U/L) |
410 |
89 |
- |
<91 |
Kreatinin (µmol/L) |
75 |
66 |
68 |
44-159 |
Laktat (mmol/L) |
2,9 |
2,3 |
- |
0,5-2,5 |
CRP (mg/L) |
62 |
5 |
5 |
0-10 |
Kalsium (mmol/L) |
2,1 |
2,3 |
- |
2,3-3,0 |
Magnesium (mmol/L) |
0,60 |
0,7 |
- |
0,6-1,3 |
Natrium (mmol/L) |
146 |
147 |
- |
140-155 |
Kalium (mmol/L) |
4,4 |
5,0 |
- |
3,5-5,1 |
ProBNP (mmol/L) |
462 |
- |
- |
< 500 |
α-HBDH (U/L) |
243 |
40 |
- |
< 65 |
Troponin I (ng/mL) |
> 25 |
0,12 |
- |
<0,08 |
Metanefrin (ng/L) |
247 |
157 |
- |
< 827 |
Normetanefrin (ng/L) |
1140 |
700 |
- |
< 1010 |
Kortisol (nmol/L) |
76 |
- |
- |
14-138 |
T4 (nmol/L) |
Innenfor referanseintervallene |
- |
- |
- |
ALT: Alkalisk transaminase, ALP: Alkalisk fosfatase, RBC: Erytrocytter, HCT: Hematokrit, HGB: Hemoglobin, WBC: Leukocytter, CRP: C-reaktivt protein, HCO3-: Bikarbonat, PCo2: Partielt trykk karbondioksid, sO2: Oksygenmetning, tCO2, totalt karbondioksid, PO2: partielt oksygentrykk, T4: Tyroksin, TSH: Thyreoideastimulerende hormon, a-HBDH: α-Hydroxybutyrate dehydrogenase, CK: Kreatinin kinase, AST: Aspartat animnotransferase, LDH: Laktat dehydrogenase, ProBnP: pro-B-type natriuretisk peptid.
Resultater jaktdagen |
1 time senere på jaktdagen |
14 dager senere |
|
|---|---|---|---|
Farge |
Brunlig |
Mørk gul |
Strågul |
Klarhet |
Opak |
Klar |
Klar |
Spesifikk vekt |
1,024 |
1,010 |
1,021 |
pH |
7,0 |
6,0 |
5,0 |
Proteiner (g/L) |
5,0 |
6,0 |
Negativ |
Glukose |
Negativ |
Negativ |
Negativ |
Ketoner |
Negativ |
Negativ |
Negativ |
Urobilinogen |
Normal |
Normal |
Normal |
Bilirubin |
Negativ |
Negativ |
Negativ |
Blod (RBC/L) |
250 |
259 |
10 |
WBC (/HPF) |
29 |
> 50 |
- |
RBC (/HPF) |
3 |
< 1 |
- |
Stavbakterier |
Ingen |
Til stede |
- |
Kokkoide bakterier |
Ingen |
Mistenkt til stede |
- |
Plateepitelceller (/HPF) |
<1 |
Ingen |
- |
Andre-epitelceller (/HPF) |
<1 |
1-2 |
- |
Hyalinsylindre |
Ingen |
Ingen |
- |
Ikke-hyalinsylindre |
Ingen |
> 1/HPF |
- |
Krystaller |
Ingen |
Ingen |
- |
WBC: Leukocytter, RBC: Erytrocytter, HPF: Mikroskopisk høyoppløselig felt
Røntgen
Etter innledende stabilisering av hunden ble en røntgenundersøkelse av thorax utført med klinikkens røntgenapparat Examion X-R Static Classic. Bildene ble tatt med hunden liggende i høyre og venstre sideleie, samt i brystleie. Det ble påvist osteofyttdannelser ved kraniale tuber olecrani, ellers var der ingen avvik på skjelettet. Diafragma var intakt, ventrikkelen var fylt med innhold forenlig med mat, og synlig del av lever hadde normal opasitet og størrelse. Oesophagus var ikke synlig, mediastinum hadde normal bredde, trachea var ikke innsnevret, og det var ikke redusert trakeovertebral vinkel. Hjertesilhuetten hadde en vertebral hjertescore på 10,5 (ref. 10 +/- 0,5) og ingen forstørrelse av venstre forkammer. Arteria og vena pulmonalis var ikke dilaterte, men både aorta og vena cava caudalis var mindre synlige på grunn av økt opasitet i interstitiet i kaudodorsale lungefelt bilateralt («knust glass utseende»). I dorsoventralplanet kunne det observeres en normal hjertesilhuett uten forstørret venstre forkammer, men med økt opasitet i lungenes interstitium. Dette er forenlig med et interstitielt lungeødem (Figur 2 og 3). Etter funn av lungeødem var det naturlig å ta ultralyd av hjertet, undersøke om det var væske i buken, thorax eller perikardet og måle blodtrykket.
Blodtrykk
Blodtrykket ble undersøkt med en HDO blodtrykksmåler fra Eickemeyer. Det ble tatt fem målinger som viste et gjennomsnitt på 113/67 som er et normalt blodtrykk.
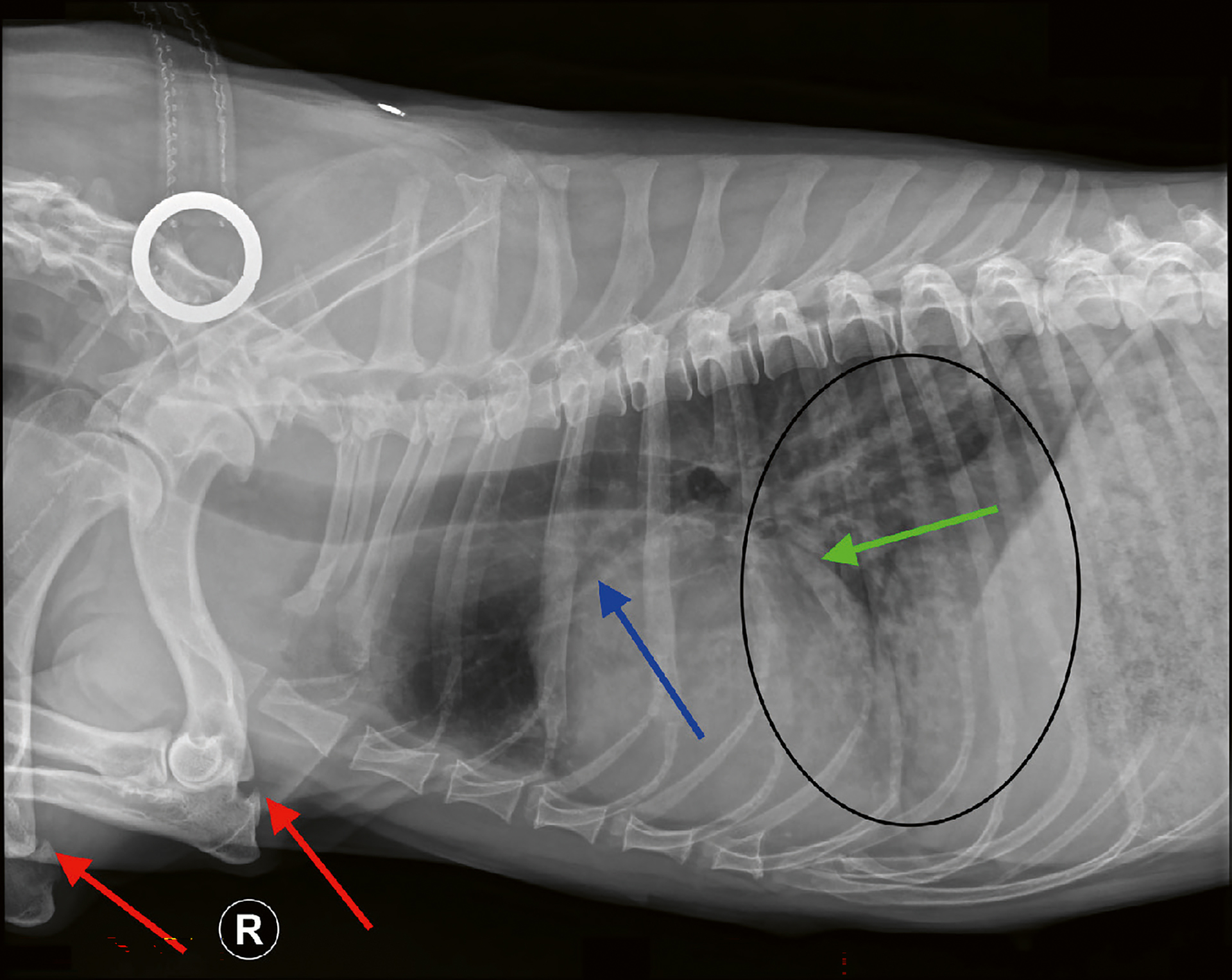
Figur 2. Røntgenbilde i høyre lateral posisjon av thorax. Begge albuer har osteofytter på processus olecrani (røde piler) forenlig med artrose. Både aorta og vena cava er lite synlige på grunn av økt opasitet i lungeparenkymet (sort sirkel). Bildet har et såkalt «knust glass» utseende, som er forenlig med lungeødem i hele kaudale del (sort sirkel). Diafragma er intakt, og hjertesilhuetten er i øvre normale grenseverdi. (Vertebral hjertescore = 10,5), Hverken venstre forkammer (LA) (grønn pil), eller v. pulmonalis er dilatert (blå pil).
Foto: Kirsti Bjørndal
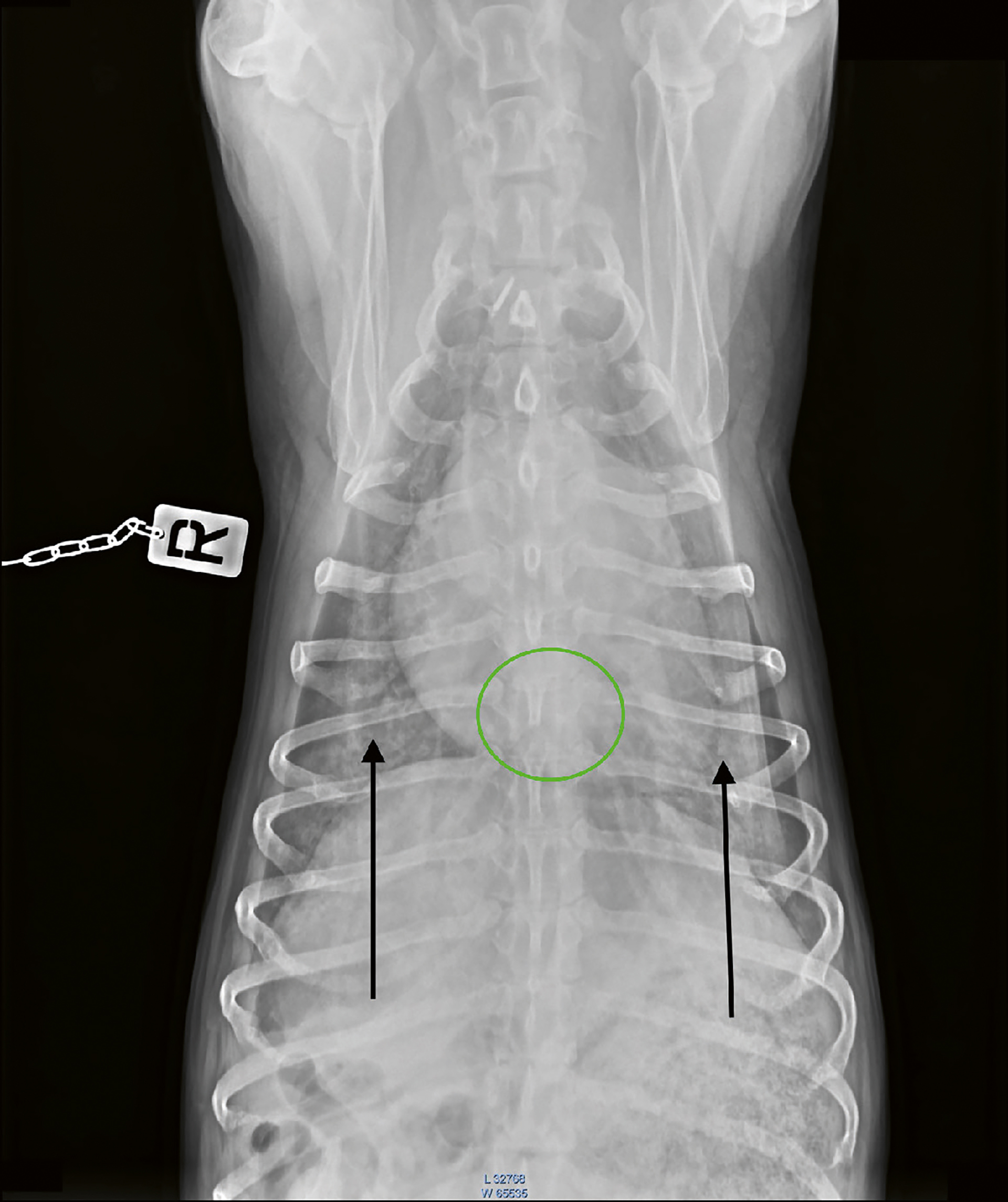
Figur 3. Røntgenbilde av thorax i dorsoventralt plan. Hjertesilhuetten fyller cirka 2/3 av thorax. Venstre forkammer er ikke forstørret (grønn sirkel), og det er økt interstitiell opasitet i det kaudale lungefeltet bilateralt (sorte piler).
Foto: Kirsti Bjørndal
EKG
EKG ble utført ved bruk av Televet 100. Hunden hadde en sinusrytme med P for hver QRS. Det ble ikke påvist noen rytmeforstyrrelse.
Ekkokardiografi
To timer etter at eier hadde hentet hunden ut av skogen, ble hundens hjerte undersøkt med ultralyd. Den ekkokardiografiske undersøkelsen ble utført med en Philips Equip Elite ultralydmaskin og S9-2 lydhode. Hunden lå først i høyre sideleie, og deretter i venstre sideleie på et spesialbord for hjerteundersøkelser. Det ble barbert et lite felt på høyre og venstre side av brystet ved armhulene, i tillegg til ved processus xiphoideus. Ultralydmaskinens EKG-ledninger ble festet på høyre og venstre frambein og på ett bakbein.
Ekkokardiografisk undersøkelse viste mildt forstørret høyre hjertekammer (RV), mildt dilatert pulmonalarterie (PA), og en avflating av ventrikulært septum. Det var ingen andre avvik på hverken venstre hjertekammer (LV) eller venstre forkammer (LA). Det var ingen pulmonal stenose eller trikuspidalinsuffisiens som kunne forklare mildt forstørret RV. Det var heller ikke hypertrofi av veggen eller septum i RV. Hjertets diastoliske (E/A, E/IVRT, E/E’) og systoliske funksjon (FS og EF) var normal (Tabell 3, Figur 4 og 5).
Ultralyd av urinveier inkludert vesica
Det ble ikke påvist noen avvik i noen deler av urinveiene.
POCUS (Point Of Care Ultrasound)
Fri væske ble ikke observert i noen av de fire abdominale feltene, i pleura eller i perikardet.
Diagnose
På bakgrunn av anamnese, kliniske tegn og de diagnostiske undersøkelsene fikk hunden diagnosen akutt lungeødem relatert til overanstrengelse på jakt, «Jakthundødem».
Behandling
Hunden ble innledningsvis behandlet med oksygen og ro. Med diagnosen akutt lungeødem ble hunden behandlet med furosemid injeksjon (Furix 10 mg/mL) 2 mg/kg intravenøst, totalt 29 mg. Den fikk også butorfanol injeksjon (10 mg/mL) 0,2 mg/kg intramuskulært, totalt 0,3 mL. Puls, respirasjonsfrekvens, blodtrykk, temperatur, CRT og mental status ble monitorert jevnlig. Pulsen gikk ned til 110/minutt etter innledende bolus. Hunden måtte imidlertid ha til sammen 3 boli med tilsvarende mengde furosemid, gitt med 45 minutters mellomrom, før respirasjonsfrekvensen gikk ned til under 40/min. Etter stabilisering ble hunden sendt hjem med oppfordring om å gi hunden ro, og sørge for at hunden fikk nok vann og mat med høyt næringsinnhold som for eksempel Hills a/d. Furosemid ble forskrevet i ytterligere 3 dager, 1 mg/kg morgen og kveld.
Parameter |
Resultat |
Referanseintervaller |
|---|---|---|
IVSd (mm) |
90,0 |
81-91 |
IVSs (mm) |
14,0 |
12-14 |
LVIDd (mm) |
30,0 |
30-32 |
LVIDs (mm) |
21,0 |
18-20 |
LVPWd (mm) |
78,0 |
65-74 |
LVPWs (mm) |
10,0 |
11-12 |
FS LV (%) |
35,2 |
33,7-45,9 |
EPSS (mm) |
0,48 |
< 0,6 |
LVIDdN |
1,65 |
< 1,85 |
Morfologi mitralklaff |
Seil-lignende |
Seil-lignende |
Rupturert cordae tendineae |
Nei |
Nei |
LA diameter (cm) |
0,19 |
0,18-0,20 |
Ao diameter (cm) |
0,19 |
0,19-0,20 |
LA/Ao (Hanssons metode) |
1,0 |
< 1,6 |
RVOT Vmax (m/s) |
1,2 |
< 1,8 |
RVOT insuffisiens Vmax |
Ingen |
Ingen |
Avflating av interventrikulært septum |
Ja |
Nei |
PA/Ao |
1,2 |
< 1,0 |
LVOT Vmax (m/s) |
1,2 |
< 2,0 |
Mitral E velositet (m/s) |
0,7 |
< 1,2 |
Mitral A velositet (m/s) |
0,5 |
0,3-0,6 |
Mitral E/A |
1,4 |
0,9-1,5 |
E/IVRT |
1,8 |
< 1,9-2,5 |
E/E’ |
9 |
< 9-12 |
Mitral regurgitasjon (MR) |
Ingen |
Ingen |
Tricuspid regurgitasjon (m/s) |
Ingen |
0-3 |
Mitralinsuffisens intensitet |
Ingen |
Ingen |
Mitralinsufissiens område |
Ingen |
Ingen |
Pulmonalvene blodstrøm |
Systolisk dominerende |
Systolisk dominerende |
LVEDVolume (Simpson) mL/kg |
2,0 |
1,3-3,3 |
LVESVolume (Simpson) mL/kg |
1,0 |
0,3-1,6 |
EF |
73 |
> 42 |
RV EDA (cm2) |
8,0 |
3,8-8,8 |
RV ESA (cm2) |
4,6 |
1,8-5,6 |
IVSd: Intraventricular Septum in diastole, IVSs: Intraventricular Septum in systole, LVIDd: Left Ventricular Internal Diameter in diastole, LVIDs: Left Ventricular Internal Diameter in systole, LVPWd: Left Ventricular Posterior Wall thickness in diastole, LVPWs: Left Ventricular Posterior Wall thickness in systole, FS: Fractional Shortening, EPSS: End Point Septal Separation, LVIDdN: Left Ventricular Inner Diameter in diastole Normalized, LA: Left Atrium, Ao: Aorta, RVOT: Right Ventricular Outflow Tract, PA: Pulmonary Artery, LVOT: Left Ventricular Outflow Tract, IVRT: Isovolumetric Relaxation Time, MR: Mitral Regurgitation, LVED: Left Ventricular End Diastole, LVES: Left Ventricular End Systole, EF Ejection Fraction.
Kontroll
Fire dager senere kom hunden til kontroll. Alle kliniske parametere hadde normalisert seg, og hunden var kvikk, alert og responsiv ved ankomst. Blodverdiene og urinundersøkelsen var nå tilnærmet normale, med unntak av at det fortsatt var en mild metabolsk acidose, og mildt forhøyet Troponin I (Tabell 1). Ekkokardiografisk undersøkelse viste en normalisering av RV kammer og PA dilatasjon, og røntgen thorax var uten funn av lungeødem. Oppfølgende kontroll av blod og urin 10 dager senere viste at alle parameterne var innenfor referanseintervallene.
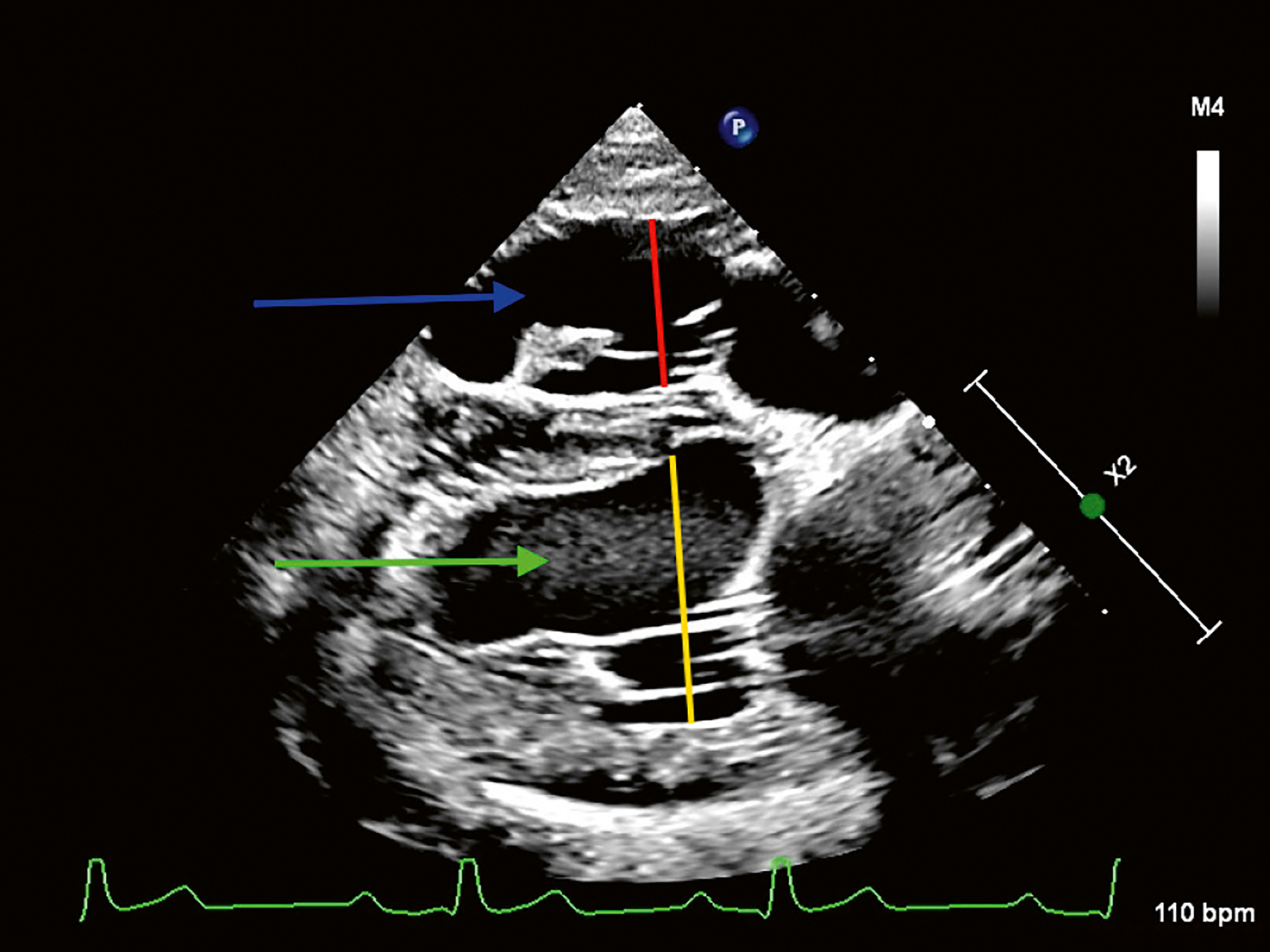
Figur 4. Høyresidig parasternalt firekammers lengdeaksebilde i endediastole, som viser at høyre hovedkammer (RV) (blå pil) var dilatert (rød linje) sammenlignet med venstre hovedkammer (LV) (grønn pil og gul linje) i henhold til Johnsons referanse (18), men ikke i henhold til Feldhutters referanseverdier (16). Det var ingen hypertrofi av ventrikkelveggen på høyre side.
Foto: Kirsti Bjørndal
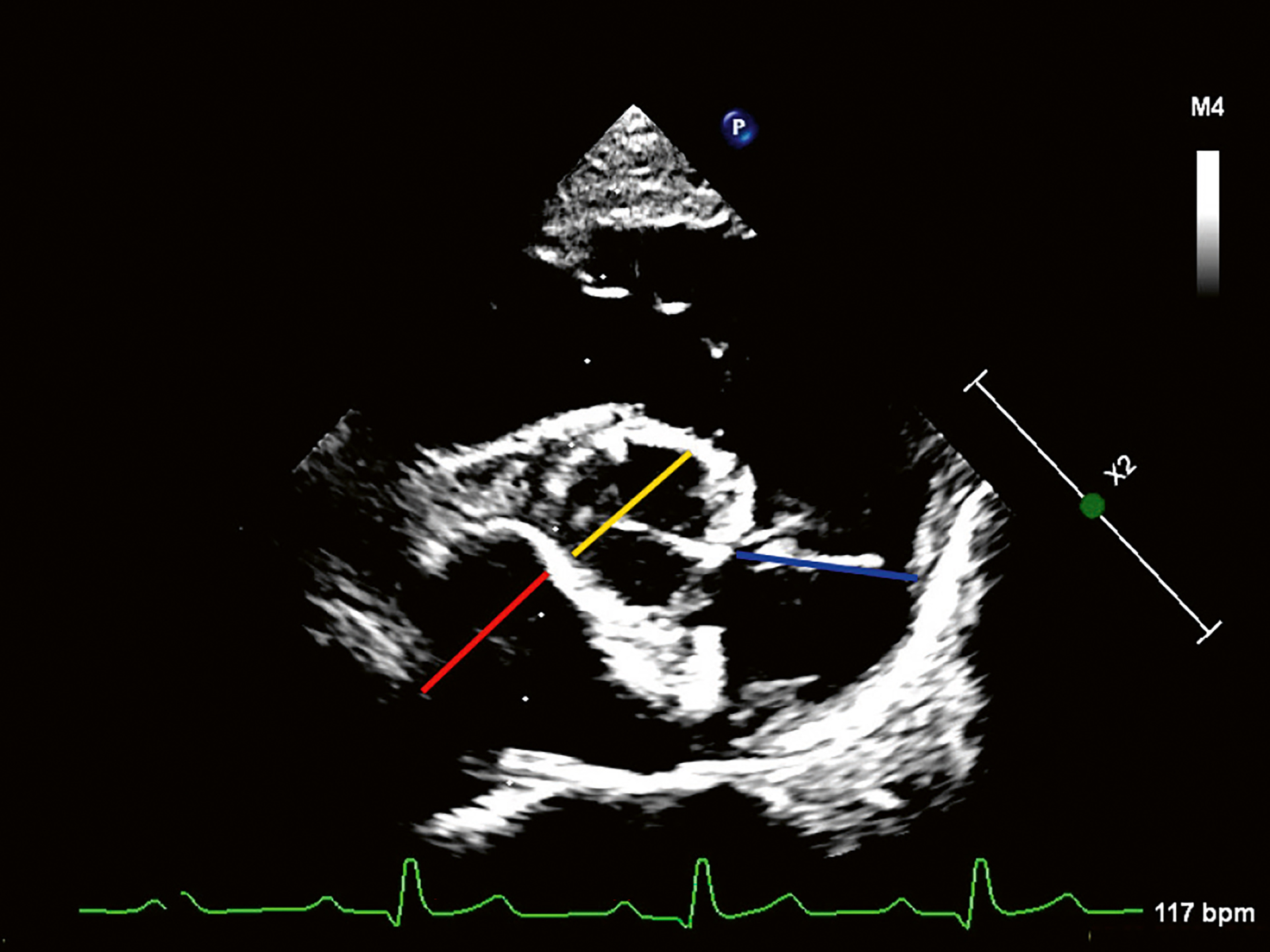
Figur 5. Høyresidig parasternalt kortaksebilde. LA/Ao (Left Atrium/ Aorta) viser at venstre forkammer (rød strek) ikke er forstørret, Pulmonalarterien (PA) (gul strek) var dilatert sammenlignet med aortadiameteren (Ao) (blå strek).
Foto: Kirsti Bjørndal
Diskusjon
Hunden i denne kasuistikken ble utredet for mistanke om «jakthundødem» grunnet signalement, anamnese og kliniske tegn. Røntgenbilder av thorax viste forandringer forenlig med lungeødem (Figur 2 og 3) mens ultralydundersøkelsen viste at hjertets venstre side ikke var dilatert. Den systoliske og diastoliske funksjonen var også normal (Figur 4 og 5, Tabell 3). Pasientens nivå av ProBNP var innenfor referanseintervallet. Disse funnene gir grunnlag for å konkludere med at det ikke forelå noen form for strekk av hjertets myokard (15). Hundens lungeødem kunne derfor ikke være forårsaket av venstresidig hjertesvikt, men heller av en ikke-kardiogen årsak.
Funnet av myoglobinuri viste at det forelå en skade på skjelettmuskulaturen hos denne pasienten (Figur 1, Tabell 2) (16). I tillegg var biomarkøren Troponin I (cTnI) 300 ganger høyere enn øvre referansegrense (21). Høye nivåer av Troponin reflekterer myocyttskade. En vanlig årsak til myocyttskade er hjertesykdommer. Dette ble ikke påvist hos denne pasienten. Myocyttskade kan også oppstå ved ikke-kardiogen sykdom, særlig hos kritisk syke pasienter med inflammatoriske sykdommer eller sjokktilstander. Det kraftig forhøyede nivået av cTnI ved innledende klinisk presentasjon viste at hjertet til denne pasienten var svært påkjent (17,18). Post mortem undersøkelser av hjerter hos hunder med lungeødem oppstått under jakt i Sverige, viste subendokardiale nekroser (1). Det er mulig at den kraftig forhøyde verdien av cTnI hos pasienten i den kasuistikken reflekterte en subendokardial nekrose som ble observert (1). cTnI ble imidlertid ikke målt i denne studien. Siden cTnI falt raskt fra >25 ng/mL til 0,12 ng/mL i løpet av fire dager hos pasienten beskrevet i denne kasuistikken var myocyttskaden trolig reversibel, og resulterte derfor ikke i en permanent skade med utvikling av nekroser (18,19). Kliniske tegn og forløpet støtter også at myocyttskaden var reversibel.
Siden pasienten i denne kasuistikken urinerte brunlig misfarget urin like etter at eier hadde funnet hunden i en forkommen tilstand, ga dette ga mistanke om rabdomyolyse grunnet muskelskade og frigjøring av myoglobin. Høye verdier av muskelenzymene alfa-hydroxybutyrat dehydrogenase (alfa-HBDH), kreatinin kinase (CK), aspartat aminotransferase (AST) og laktat dehydrogenase (LDH) sammen med et høyt nivå av laktat bekreftet dette (26). Sledehunder som deltar i lengre konkurranseløp utvikler av og til også rabdomyolyse. Det er vist at flere av disse hundene fikk markert økning i CK og fosfat, i tillegg til økt ALT og AST (22). Dette skjedde imidlertid først 2-4 dager ut i løpet, i motsetning til hos pasienten i denne kasuistikken der muskelskaden oppstod allerede etter få timers intens losing. En undersøkelse fra 2008 gjennomgikk dødsårsak til 23 hunder som døde i løpet av hundeløpet Iditarod over en periode på 12 år. Det ble påvist rabdomyolyse hos 15 av disse hundene. Flere av hundene hadde tilleggsdiagnoser som magesår, aspirasjonspneumoni og myokardiell degenerasjon og nekrose (20). Funnene i kasuistikken viser at det er flere likehetstrekk mellom sledehunder som deltok i lange løp og utviklet rabdomyolyse, og pasienten i denne kasuistikken.
Det er mulig at samtidig losing og løping gir raskere muskelskade hos en jakthund (timer) sammenlignet med en sledehund som kun løper (dager). Det kan ikke utelukkes at hunder med jakthundødem også kan dø av den metabolske påvirkningen, og ikke bare av det ikke-kardiogene lungeødemet, på lik linje med sledehunder. Det er derfor svært viktig at jakthunder med kliniske tegn på respirasjonsproblemer avbryter jakten og får tilstrekkelig med hvile i flere dager.
Mild proteinuri, som ble påvist hos pasienten i kasuistikken, er ofte et tidlig tegn på tubulær nyreskade. Forekomsten av myoglobin kan være årsak til nyreskaden og påfølgende proteinuri. Kasuistikken viste imidlertid forbigående proteinuri da det ved kontroll etter 14 dager ikke kunne påvises proteiner i urinen. Myoglobinuri stoppet trolig opp allerede etter få timer (Tabell 2).
Undersøkelse av venøs blodgass viste at pasienten i kasuistikken hadde en metabolsk acidose med kompensatorisk respiratorisk alkalose (Tabell 1). Hunden hadde også et høyt nivå av laktat, og et stressleukogram. Sannsynlig årsak til disse funnene var hypoxi og anaerob energiproduksjon. Løping samtidig med losing ga sannsynligvis redusert inntak av oksygen. Høyt nivå av katekolamin førte til takykardi. Dette medførte redusert pre-load og slagvolum, som igjen ga redusert minuttvolum (cardiac output). Lungeødemet medførte ytterligere redusert utveksling av oksygen fra alveolene til de røde blodcellene. Til sammen førte dette til nedsatt perifer perfusjon, noe som resulterte i hyperventilering og moderat forhøyet laktat.
Optimal behandling av ikkekardiogent lungeødem er å fjerne underliggende årsak. I dette tilfellet var derfor den viktigste behandlingen av hunden å avslutte jakten og la den få ro. I tillegg ble hunden behandlet med butorfanol som virker angstdempende, og oksygen. Pasienten i kasuistikken hadde tilsynelatende også god effekt av diuretisk behandling. Respirasjonsfrekvensen gikk ned fra 56/minutt til under 40/minutt i løpet av en drøy time. Det er imidlertid ingen studier som viser god effekt av diuretika ved ikke-kardiogent lungeødem. Behandlingen av pasienten førte til at både puls og respirasjonsfrekvens gikk ned. Hunden fikk økt oksygenopptak, og økt pre-load med påfølgende økt minuttvolum. Ved å tilføre oksygen ble også oksygeninntaket per inspirasjonssyklus økt. Dette bedret den kliniske tilstanden til pasienten.
Det ble påvist moderat til høy forekomst av katekolaminet normetanefrin i venøst blod. Sannsynligvis var nivået i utgangspunktet betydelig høyere da blodprøve først ble tatt 2 timer etter at hunden stoppet opp under jakt. Humant er høye nivåer av katekolaminer funnet ved nevrogent forårsaket lungeødem (1,5,6). Hos denne pasienten er det derfor mulig at det økte katekolaminet var en medvirkende årsak til både det påviste lungeødemet og myocyttskaden.
Det er uklart hvorfor noen hunder utvikler «jakthundødem» og andre ikke. Det er også uklart hvorfor noen hunder kan jakte en dag uten å utvikle ødem, for så å ikke fungere en annen dag. Flere aktive jegere har meddelt artikkelforfatterne at «jakthundødem» i hovedsak oppstår når hunden loser samtidig som den forfølger byttet. Sykdommen forekommer oftere hos hunder som klarer å følge byttet over lengre tid og utløses spesielt hos hunder som er dårlig trent. Losens intensitet øker også sjansen for å utvikle lungeødem. «Jakthundødem» er ikke beskrevet hos jakthunder som ikke loser samtidig, som for eksempel hos fuglehunder.
Ultralydundersøkelsen viste dilatasjon av høyre ventrikkel og pulmonal arterien (Tabell 2, Figur 4 og 5). Dette indikerer økt trykk i den pulmonale sirkulasjonen. Disse avvikene ses også ved pulmonal hypertensjon. Pulmonal hypertensjon kunne likevel ikke verifiseres da flere av kriteriene i henhold til ACVIM konsensus ikke var oppfylt (21). Det er sannsynlig at det intratorakale trykket ble negativt som følge av at hunden både loset og løp samtidig. Redusert pulmonalt hydrostatisk trykk medførte sannsynligvis en endring i trykkgradienten mellom de pulmonale karene og alveolene. Væske kan derfor ha forflyttet seg inn i interstitiet. Negativt trykk kan også gi økt venøs retur til høyre side av hjertet, og til lungene. Venstre side kan få redusert ventrikulær fylning og økt after-load. Begge deler kan gi økt trykk i lungesirkulasjonen (22).
Sannsynligvis er årsaken til de kliniske tegnene hos denne pasienten med «jakthundødem» to-delt: nevrogent og hydrostatisk. Løping og samtidig losing gir et høyt nivå av katekolaminer. Losing gir sannsynligvis en mekanisk senkning i trykket intratorakalt. Begge deler kan være årsaken til et ikke-kardiogent lungeødem. Hypoksemi medfører flere alvorlige metabolske forandringer, og skade på både skjelettmuskulatur og myokard.
Ikke alle distrikter har tilgang til veterinær med kompetanse innen ekkokardiografi. Dersom henvisning ikke er mulig, kan kombinasjonen av røntgen, urinprøve og vurdering av laktat, proBNP og Troponin I gi praktikeren nyttig informasjon om mulig årsak og prognose hos pasienter med mistenkt «jakthundødem».
Sammendrag
«Jakthundødem» er en relativt vanlig diagnose i distrikter der andelen losende jakthunder er høy. Kasuistikken presenterer en pasient med flere alvorlige, og potensielt fatale, radiologiske og biokjemiske avvik. Til tross for alvorlighetsgraden i avvikene restituerte pasienten raskt, og avvikene var normalisert etter få dager.
Diagnosen er en utelukkelsesdiagnose, der underliggende kardiologisk patologi ansvarlig for lungeødem, ekskluderes. Behandling består av ro, oksygen, diuretika og eventuelt butorfanol. Hunder som har utviklet jakthundødem har høy risiko for å utvikle sykdommen på nytt i neste slipp, og hvile mellom jakt er svært viktig.
Ikke alle distrikter har tilgang til veterinær med kompetanse innen ekkokardiografi. Dersom henvisning ikke er mulig, kan kombinasjonen av røntgen, urinprøve, og vurdering av laktat, proBNP og Troponin I gi praktikeren nyttig informasjon om mulig årsak og prognose hos pasienter med mistenkt jaktødem.
Det er behov for videre studier for å vurdere om dette kasuset er representativt for alle pasienter med jakthundødem. Per i dag er det ikke utført studier som dokumenterer effekt av profylaktisk behandling med eksempelvis diuretika, eller beta-blokkere.
Summary
Pulmonary oedema in hunting dogs is a relatively common diagnosis in areas where there is a high number of hunting dogs that bark at the same time as they run after the pray. This case presentation discusses a patient with several severe and potentially fatal radiological and biochemical deviations. Despite the severity of the deviations, the patient recovered quickly within a few days.
The diagnosis is a diagnosis of exclusion, where underlying cardiovascular pathology leading to pulmonary oedema is excluded. Treatment consists of rest, oxygen, diuretics, and butorphanol if required. Hunting dogs that develop pulmonary oedema have a high risk of developing the syndrome next time they hunt. Hence, rest between hunting days is extremely important.
Not all districts have access to a veterinarian with echocardiography knowledge. If referral is not possible, a combination of radiology, urine sample, measurement of lactate, ProBNP and Troponin I can lead to important information regarding the cause and prognosis in patients with suspected hunting dog oedema.
Further studies are required to evaluate if this case description is representative for hunting dogs with pulmonary oedema. No studies have been done where there is a documented effect of prophylactic treatment with drugs like diuretics or beta-blockers.
Referanser
Egenvall A, Hansson K, Säteri H, Lord PF, Jönsson L. Pulmonary oedema in Swedish hunting dogs. J Small Anim Pract 2003;44:209-17.
Egenvall A, Swenson L, Andersson K. Inheritance and determinants of pulmonary oedema in Swedish hunting dogs. Vet Rec 2004;155:144-8.
Iqbal MA, Gupta M. Cardiogenic pulmonary edema. Treasure Island, Florida: StatPearls, 2023. https://www.ncbi.nlm.nih.gov/books/NBK544260/
Agudelo CF, Schanilec P. Pulmonary oedema in a hunting dog: a case report. Vet Med 2015;60:446-9.
Unger K, Martin LG. Noncardiogenic pulmonary edema in small animals. J Vet Emerg Crit Care (San Antonio) 2023;33:156-72.
Davison DL, Terek M, Chawla LS. Neurogenic pulmonary edema. Crit Care 2012;16:212.
Mishriki YY. Hypoglycemia-induced neurogenic-type pulmonary edema: an underrecognized association. Endocr Pract 2004;10:429-31.
Glaus T, Schellenberg S, Lang J. Kardiales und nicht kardiales Lungenödem: Pathomechanismen und Ursachen. Schweiz Arch Tierheilkd 2010;152:311-7.
Akhtar MM, Cammann VL, Templin C, Ghadri JR, Lüscher TF. Takotsubo syndrome: getting closer to its causes. Cardiovasc Res 2023;119:1480-94.
Sarnoff SJ, Sarnoff LC. Neurohemodynamics of pulmonary edema. II. The role of sympathetic pathways in the elevation of pulmonary and stemic vascular pressures following the intracisternal injection of fibrin. Circulation 1952;6:51-62.
Maron MB. Effect of elevated vascular pressure transients on protein permeability in the lung. J Appl Physiol 1989;67:305-10.
McClellan MD, Dauber IM, Weil JV. Elevated intracranial pressure increases pulmonary vascular permeability to protein. J Appl Physiol 1989;67:1185-91.
Covey E. How to triage. Vet Nurse 2018;9:262-8.
Ruys LJ, Gunning M, Teske E, Robben JH, Sigrist NE. Evaluation of a veterinary triage list modified from a human five-point triage system in 485 dogs and cats. J Vet Emerg Crit Care (San Antonio) 2012;22:303-12.
Daniels LB, Maisel AS. Natriuretic peptides. J Am Coll Cardiol 2007;50:2357-68.
Francey T. Hematuria and other conditions causing discolored urine. I: Ettinger SJ, Feldman EC, Côté E, eds. Textbook of veterinary internal medicine. Diseases of the dog and the cat. 8th ed. St. Louis, Miss.: Elsevier, 2017:190-3.
Guest TM, Ramanathan AV, Tuteur PG, Schechtman KB, Ladenson JH, Jaffe AS. Myocardial injury in critically ill patients. A frequently unrecognized complication. JAMA 1995;273:1945-9.
Langhorn R, Willesen JL. Cardiac troponins in dogs and cats. J Vet Intern Med 2016;30:36-50.
Hickman PE, Potter JM, Aroney C, Koerbin G, Southcott E, Wu AHB et al. Cardiac troponin may be released by ischemia alone, without necrosis. Clin Chim Acta 2010;411:318-23.
Dennis MM, Nelson SN, Cantor GH, Mosier DA, Blake JE, Basaraba RJ. Assessment of necropsy findings in sled dogs that died during Iditarod Trail sled dog races: 23 cases (1994-2006). J Am Vet Med Assoc 2008;232:564-73.
Reinero C, Visser LC, Kellihan HB, Masseau I, Rozanski E, Clercx C et al. ACVIM consensus statement guidelines for the diagnosis, classification, treatment, and monitoring of pulmonary hypertension in dogs. J Vet Intern Med 2020;34:549-73.
Alian AA, Shelley KH. Respiratory physiology and the impact of different modes of ventilation on the photoplethysmographic waveform. Sensors (Basel) 2012;12:2236-54.