Persisterende ductus arteriosus hos hund
Persisterende ductus arteriosus (PDA) betegner en vedvarende kommunikasjon mellom aorta og pulmonalarterien der blodåren ductus arteriosus forblir åpen etter fødsel. Blod fra aorta føres over til lungesirkulasjonen via den åpne åren istedenfor til systemisk sirkulasjon. Dette er en av de vanligste medfødte hjertelidelsene hos hund. Denne artikkelen beskriver PDA hos hund og inkluderer utredningen og behandlingen av to hunder med PDA. Lukking av PDA ved åpen thoraxkirurgi ble brukt på den ene hunden (Kasuistikk 1) og transvaskulær okklusjon ble brukt på den andre hunden (Kasuistikk 2).
Veterinær, spesialist i smådyrsykdommer, hund og katt, AniCura Byåsen Dyrehospital, AniCura Dyresykehus Oslo
Ine.sund@anicura.no
Veterinær, CertVC, AniCura Dyresykehus Oslo, NMBU Veterinærhøgskolen
Veterinær, DiplECVS, AniCura Dyresykehus Oslo
Denne artikkelen er skrevet som et ledd i førsteforfatterens spesialisering i smådyrsykdommer – hund og katt
Innledning
Denne artikkelen beskriver persisterende ductus arteriosus (PDA) hos hund og de ulike behandlingsalternativene. Deretter beskrives utredning av to hunder med PDA behandlet med ulike prosedyrer, åpen thoraxkirurgi og transvaskulær okklusjon.
Fysiologi og forekomst
PDA er en av de vanligste medfødte hjertelidelsene hos hund (1). Ductus arteriosus (DA) kommer fra den sjette aortabuen og går fra bifurkasjonen på hoveddelen av pulmonalarterien til det ventrale aspektet av aorta mellom venstre arteria subclavia og intrakostalarteriene (2). DA fører blodet bort fra lungesirkulasjonen så kun 5-8 % av blodet i pulmonalarterien når lungene til fosteret. Vanligvis skal DA lukke seg få timer etter fødsel som en respons på økt oksygentrykk etter at lungene fylles med luft. Innen en måned har muskelcellene blitt brutt ned og det eneste som gjenstår er en liten elastisk struktur, ligamentum arteriosum (3).
Hos friske fostre består DA av 98 % glatt muskulatur. Histologi av hunder med PDA viser en kortere DA med hypoplastisk muskelmasse og områder med elastisk materiale der det burde vært glatt muskulatur (4, 5). Både mangel på muskelmasse og kortere lengde på DA bidrar til at den ikke lukker seg. Minst muskelmasse ses ved aorta, og dette er årsaken til at denne delen av PDA er større enn delen mot pulmonalarterien (3).
PDA er arvelig (6). Tisper har høyere forekomst av PDA enn hannhunder, og raser som toy- og dvergpuddel, malteser, pomeranian, shetland sheepdog, engelsk springer spaniel, keeshond, bichon frise, yorkshire terrier, collie og schæfer er overrepresentert (2, 7).
Om lag 5,5-15 % av hunder med PDA utvikler arteriell pulmonal hypertensjon. Dersom trykket i lungesirkulasjonen overstiger trykket i den systemiske sirkulasjonen vil blodstrømretning over PDA reverseres, «høyre-til-venstreshuntende PDA» (8). Hunder med reversert PDA kan vise kliniske tegn som kaudal cyanose, nedsatt utholdenhet, bakbenssvakhet og anfall som følge av polycytemi. Hos disse pasientene er det ikke anbefalt å lukke PDA da dette vil kunne føre til dødelig pulmonal hypertensjon (9).
Kliniske tegn og diagnose, venstre-til-høyreshuntende PDA
Venstre-til-høyreshuntende PDA fører til oversirkulasjon av pulmonal vaskulatur og venstresidig eksentrisk hypertrofi. Kliniske tegn er ofte ikke tydelige før pasienten utvikler lungeødem som følge av kongestiv venstresidig hjertesvikt som kan skje fra hunden er noen uker til flere år gammel (2, 10). Noen eiere kan kjenne et svirr over hjertet til hunden. Defekten blir ofte, men ikke alltid, oppdaget på rutinevaksinasjon fra 6 til 12 ukers alder når hunden auskulteres (11). Ubehandlet dør opptil 65 % av PDA pasienter av hjertesvikt innen et år etter at diagnosen er stilt (12). Noen få hunder kan overleve og leve et normalt liv med ingen eller få kliniske tegn uten behandling (13).
Klassisk for disse pasientene er en kraftig kontinuerlig bilyd med svirr over venstre kraniale hjertebase og en hyperkinetisk bankende puls. Ekkokardiografi brukes for å stille diagnosen. PDA kan best visualiseres i høyre parasternale kortakse og i venstre kraniale «vindu». Kontinuerlig turbulent blodstrøm med høy hastighet observeres i pulmonalarterien ved hjelp av spektral og fargedoppler. Morfologisk sees ofte et forstørret venstre for- og hovedkammer og i noen tilfeller nedsatt systolisk funksjon. Hastighet over aorta og mitralklaffen er vanligvis økt og ofte påvises en sekundær mitral lekkasje som følge av dilatasjon av venstre hovedkammer (14). Røntgen viser ofte kardiomegali med aorta- og pulmonalarteriedilatasjon (15). Elektrokardiografi kan vise høye R-takker og dype Q-takker eller være normal (16). Dilatasjon av venstre forkammer kan også føre til arteriell fibrillasjon (17).
Behandling
Til mennesker brukes prostaglandin-syntesehemmere som ibuprofen for å stimulere naturlig lukking av PDA. Hos hunder, som diagnostiseres senere enn mennesker og hvor hypoplasi av muskelen er problemet, har dette ingen effekt (18). Det er derfor kun mekanisk okklusjon som er effektiv behandling hos hunder. Den første kirurgiske behandlingen av PDA hos hund ble beskrevet i 1952 og utført av Dr. Willis Potts mindre enn to tiår etter den første kirurgiske behandlingen av PDA hos mennesker (19). Kirurgisk lukking av PDA hos hund utføres via fjerde interkostalrom som beskrevet i Kasuistikk 1 i denne artikkelen.
Den første transvaskulære okklusjonen av PDA på hund ble utført i 1994 ved hjelp av trombogeniske coiler plassert i PDA via femoralarterien (20). Det har siden blitt utviklet flere transvaskulære okklusjonsmetoder med bruk av forskjellige innretninger inkludert AmplatzerTM Vascular Plugs, AmplatzerTM Duct Occluder og Amplatz® Canine Duct Occluder (ACDO). Både transvenøse og transarterielle ruter brukes. Siden ACDO ble utviklet mellom 2005 og 2007 har den vist å ha bedre suksessfrekvens og mindre komplikasjoner enn de andre innretningene, og er den mest brukte metoden i nyere tid (20). Den er laget av en nitinolnetting med en proksimal- og en distal disk og finnes i forskjellige størrelser (21). Valg av riktig størrelse er essensielt for suksess og korrelerer ikke med kroppsvekt (22). Diameter på PDA ostium og ampulla måles ved hjelp av transtorakal og/eller transøsofageal ekkokardiografi, og angiografisk med fluoroskopi. Ved hjelp av guide wires og intravaskulære kateter plasseres ACDO i femoralarterien som beskrevet i kasuistikk (21).
Kasuistikker
Begge hundene (Kasuistikk 1 og 2) ble henvist til AniCura Dyresykehus Oslo for utredning av bilyd på hjertet og mistanke om PDA.
Kasuistikk 1
Signalement og anamnese
En åtte måneder gammel pomeranian, hannhund, ble henvist for ekkokardiografisk undersøkelse og eventuell behandling av en mistenkt PDA. Hunden veide tre kg. Hunden viste ingen kliniske tegn på sykdom, men en bilyd over hjertet ble oppdaget da hunden var inne for helsesjekk ved seks måneders alder. Det var ifølge eier også bemerket en bilyd da valpen ble kjøpt.
Klinisk undersøkelse
Klinisk undersøkelse av hunden viste god allmenntilstand og normalt hold. Hjertefrekvens var 114/minutt, pulsfrekvens var 114/minutt og pulskvalitet i femoralarteriene var hyperkinetisk. Respirasjonsfrekvens var 24/minutt, respirasjonsmønsteret var kostoabdominalt, og det var ingen økte lungelyder ved auskultasjon av thorax. Hunden hadde en kraftig kontinuerlig bilyd med svirr som var tydeligst over venstre kraniale hjertebase. Slimhinnene var rosa med en kapillærfylningstid på 1-2 sekunder. Buken var myk og indolent, og rektaltemperaturen var 38,3 °C. Det var ingen andre avvikende funn ved klinisk undersøkelse.
Ekkokardiografi
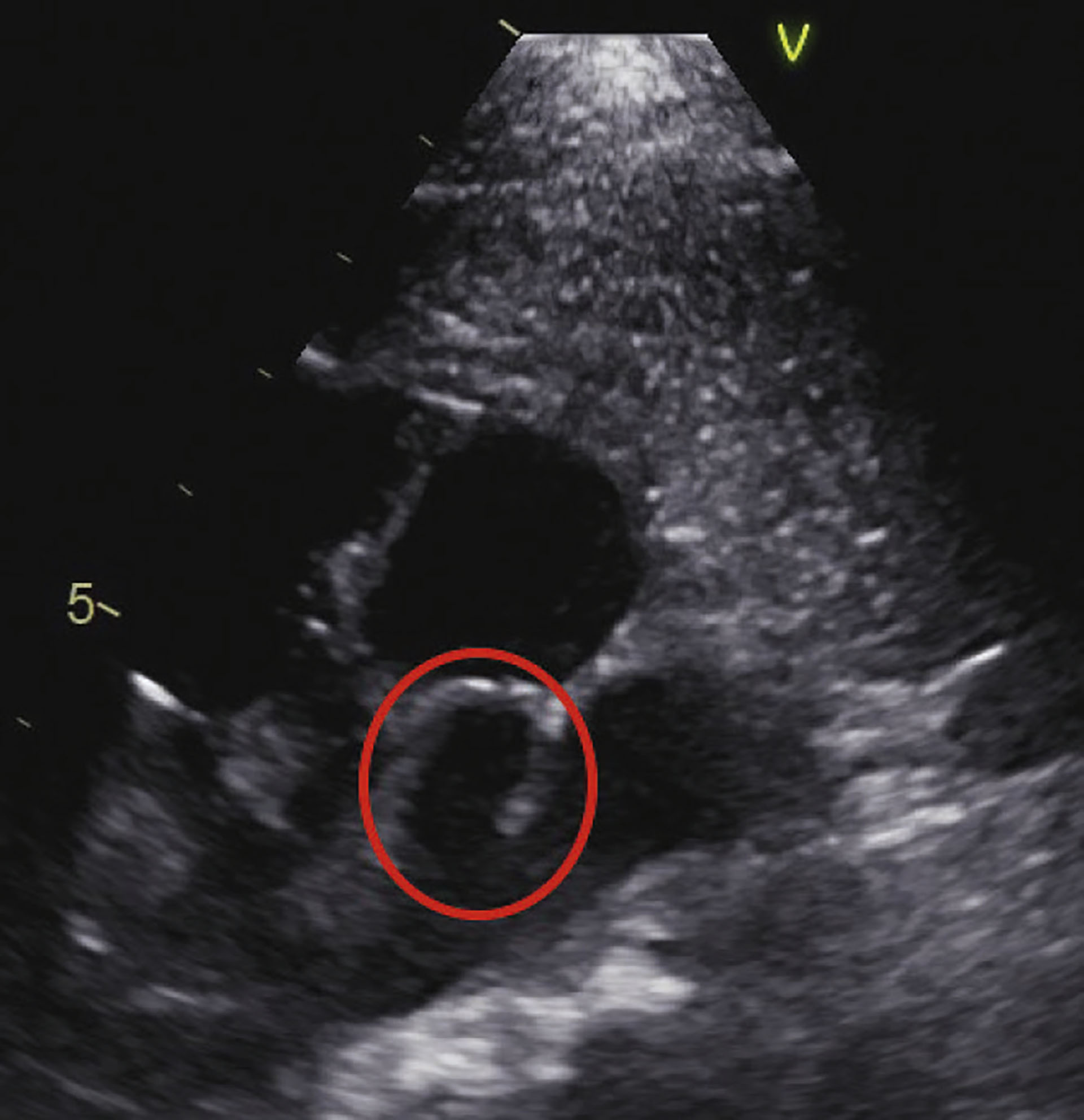
Figur 1: Sirkelen viser pda, med aorta under sirkelen og pulmonalarterien over.
Hunden ble lagt i høyre sideleie og EKG-apparat koblet på. Ekkokardiografisk undersøkelse ble utført med ultralydmaskin GE VividTM E90 og «phased array» probe 6S og 12S (2,4-8 og 4-12MHz). Hunden ble deretter lagt i venstre sideleie og undersøkt fra andre siden. Undersøkelsen viste økt diastolisk og systolisk volum samt økt diameter av venstre hovedkammer (økt LVVd, LVVs, LVIDDN og LVIDSN), samt en mild dilatasjon av venstre forkammer (økt LA:Ao SAX). Systolisk funksjon var nedsatt og fylningsmønster i venstre hovedkammer var restriktivt (økt mitral E og E:A) (Tabell 1). En sentral mitralislekkasje ble visualisert i venstre forkammer ved hjelp av fargedoppler.
I pulmonalarterien var det kontinuerlig turbulent retrograd blodstrøm, og det ble funnet en PDA med blodstrøm fra venstre til høyre side med en hastighet på 4,9 m/sek (Figur 1- 3). Elektrokardiografi viste sinusrytme med gjennomsnittlig hjertefrekvens på 136 slag per minutt, forkortet P-Q intervall og mistanke om aberrant atrioventrikulær konduksjon.
Parameter |
Resultat |
Resultat |
Resultat |
Resultat |
Referanseområder (23-31) |
|---|---|---|---|---|---|
LVVd (ml/kg) (SMOD) |
8,3 |
6 |
5,3 |
3 |
1,34-3,06 |
LVVs (ml/kg) (SMOD) |
3,66 |
2,6 |
2,6 |
1,6 |
0,77-0,94 |
EF (%) (SMOD) |
56 |
52 |
49 |
53 |
46-82,5 |
LA:Ao SAX |
1,67 |
1,56 |
1,32 |
1,39 |
<1.65 |
FS (%) |
21 |
21 |
15 |
21 |
25-40 |
LVIDDN |
2,35 |
2 |
1,85 |
1,84 |
<(1,73-1,85) |
LVIDSN |
1,29 |
1,5 |
1,45 |
1,4 |
<(1,14-1,26) |
EPSS (mm) |
5,3 |
- |
- |
- |
<6,5 |
IVRT (ms) |
53 |
55 |
- |
- |
40-80 |
E (m/s) |
1,19 |
0,92 |
- |
- |
0,5-1 |
A (m/s) |
0,62 |
0,59 |
- |
- |
0,3-0,6 |
E:A |
1,92 |
1,55 |
- |
- |
<1,58 |
E:IVRT |
2,2 |
1,67 |
- |
- |
<2,4 |
Diastolisk profil |
Restriktiv |
Normal |
- |
- |
Normal |
Forkortelser: EF (ejection fraction), EPSS (e point-septal separation), FS (fractional shortening), IVRT (isovolumic relaxation time), LA:Ao SAX (left atrium:aorta in short axis), LVIDDN (left ventricular inner diameter in diastole indexed), LVIDSN (left ventricular inner diameter in systole indexed), LVVd (left ventricular volume in diastole), LVVs (left ventricular volume in systole). E: Eearly diastolic transmitral flow velocity, A: ,Late diastolic transmitral flow velocity, E:A: ,Ratio between early and late diastolic transmitral flow velocity, E : IVRT: The ratio of early transmitral flow velocity to left ventricular isovolumic relaxation time
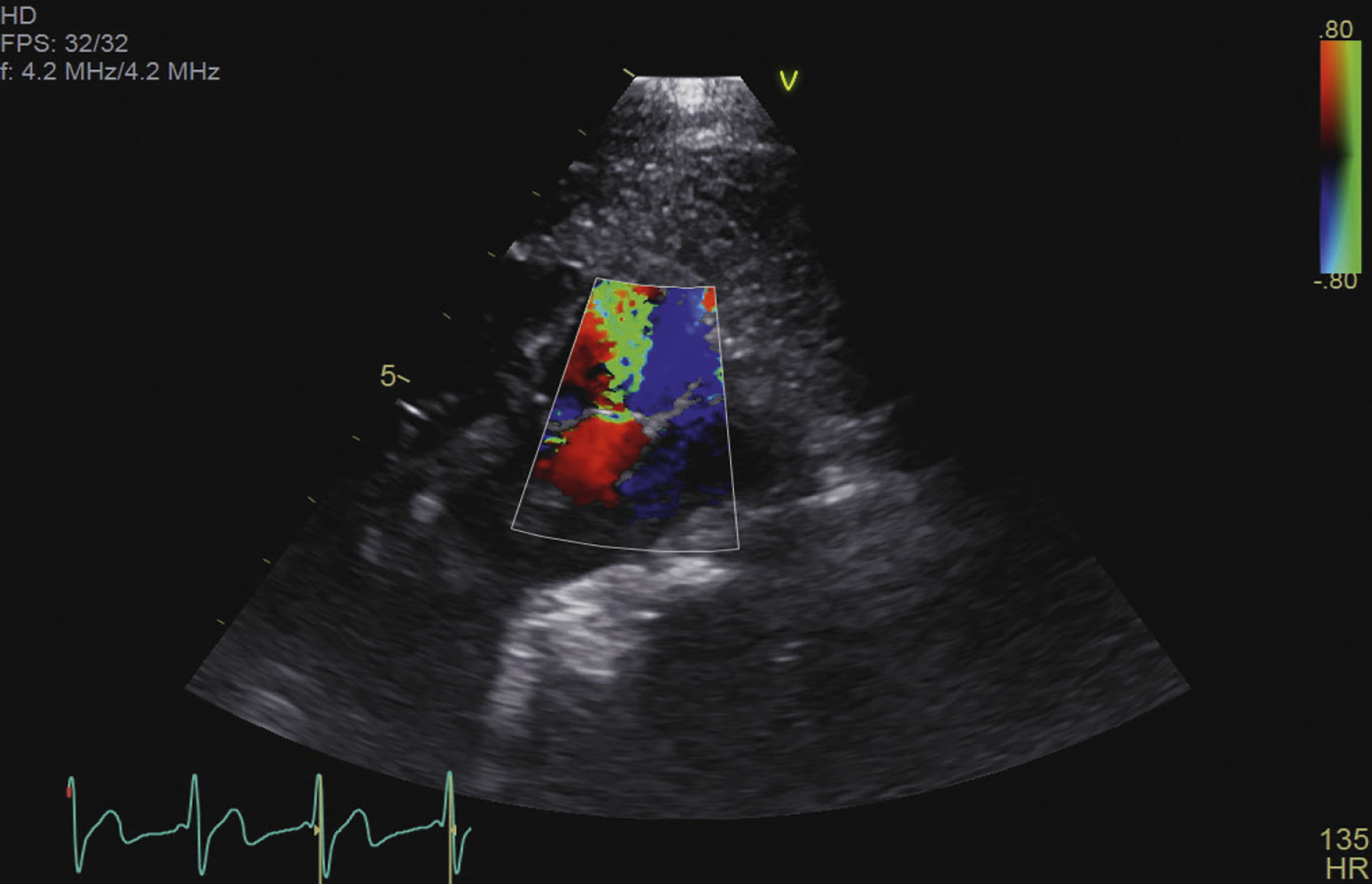
Figur 2: Fargedoppler viser turbulent retrograde blodstrøm fra aorta og inn i pulmonal-arterien gjennom PDA
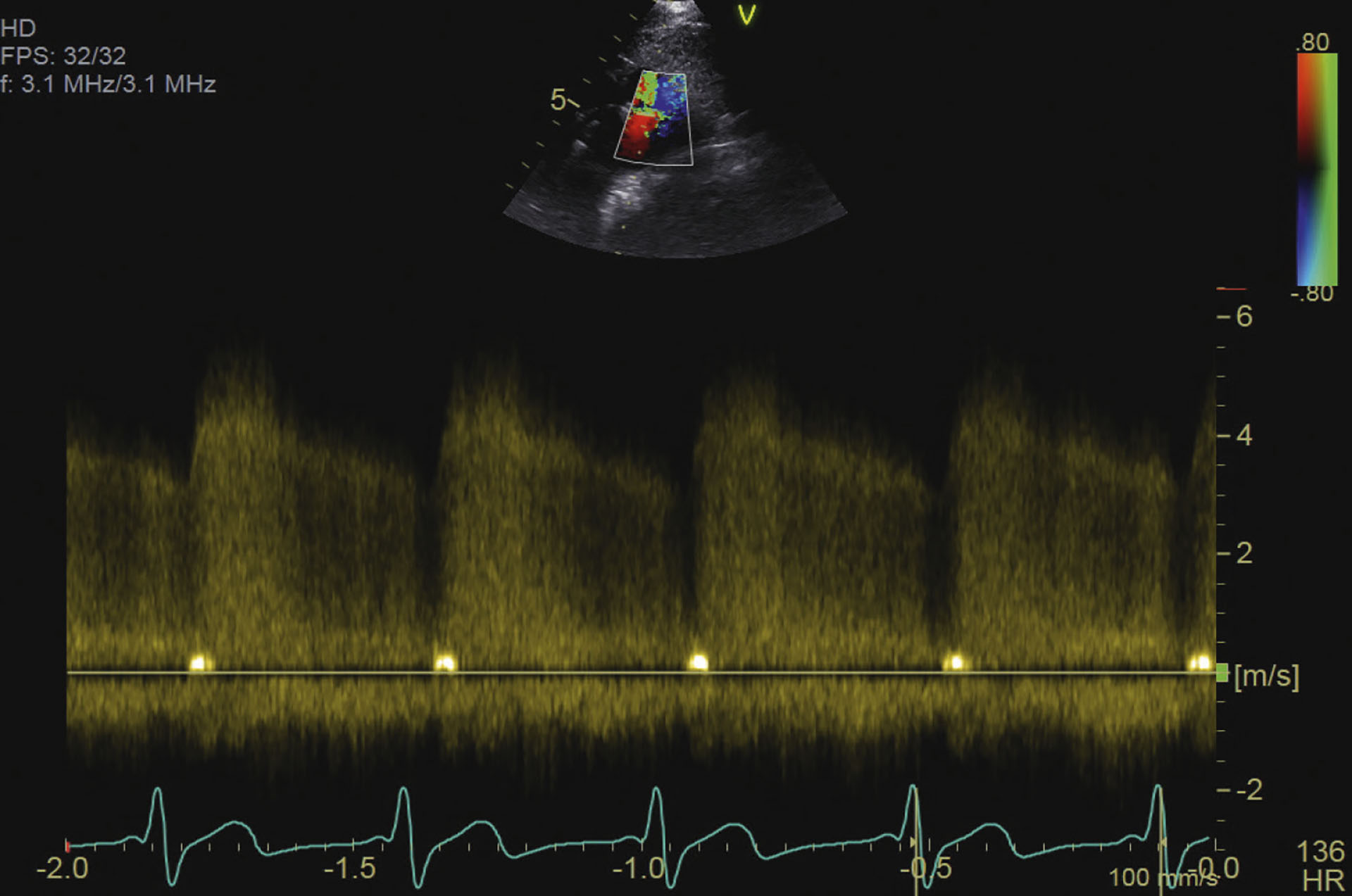
Figur 3: Continuous wave Doppler viser hastigheten og retning på blodstrøm gjennom PDA
Diagnose
Venstre-til-høyre shuntende PDA med mildt forstørret venstre for- og hovedkammer samt nedsatt systolisk funksjon.
Behandling
Det ble plassert en 22G venflon iv i høyre forben. Pasienten ble preoksygenert i 5 minutter og ble deretter sedert med 0,4 mg/kg metadon (Metadon NAF®, 10mg/ml) og 0,3 mg/kg midazolam (Midazolam Accord, 1 mg/ml) intravenøst. Anestesi ble indusert med 4 mg/kg propofol (PropovetTM Multidose, Zoetis, 10 mg/ml) og hunden ble intubert med en 5 mm endotrakealtube. Deretter ble den koblet til en ventilator og anestesi ble opprettholdt med isofluran (Isofluran®, Baxter) blandet med oksygen. En infusjon med 4 ml/kg/time ringeracetat (Ringer-acetat Fresenius Kabi AS) ble startet. Kontinuerlig infusjon med 10-30 µg/kg/time fentanyl (Fentadon vet, Eurovet, 50µg/ml) og 0,3 mg/kg/time (Ketalar, Pfizer, 50 mg/ml) ble igangsatt, og hunden fikk 2 mg/kg Robenacoxib (Onsior, Elanco, 20 mg/kg) og 1 mg/kg maropitant (Cerenia, Zoetis, 10 mg/ml) subkutant postoperativt. Hunden lå stabilt i anestesi under prosedyren med en hjertefrekvens på rundt 80/min og temperatur 38,1 °C. Blodtrykket før lukking var 89/39, MAP 55, og etter lukking 100/50, MAP 60. Det ble injisert 1 mg/kg bupivacain (Marcain, aspen, 2,5 mg/ml) lokalt mellom interkostalrom 3-5.
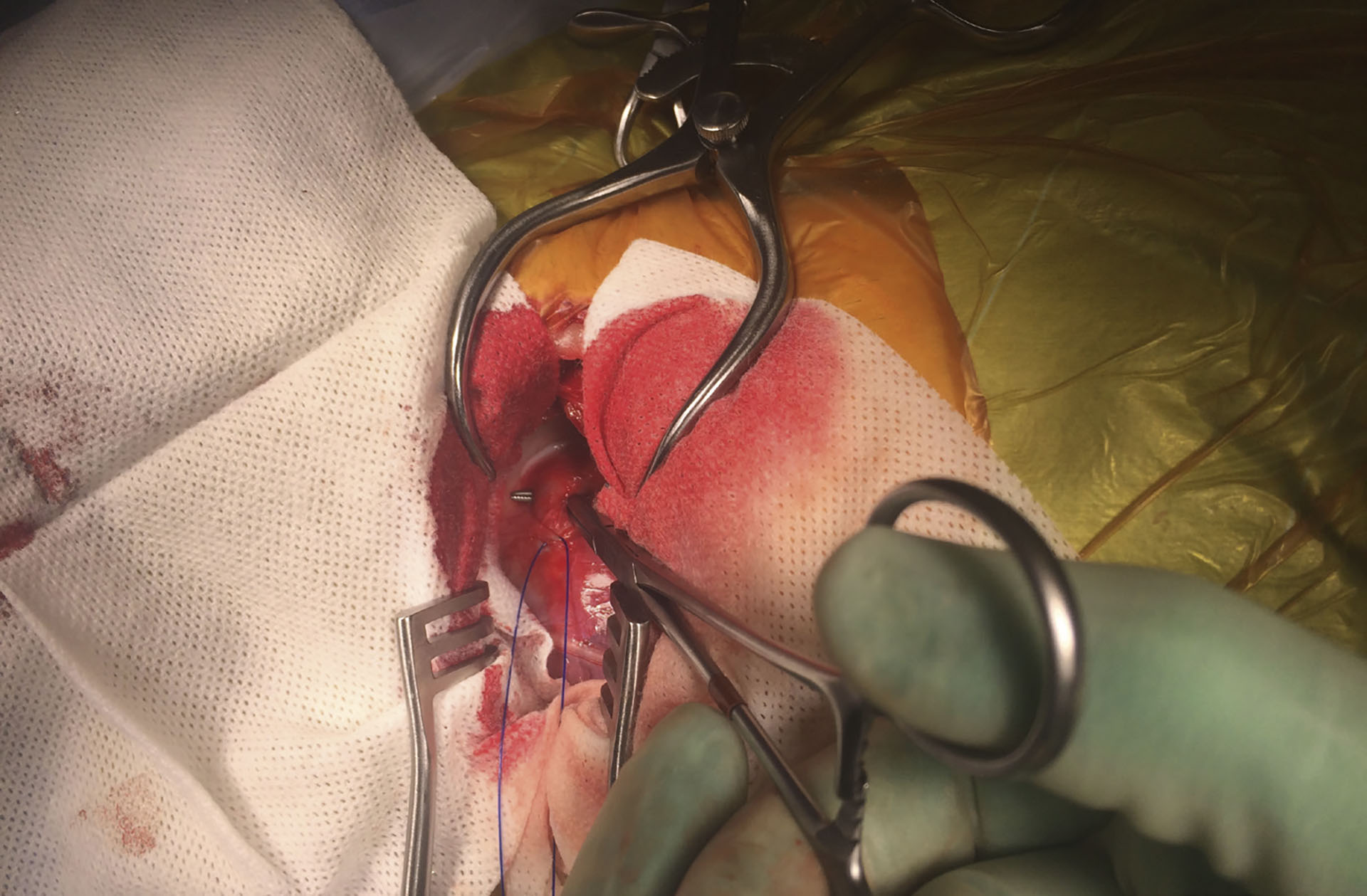
Figur 4: lahay forceps plassert rundt pda, før ligering. Vagus nerven er deflektert ventralt med holdesutur.
Det ble utført en torakotomi gjennom fjerde intrakostalrom på venstre side. Venstre kraniale lungelapp ble pakket kaudalt. Vagusnerven ble isolert med en holdesutur og deflektert ventralt. Det ble dissekert kranialt, kaudalt og medialt rundt PDA slik at det ble mulig å plassere en høyrevinklet Lahey forceps under, og PDA ble ligert med to Prolene 2.0 suturer (Figur 4). Vagus og lungelappen ble så frigjort. Det ble deretter verifisert at alveolene i lungelappen var luftfylte før lukking. En venflon ble plassert før lukking. Luft ble evakuert med venflonen som så ble fjernet. Det ble tatt postoperativt thoraxrøntgen som ikke viste tegn til pneumothorax eller kollaberte lunger. Det ble så plassert et 12 µg/time fentanyl depotplaster på høyre side av flanken og fentanylinfusjon ble fortsatt til dette ga effekt. Denne ble justert opp og ned etter behov og smertevurdering av hunden gjennom natten. Ketamininfusjonen ble avsluttet.
Hunden våknet raskt og ukomplisert med en hjertefrekvens på 98/min, pustefrekvens var 28/min, kapillær-fylningstid 2 sekunder og slimhinnene var rosa. Det ble ikke hørt noen bilyd etter lukking.
Kontroll postoperativt
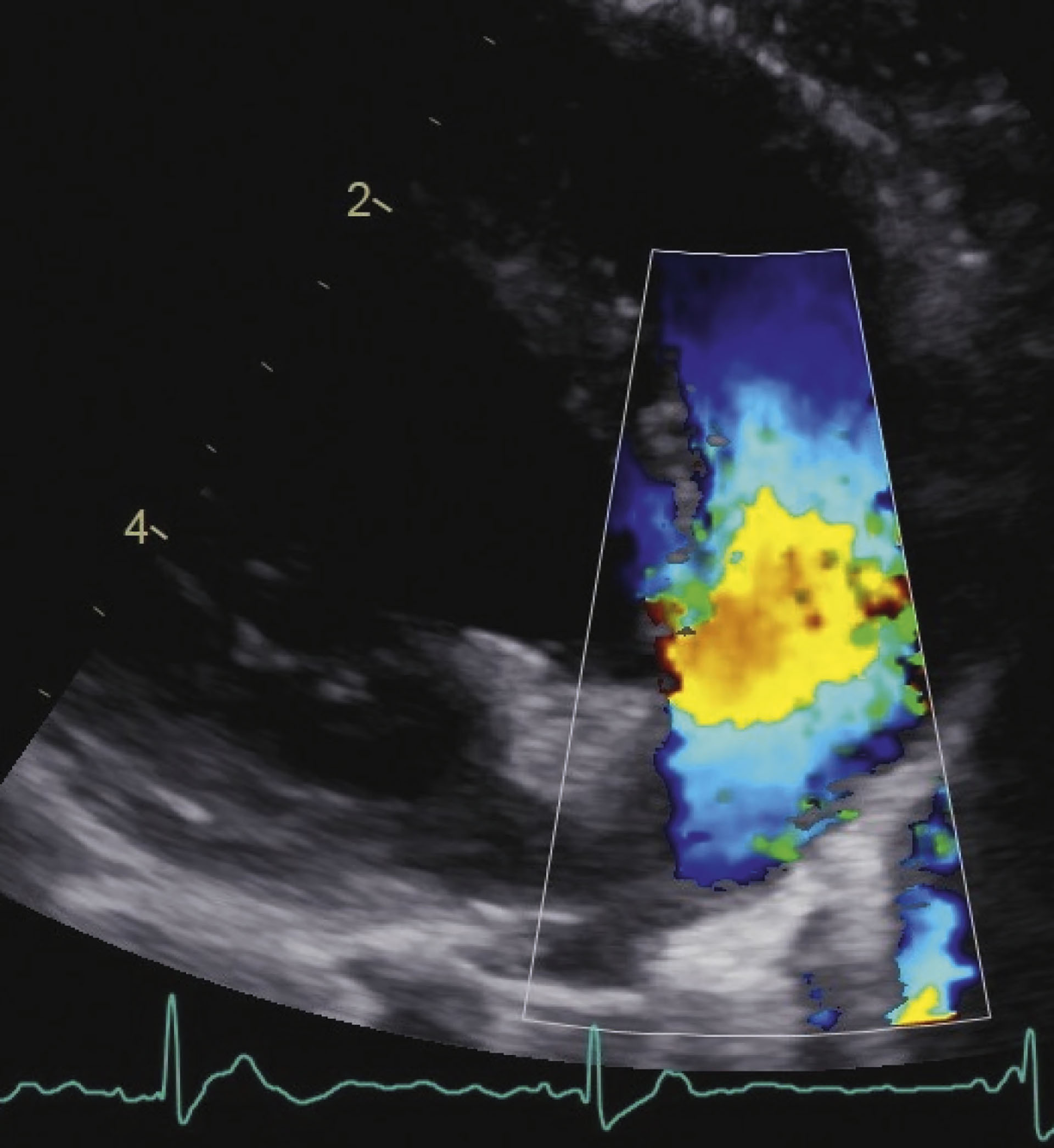
Figur 5: Viser pulmonalarterien etter lukking av pda, profil på farge-doppler er normal.
Hunden ble oppstallet til påfølgende dag, hvor det ble utført en ny ekkokardiografisk undersøkelse. Denne viste ingen residual blodstrøm over ductus (Figur 5), det var heller ingen mitrallekkasje. Diastolisk diameter av venstre hovedkammer var fortsatt økt (LVIDDN), men mindre enn preoperativt, og systolisk diameter var større enn før (LVIDSN). Venstre forkammer hadde normal størrelse (LA:Ao SAX). Fylningsmønsteret i venstre hovedkammer var nå normalt (E, A, og E:A) (Tabell 1). EKG viste normal sinusrytme med normal konduksjon og gjennomsnittlig hjertefrekvens på 92 slag per minutt. Det ble avtalt en kontroll om ti dager, og hunden fikk med en resept på 1 mg/kg robenacoxib (Onsior, Elanco) som skulle gis én gang daglig.
Kontroll etter to uker
Operasjonssåret hadde grodd fullstendig og det var ingen hevelse, rødhet eller smerte i området. Ultralydundersøkelsen viste at diameter på venstre forkammer var enda lavere (LA:Ao SAX). Hovedkammer var fortsatt forstørret i diastole og systole (LVVd, LVVs, LVIDDN, LVIDSN), så hunden ble startet på 0,25 mg/kg pimobendan (Vetmedin, Boehringer Ingelheim Vetmedica Gmbh) to ganger daglig.
Kontroll etter seks måneder
Siden sist hadde hunden vært i fin form, eier hadde seponert vetmedin tidlig av ukjent årsak. Hunden hadde 96/min hjertefrekvens, rosa slimhinner og jevn og fyldig femoralpuls.
Ekkokardiografisk undersøkelse viste ingen residualblodstrøm over PDA, ingen mitrallekkasje, normal størrelse på venstre forkammer (LA:Ao SAX), men fremdeles noe forstørret hovedkammer i systole (LVVs, LVIDSN) (Tabell 1).
Det ble ikke avtalt ytterligere kontroll, men eier ble anbefalt kontroll ved nye auskultatoriske funn som ny bilyd eller mistanke om rytmeforstyrrelser ettersom konduksjonsavvik hadde blitt påvist preoperativt.
Kasuistikk 2
Signalement og anamnese
En to år gammel Welsh springer spaniel, intakt tispe, ble henvist for ekkokardiografisk undersøkelse og eventuell behandling av en nyoppdaget bilyd. Denne hunden hadde heller ingen kliniske sykdomstegn, men hadde også en kraftig bilyd som ble oppdaget da hunden var nesten to år.
Klinisk undersøkelse
Klinisk undersøkelse av hunden viste en kraftig kontinuerlig bilyd med maksimum intensitet over venstre kraniale base. Et tydelig kontinuerlig svirr kunne kjennes kranialt over hjertet på venstre side. Pulsen var synkron med hjertet og hadde hyperkinetisk kvalitet. Hjertefrekvensen var 140/min, og respirasjonen var rolig og uanstrengt med en frekvens på 20/min. Slimhinnene var rosa, og kapillærfylningstiden 1-2 sekunder. Buken var myk og indolent og temperaturen var 38,3 °C. Det var ingen øvrige avvik ved klinisk undersøkelse.
Ekkokardiografi
Hunden ble lagt i høyre sideleie, koblet på EKG-apparat og en ekkokardiografisk undersøkelse ble utført med en GE Vivid E90 ultralydmaskin og «phased array» probe 6S (2,4-8 MHz). Hunden ble deretter lagt i venstre sideleie og undersøkt fra andre siden.
Parameter |
Resultat |
Resultat |
Resultat |
Resultat |
Referanseområder (23-32) |
|---|---|---|---|---|---|
EDVI (SMOD) |
108 |
72 |
64 |
53 |
<100 |
ESVI (SMOD) |
43 |
30 |
27 |
25 |
<30 |
EF (%) (SMOD) |
60 |
58 |
58 |
47 |
46-82,5 |
LA:Ao SAX |
1,76 |
1,56 |
1,31 |
1,35 |
<1.65 |
FS (%) |
26 |
28 |
28 |
29 |
25-40 |
LVIDDN |
2,13 |
1,72 |
1,54 |
1,56 |
<(1,73-1,85) |
LVIDSN |
1,48 |
1,23 |
1,17 |
1,13 |
<(1,14-1,26) |
EPSS (mm) |
8,23 |
6,3 |
- |
- |
<6,5 |
IVRT (ms) |
74 |
- |
- |
- |
40-80 |
E (m/s) |
0,71 |
- |
- |
- |
0,5-1 |
A (m/s) |
0,76 |
- |
- |
- |
0,3-0,6 |
E:A |
0,93 |
- |
- |
- |
<1,58 |
E:IVRT |
0,95 |
- |
- |
- |
<2,4 |
Diastolisk profil |
Delayed relaxation |
- |
- |
- |
Normal |
Forkortelser: EDVI (end diastolic volume indexed), ESVI (end systolic volume indexed) EF (ejection fraction), EPSS (e point-septal separation), FS (fractional shortening), IVRT (isovolumic relaxation time), LA:Ao SAX (left atrium:aorta in short axis), LVIDDN (left ventricular inner diameter in diastole indexed), LVIDSN (left ventricular inner diameter in systole indexed)
Undersøkelsen viste et volumoverloadet venstre for- og hovedkammer (økt EDVI, LVIDN, LA:Ao SAX) (Tabell 2). En sentral lekkasje ble påvist over mitralklaffen. Det var også en lekkasje over trikuspidklaffen som målte 2,5 meter per sekund. Det var retrograd turbulens i pulmonalarterien, og det ble påvist en PDA med blodstrøm fra venstre til høyre side med en hastighet på 5,34 meter per sekund (Figur 6-8).
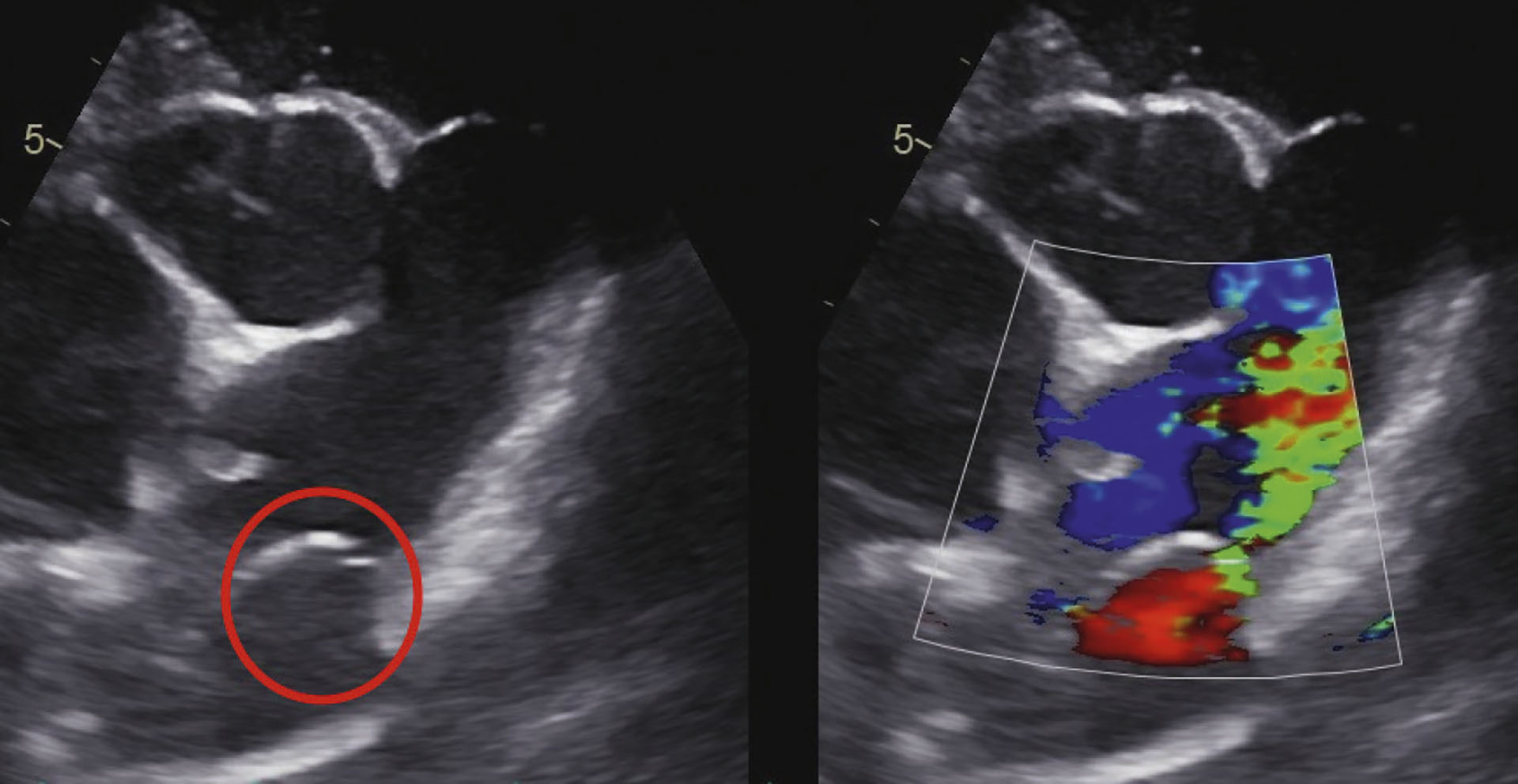
Figur 6: Sirkel viser pda, bilde til høyre viser den turbulente blodstrømmen gjennom pda med retrograd blodstrøm, fra aorta og inn i pulmonalarterien.
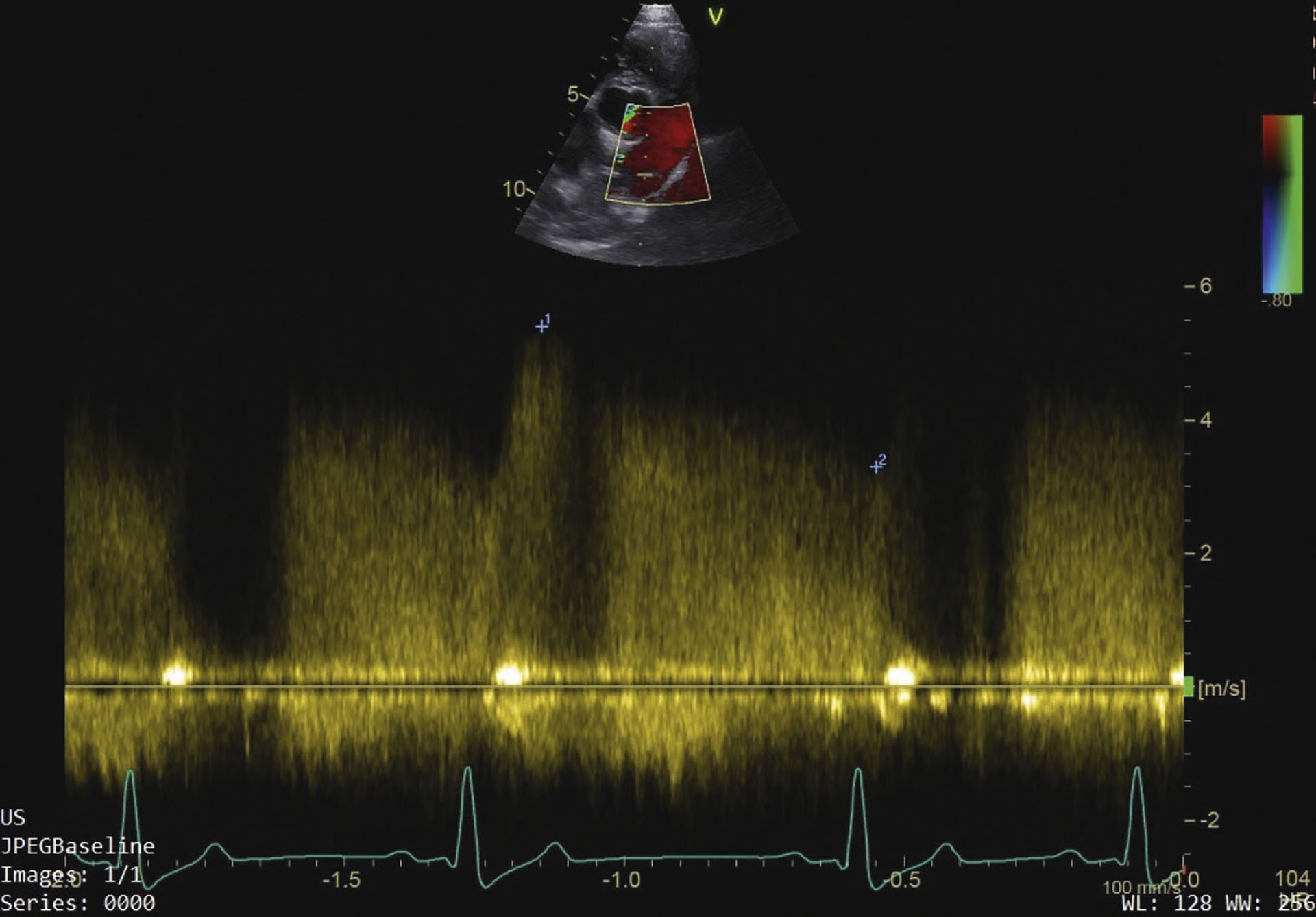
Figur 7: Continuous wave doppler viser hastighet og retning på blodstrømmen gjennom pda.
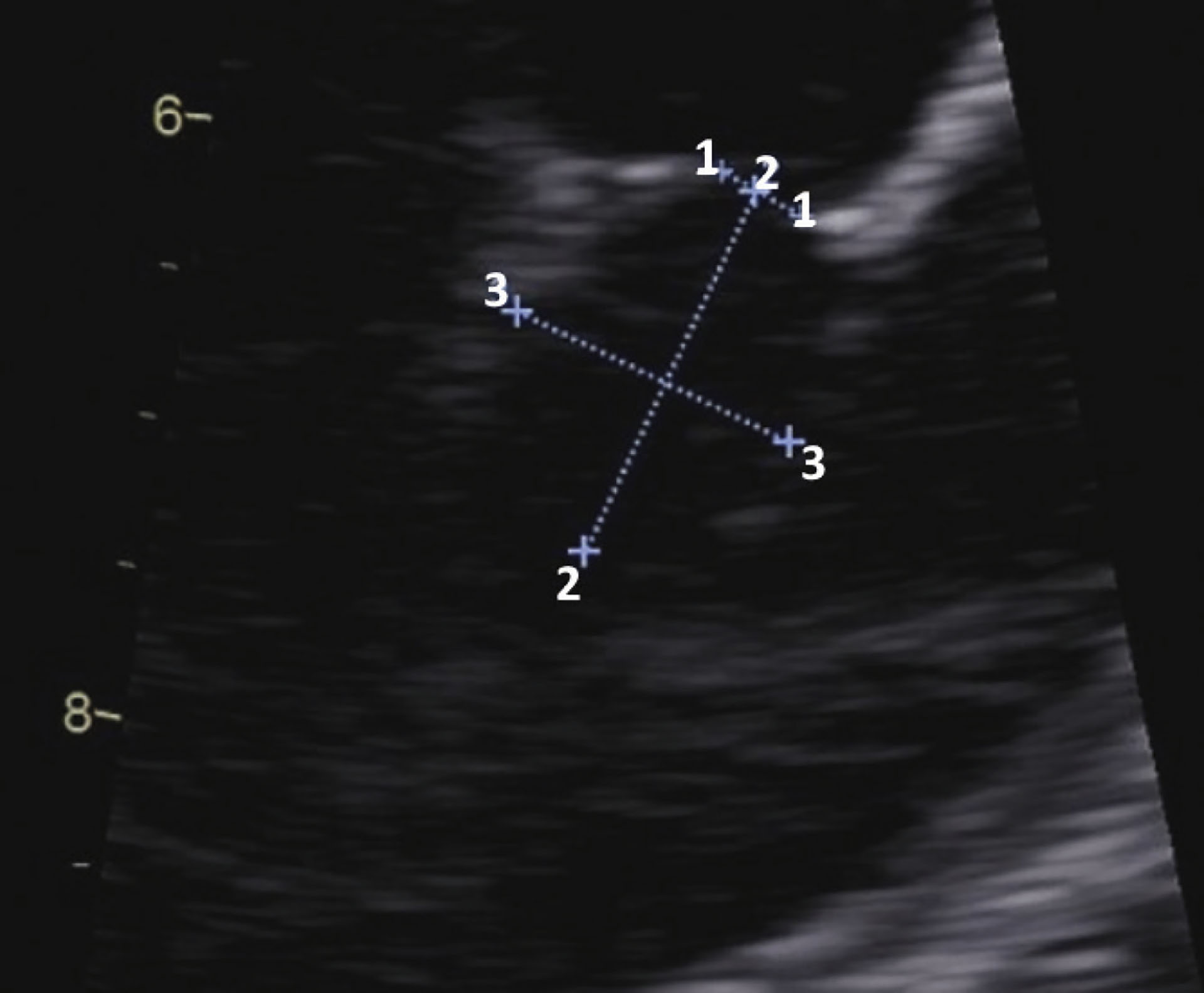
Figur 8: Viser størrelsen på pda ostium (1), pda ampulla lengde (2) og - ampulla bredde (3)
Diagnose
Venstre-til-høyre shuntende PDA med forstørret venstre for- og hovedkammer.
Behandling
Pasienten ble sedert med 0,4 mg/kg metadon (Metadon NAF®, 10 mg/kg) intramuskulært og 0,01 mg/kg acepromazin (Plegicil, 10mg/ml) intravenøst. Det ble gitt 1 mg/kg maropitant (Prevomax, Le vet beheer b.v., 10 mg/ml) og 2 mg/kg robencoxib (Onsior, Elanko, 10 mg/ml) subkutant. Anestesi ble indusert med 1,4 mg/kg propofol (Propovet multidose, Zoetis, 10 mg/ml) intravenøst. Hunden ble intubert med en 10 mm endotrakealtube og koblet på en ventilator med isofluran (Isofluran®, Baxter) blandet med oksygen gjennom prosedyren med en respirasjons-frekvens på 13-14 pust per minutt. Det ble gitt en isoton infusjon med 4 ml/kg/time ringeracetat (Ringer-acetat Fresenius Kabi AS).
Hunden lå stabilt i anestesi gjennom prosedyren med kapillær-fylningstid på 2 sekunder, rosa slimhinner, blodtrykk på 110/55 med MAP 70-80 (MAP økte etter lukking av PDA) og en temperatur på 36,7 °C.
Hunden ble plassert i høyre sideleie, med venstre bakben strukket opp og ut til siden slik at medialsiden av høyre lår ble tilgjengelig. Høyre bakben ble aseptisk preparert fra lysken til kneet. Personalet involvert i prosedyren, inkludert to veterinærer og tre assistenter, hadde på seg heldekkende blyfrakker og blykrager for å beskytte seg mot stråling. Veterinærene hadde steril operasjonsfrakk over blyfrakken. Protokoll for minimering av stråling ble fulgt gjennom hele prosedyren, pulsert gjennomlysing ble hovedsakelig brukt istedenfor kontinuerlig gjennomlysing, og avstand mellom fluoroskopienhet og pasient var minimal (Figur 9).
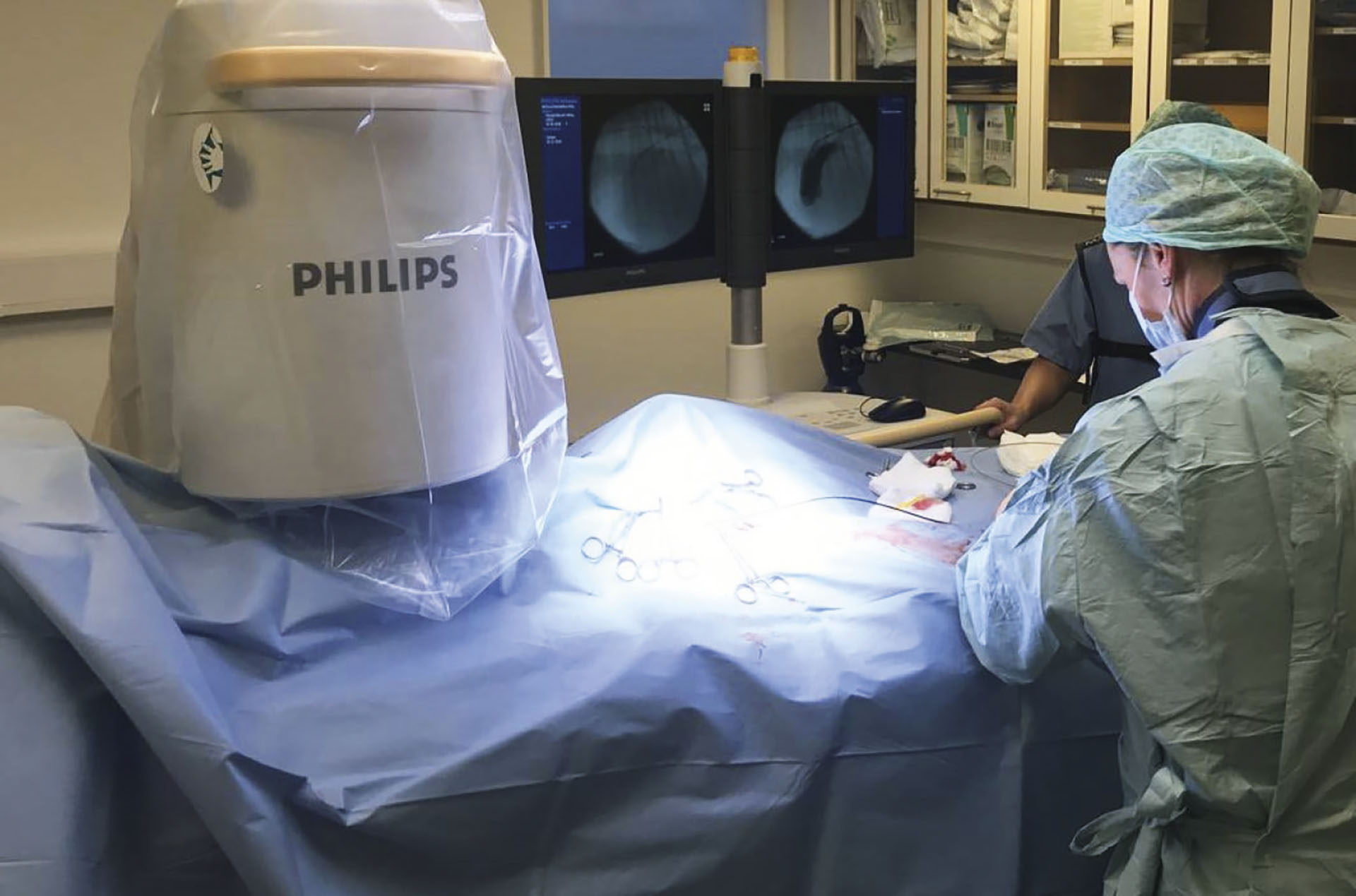
Figur 9: Bildet viser steril drapering av operasjonsbordet og pasient og fluoroskopienhet med minimal avstand til pasient.
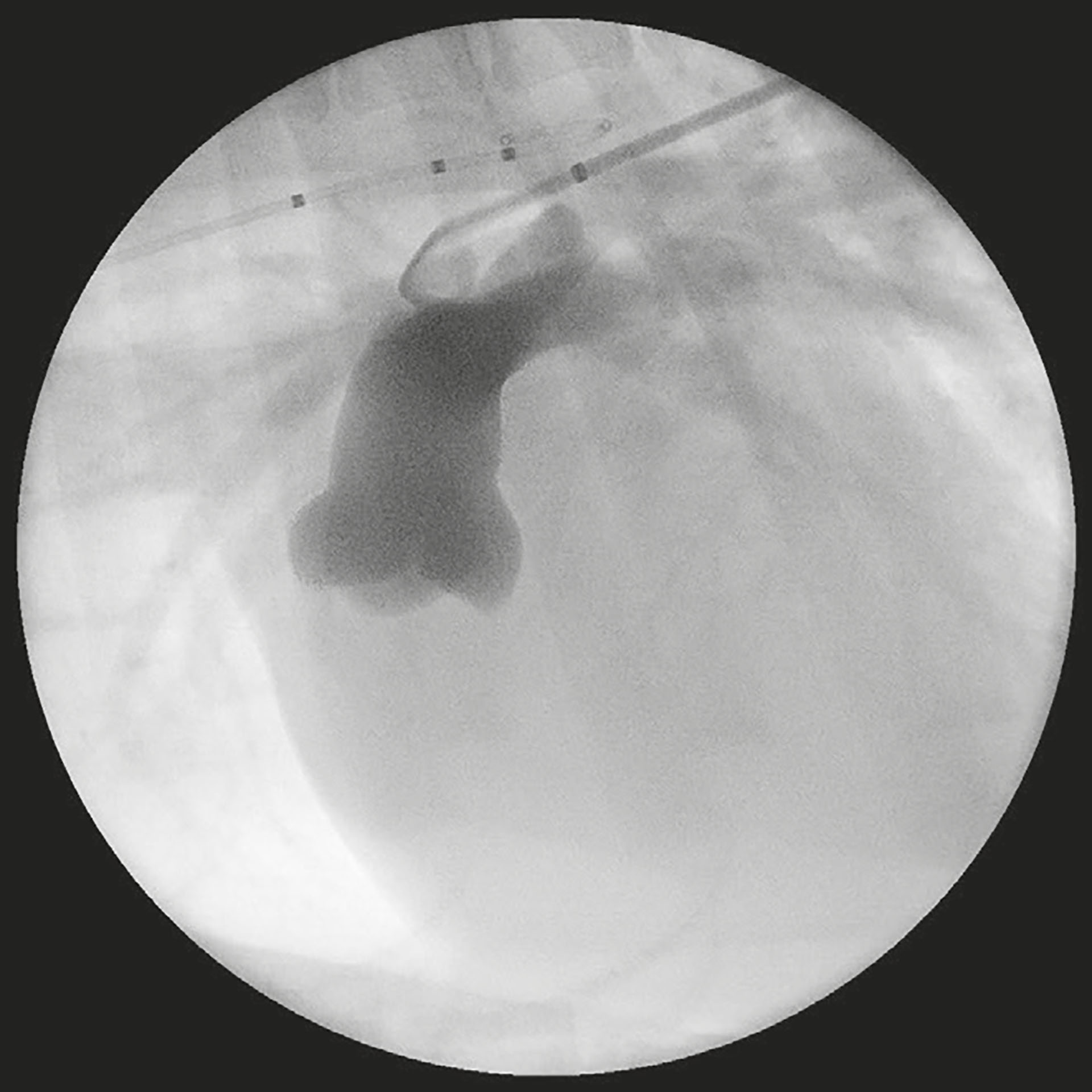
Figur 10: Kontrast gjennom pda
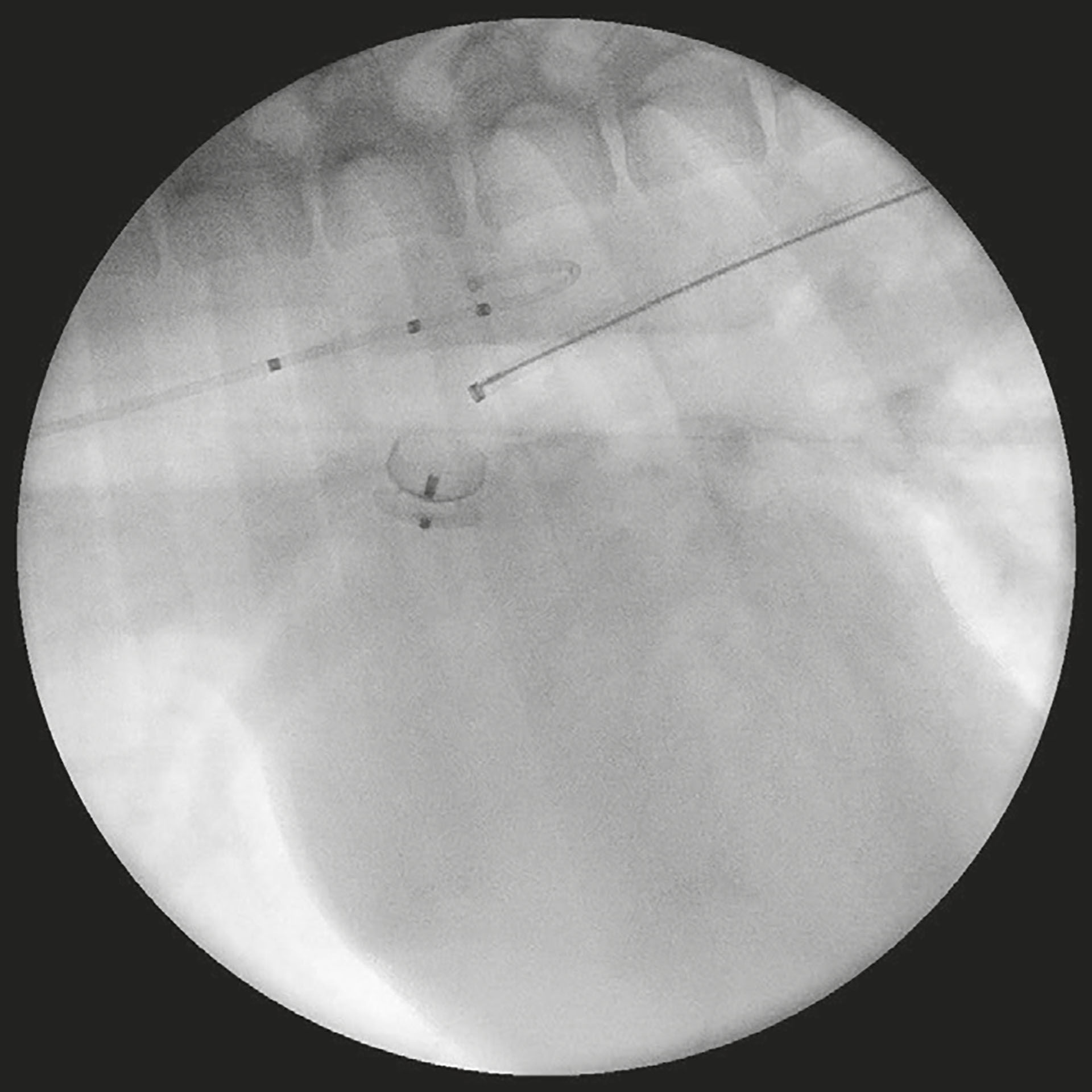
Figur 11: Acdo slippes
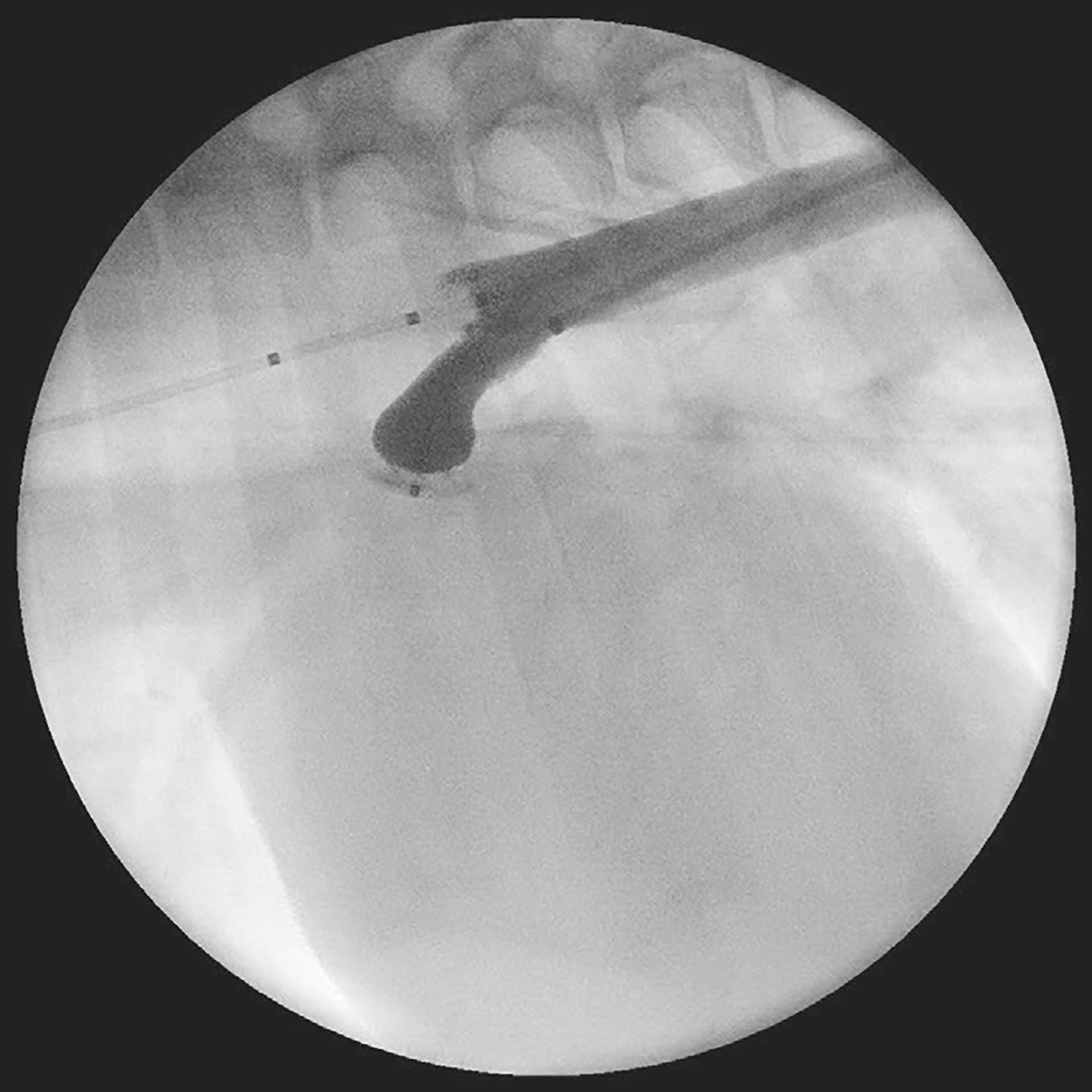
Figur 12: Kontraststudie etter at acdo er plassert viser fravær av blodstrøm over pda.
Det ble dissekert ned til høyre femoralarterie, og to holdesuturer ble plassert rundt den. En «introducer» ble plassert ved hjelp av seldingers teknikk (33). Den distale holdesuturen ble ligert, og en guidewire ble introdusert videre gjennom aorta og til like distalt for PDA med hjelp av fluoroskopi (Phillips BV Pulsera). Et endehullkateter ble ført over guidewire, og guidewire ble fjernet. 120 mg/kg iohexol (omnipaque, GE healthcare, 300 mg/ml) ble sprøytet inn i kateteret. Ostium ble målt til 4,4 mm og ampulla til 8,5 x 13,6 mm. Leveringskateter ble ført inn gjennom PDA med dilator og guidewire som så ble fjernet slik at kun leveringskateter ble liggende i pulmonalarterien. En størrelse 8 ACDO ble ladet inn i leveringskateteret og ført inn i pulmonalarterien. Den distale disken ble åpnet, og ACDO ble dratt inn mot ostiumet. Den proksimale disken ble så åpnet på andre siden av ostium. Nye mål ble tatt av ACDO for å sikre god passform, og etter åtte minutter ble ACDO sluppet. 120 mg/kg iohexol (Omipaque, GE healthcare, 300 mg/ml) ble sprøytet inn i kateteret. Det passerte ingen kontrast gjennom PDA. Arterien ble ligert og såret ble lukket. Det ble lagt trykk på såret i fem minutter. Figur 10 viser kontraststudiet før ACDO er plassert, Figur 11 viser ACDO etter at den har blitt sluppet og Figur 12 viser kontraststudiet etter at ACDO er plassert. Klinisk audit ble journalført i etterkant av prosedyren som en del av dyresykehusets kvalitetsforbedrende rutiner, og inkluderte strålingsdose, tidsintervaller for ACDO slipp og pasientdetaljer.
Kontroll postoperativt
Hunden ble oppstallet til neste dag og virket komfortabel i buret og på tur, og spiste med god appetitt. Postoperativt hadde hunden en hjertefrekvens på 80 slag i minuttet, og en pustefrekvens på 32 pust i minuttet.
Neste dag ble det utført ny ekkokardiografisk undersøkelse. Det var ingen blodstrøm over PDA, og ACDO var på plass (Figur 13). Volumet i venstre hovedkammer var redusert og innenfor referanseverdien (EDVI og LVIDDN). Diameter på venstre forkammer var også redusert og innenfor normalen (LA:Ao SAX) (Tabell 2). Hunden ble sendt hjem med instruks om å holdes i ro de neste tre dagene. Deretter skulle de gradvis trappe opp aktivitetsnivået til normalt de neste to ukene. Bandasjen over såret i lysken skulle de fjerne etter tre dager, og for å unngå slikking på såret måtte hunden bruke halskrage til såret hadde grodd.
Kontroll etter to uker
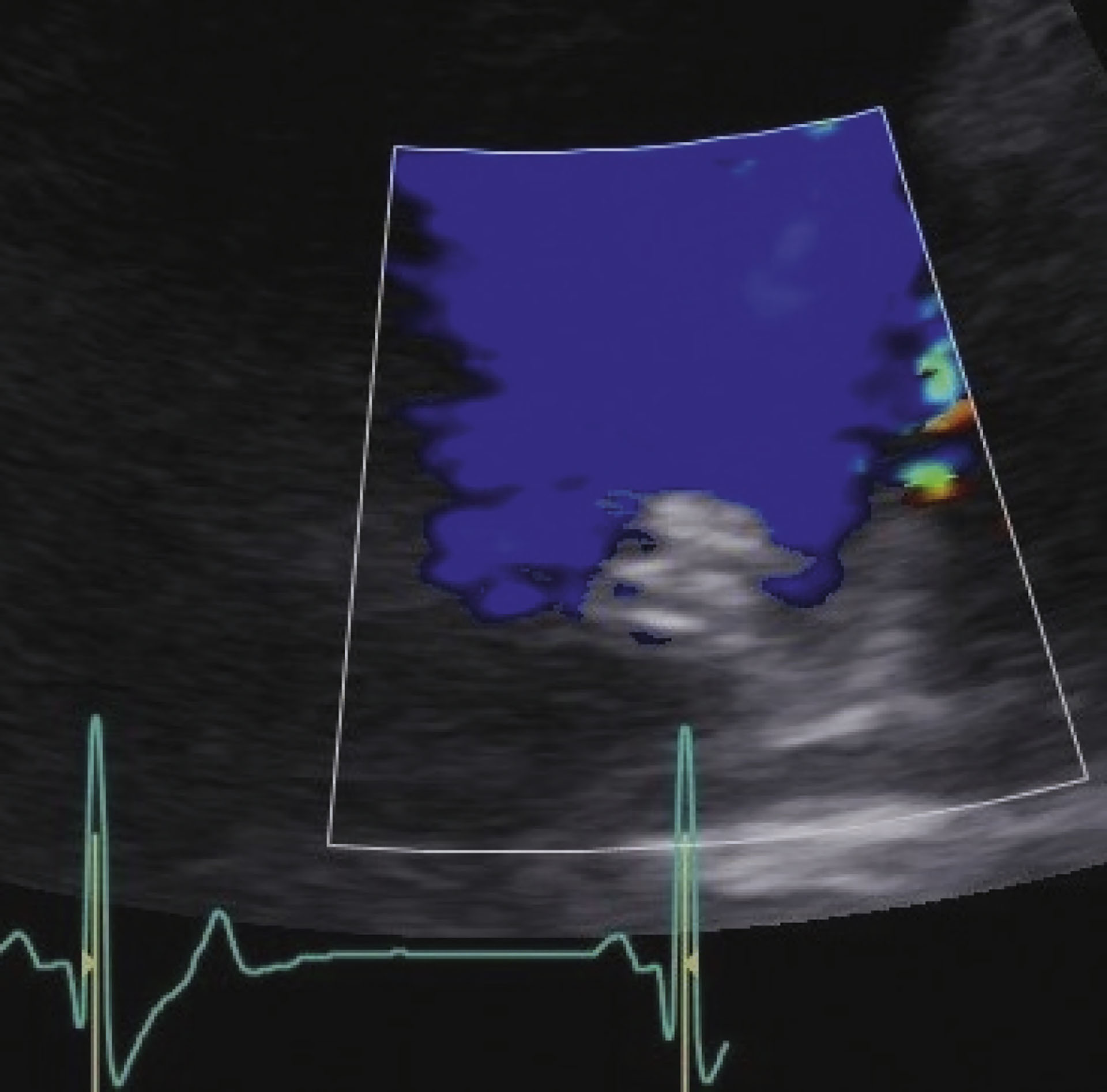
Figur 13: Etter okklusjon er acdo synlig, og det er ingen turbulent blodstrøm i pulmonalarterien.
Hunden hadde vært i fin form etter at den kom hjem. Den var noe roligere enn før med nedsatt mat- og drikkelyst, men eierne mistenkte at det var på grunn av halskragen. Såret hadde grodd fullstendig, og kun et lite arr var synlig. Det var ikke rødt eller hovent. Ved klinisk undersøkelse var hunden kvikk og alert med rosa slimhinner og en kapillærfylningstid på under 2 sekunder. Det kunne ikke høres bilyd, hjerterytmen var regelmessig og hjertefrekvensen var 114/minutt. Pustefrekvensen var 24/min og uanstrengt, og det kunne ikke høres noen økte lungelyder. Det var ingen blodstrøm over PDA, og ACDO satt fortsatt på plass. Diameter og volum på venstre hovedkammer var ytterligere redusert (EDVI, LVIDDN), det samme var diameteren på venstre forkammer (LA:Ao SAX) (Tabell 2).
Kontroll etter seks måneder
Hunden hadde vært i fin form siden inngrepet. Ved klinisk undersøkelse var hunden kvikk og alert, med rosa slimhinner, kapillærfylningstiden var 1 sekund, og hjertet hadde en rolig jevn rytme uten bilyd. Hjertefrekvensen var 100/minutt og pustefrekvensen 24/minutt. Pusten var rolig og uanstrengt.
Ekkokardiografisk undersøkelse viste ingen lekkasjer eller defekter (Tabell 2), og det var normal hjertekammerstørrelse og funksjon. ACDO satt i korrekt posisjon. Det ble ikke avtalt ytterligere kontroller.
Diskusjon
Artikkelen beskriver to behandlingsmetoder for okklusjon av PDA hos hund, kirurgisk ligering og transarteriell okklusjon med ACDO.
Suksessraten for de to behandlingsmetodene er rapportert som tilnærmet lik (20, 34). For øvrig rapporteres det om stadig forbedring av teknikk for transvaskulære okklusjonsmetoder, og det forventes å se en lavere komplikasjonsfraksjon og mortalitet i fremtidens studier (35).
Transvaskulær PDA okklusjon er forbundet med vesentlig mindre postoperativ morbiditet og smerter sammenlignet med det man ser ved kirurgisk ligering med torakotomi, men for å kunne gjennomføre transvaskulære prosedyrer kreves spesialkompetanse og fluoroskopi og/eller transøsofageal ekkokardiografi. Det er en viss risiko for embolisering av ACDO eller ufullstendig lukking av PDA ved transvaskulær okklusjon, og passering av ACDO via femoralarterien har en størrelsesbegrensende faktor da det kreves en viss arteriediameter for å kunne passere store nok leveringskatetere. Ordinær kirurgisk ligering av PDA krever også vesentlig kirurgisk kompetanse, men er ikke avhengig av spesialutstyr som fluoroskopi og utstyret som benyttes er mindre kostbart.
Hulsman et al. har beskrevet bruken av Amplatzer Vascular Plug 4 (AVP) som også er en selvekspanderende innretning på hunder som er for små til å få en ACDO. Dette er en transvenøs okklusjonsmetode der femoralvene benyttes for passering av AVP. De konkluderte med at dette var et trygt og effektivt alternativ, men studien inkluderte kun syv hunder (36). En nyere studie konkluderte det samme og rapporterer bruk av AVP-II for transvenøs okklusjon av PDA hos 19 hunder (35).
I en retrospektiv studie sammenlignet Ranganathan et al. intraoperative komplikasjoner og overlevelse mellom kirurgisk ligering og ACDO hos 120 hunder med PDA. De to gruppene hadde lik overlevelsesfrekvens, men det ble sett mer alvorlige komplikasjoner med kirurgisk lukking (34). Studier som er gjort på mortalitet ved kirurgisk behandling er gjort på spesialistsenter, mens kirurgisk lukking av PDA også gjøres på mindre klinikker, så den reelle totale mortaliteten er trolig høyere enn det som rapporteres (17). Overlevelsesfrekvensen er rapportert som høyere hos yngre og lettere hunder i en eldre retrospektiv studie med 100 hunder (12). En senere retrospektiv studie av Birchard et al. med 201 hunder fant ingen sammenheng mellom alder, vekt og overlevelse (37).
Dersom behandlingen er vellykket har PDA pasientene svært god prognose. I Birchards studie var formålet å kartlegge risikofaktorene med kirurgisk behandling. Av disse 201 pasientene døde 7 % under operasjonen på grunn av blødning, lungeødem, ventrikulær fibrillasjon eller hjertestans. Fire prosent døde innen 1 måned etter operasjonen. 9,5 % av hundene fikk en blødning som ikke var dødelig, og 7 % fikk andre komplikasjoner som lungeødem, hjertestans, iatrogent lungetraume, ventrikulære fibrillasjoner, sepsis og rekanalisering av ductus. Denne studien er over 30 år gammel, så det er naturlig å tro at operasjonsteknikk og overvåkning har bedret seg fra den gang. Ranganathan et al. sin studie fra 2018 rapporterte mortalitet ved kirurgisk lukking som 1,8 % (34).
I en retrospektiv studie av 520 hunder med PDA som ble lukket hadde hunder med kliniske tegn, annen medfødt hjertelidelse og kraftig mitralisinsuffisiens dårligere overlevelsesfrekvens. Hunder med økt ventrikulære systoliske dimensjoner og systolisk dysfunksjon får ofte persisterende remodellering av hjertet, som hos hunden beskrevet i kasuistikk nummer en (7). I en annen retrospektiv studie av 52 hunder med kirurgisk lukking av PDA var det ingen sammenheng mellom mitralisinsuffisiens og overlevelse (17).
Begge pasientene beskrevet i denne artikkelen våknet rolige og virket komfortable. Forskjellen var bruken av analgesi. Hunden som hadde gjennomgått torakotomi fikk fentanylinfusjon intraoperatovt og postoperativt til depotplasteret tok effekt. Den ble sendt hjem med fentanylplaster som virket de første dagene og fikk robenacoxib de første ti dagene. Hunden som hadde det transvaskulære inngrepet fikk metadon som premedikasjon og robenacoxib perioperativt, men ellers var ingen analgesi nødvendig. Kirurgisk okklusjon av PDA innebærer betraktelig mer postoperativ smerte enn transvaskulær okklusjon.
Postoperativt vil størrelsen på venstre ventrikkel minke ettersom preload reduseres, og med tiden vil systolisk funksjon kunne øke dersom remodellering ikke persisterer. Allerede etter 24 timer kan det ses en reduksjon av LVIDd, LVIDs, EDV, ESV og ESVI. Reduksjonen er større hos mindre hunderaser (38). Det vil si at mindre hunder tolererer volumoverload bedre enn større hunder. Man kan derfor vurdere å vente til pasienten er stor nok til intervensjonell lukking, selv om risikoen for reversering fortsatt er like stor. Bilyd på grunn av mitral-regurgitasjon forsvinner vanligvis innen to dager (2). Nedgang i størrelse på venstre for- og hovedkammer kan ta mer enn seks måneder (7). Vi så en signifikant nedgang av volum i venstre hovedkammer i systole og diastole hos begge hundene. Hund 1 hadde en 28 % nedgang i volum i diastole og systole, og hund 2 hadde en 32 % reduksjon av volumet i diastole og en 29 % endring i systole. Normalisert hovedkammerdimensjon minket postoperativt hos begge pasientene, men normaliserte seg ikke på hund 1. Det hadde vært interessant å følge denne pasienten videre for å se om verdiene normaliserte seg. Dette ble ikke prioritert da eier ikke ønsket å gi vetmedin, så videre kontroller ville ikke ha endret behandlingen. Den ville sannsynlig ikke bli verre, og eier ble instruert i å komme på kontroll dersom hunden utviklet en bilyd som kan skje hvis hunden utvikler endokardiose, eller om videre dilatasjon av hovedkammer fører til sekundær mitral lekkasje. Hos hund 2 var både LVIDDN og LVIDSN normale allerede etter 24 timer. Venstre forkammer minsket til innenfor referanseverdien innen 24 timer på begge pasientene.
Den umiddelbare effekten etter okklusjon av PDA er brå nedgang i preload, som resulterer i at venstre for- og hovedkammer blir mindre i henhold til Starlings lov. Samtidig blir afterload økt på grunn av økt systemisk vaskulær motstand som også bidrar til enda mindre størrelse på venstre hovedkammer i diastole, men ikke systole. Dette fører til at man måler systolisk funksjon som lavere, som ved Kasuistikk 1. Vedvarende remodellering med svekket systolisk funksjon som følge av defekten kan også forekomme som ved Kasuistikk 1, men er ikke ansett som klinisk relevant (7).
Når en PDA-pasient legges i anestesi må det vektlegges at disse pasientene ikke er kardiovaskulært stabile i utgangspunktet. Før lukking av PDA har pasientene vanligvis høyere hjertefrekvens og lavere diastolisk trykk enn hos friske hunder. Dette bedres innen 20 minutter etter lukking av PDA (39). Ingen av våre pasienter hadde hypotensjon under prosedyrene, men det diastoliske trykket lå i nedre grense før lukking av PDA. Total intravenøs anestesi (TIVA) gir generelt mindre hypotensjon enn inhalasjonsanestesi (40). I en kasuistikk av en hund som måtte ha to prosedyrer for å korrigere en PDA ble det brukt inhalasjonsanestesi først, og deretter TIVA (41). Pasienten hadde hypotensjon under inhalasjonsanestesi, mens den var kardiovaskulært stabil med TIVA. Dette var kun én pasient, og en større pasientgruppe må studeres for å trekke denne konklusjonen når det gjelder PDA-pasienter, men det kan vurderes å bruke TIVA på pasienter med PDA for å unngå hypotensjon.
Kasuistikk 1 hadde fått påpekt en bilyd allerede da den ble kjøpt ved åtte ukers alder. Eier hadde blitt forklart at bilyden var uskyldig uten betydning for valpen. Det senere funnet av PDA illustrerer hvor viktig det er at alle valper med bilyd følges opp og undersøkes med ekkokardiografi. De ekkokardiografiske verdiene hos denne pasienten hadde enda ikke normalisert seg etter 6 måneder, og det hadde vært interessant å vite om dette hadde vært annerledes hvis den hadde vært operert tidligere.
Kasuistikk 2 var to år da den ble henvist, noe som er relativt gammelt for en PDA-pasient. Det ble funnet en trikuspidregurgitasjon med en hastighet på 2,5 m/sek. Dette tilsvarer en trykkforskjell mellom høyre forkammer og høyre hovedkammer på 25 mmHg. I fravær av pulmonal stenose er trykkgradient over 30 mmHg en indikasjon på pulmonal arteriell hypertensjon, og vi kan derfor konkludere at PDA hos denne hunden ikke var i ferd med å reversere. PDA hos hunder har med godt resultat blitt lukket med pulmonal hypertensjon, men det er ikke mulig når shunten reverseres (42). Ved å avvente operasjon hos hunder med PDA er det en risiko for utvikling av venstresidig hjertesvikt eller pulmonal hypertensjon og reversering av shunten. I tillegg er det risiko for persisterende remodellering som vi så hos Kasuistikk 1.
Det finnes hunder som ikke faller inn under den klassiske presentasjonen av PDA hvor den kraftige bilyden blir oppdaget når de er valper. I en retrospektiv studie ble 24 hunder som var over 24 måneder når de fikk diagnosen PDA studert (13). Sykdomsforløpet samt respons på lukking av PDA ble vurdert. Seksten hunder ble behandlet, og de kliniske tegnene ble borte hos alle bortsett fra én. På oppfølgende undersøkelser var det fortsatt mange med ekkokardio-grafiske tegn på systolisk og diastolisk dysfunksjon. De fleste som ikke ble behandlet utviklet hjertesvikt. Begge pasientene som presenteres i vår artikkel var relativt gamle da de fikk diagnosen, uten å ha noen kliniske tegn. De ekkokardiografiske funnene viste imidlertid volum overload av hjertet, som hos Kasuistikk 1 fremdeles var til stede selv seks måneder etter operasjon. Grundig auskultasjon av valper ved første valpekontroll vil kunne avdekke bilyd som skiller seg fra uskyldige «valpebilyder». Bilyden som høres hos valper med PDA har en karakteristisk kontinuerlig karakter som kan gi en indikasjon til undersøkende veterinær om behovet for tidlig utredning og behandling.
Sammendrag
Denne artikkelen beskriver PDA hos hund, og beskriver kasuistikker med PDA hos to hunder over et halvt års alder. Persisterende ductus arteriosus er en av de vanligste medfødte hjertelidelsen hos hund (2). Ubehandlet dør opptil 65 % av PDA pasienter innen et år etter at diagnosen er stilt (12). Behandling består av å lukke PDA, og kan gjøres kirurgisk eller transvaskulært. Transvaskulær okklusjon gjøres nå med en Amplatzer Canine Duct Occluder (ACDO), som er en innretning laget av nitinol, med disker som frigis på hver side av PDA.
Den første pasienten (Kasuistikk 1) i denne artikkelen var en åtte måneder gammel pomeranian, hannhund, som ble behandlet med kirurgisk lukking av PDA. Den andre pasienten (Kasuistikk 2) var en to år gammel Welsh springer spaniel, tispe, som ble behandlet med transarteriell lukking med en ACDO.
Begge behandlingene var vellykket, men pasienten med ACDO (Kasuistikk 2) behøvde mindre postoperativ analgesi. Den første pasienten (Kasuistikk 1) hadde fortsatt forstørret venstre hovedkammer etter 6 måneder, men begge pasientene hadde normal størrelse på venstre forkammer 24 timer etter inngrepet.
Summary
This paper describes patent ductus arteriosus in dogs and includes two case reports of dogs diagnosed with PDA. Patent ductus arteriosus is among the most common congenital heart defects in dogs (2). Untreated, about 65 % of dogs will die within a year of diagnosis (12). Surgical or transvascular occlusion are the treatment options. Transvascular occlusion is often performed with an Amplatzer Canine Duct Occluder (ACDO) which consists of nitinol mesh with discs that are deployed on both sides of the PDA ostium.
The first patient was an eight-month-old male Pomeranian which underwent surgical occlusion of the ductus. The second patient was a two-year-old Welsh springer spaniel bitch that had an ACDO placed via the femoral artery.
Both treatments were successful, but the patient with the ACDO needed less post operative analgesia. The first patient had mild persistent left ventricular remodelling six months post operatively. The left atria normalised in size in both patients within 24 hours after surgery.
Etterord
Vi vil gjerne rette en stor takk til våre kolleger ved AniCura Dyresykehus Oslo for hjelp med pre-operativ organisering, anestesi, overvåkning og postoperativ oppfølging. En stor takk rettes også til Kathrine Lund Pettersen for hjelp med fluoroskopi og Mike Martin for opplæring i intervensjonell kardiologi.
Referanser
Tidholm A. Retrospective study of congenital heart defects in 151 dogs. J Small Anim Pract 1997;38:94-8.
Buchanan JW. Patent ductus arteriosus morphology, pathogenesis, types and treatment. J Vet Cardiol 2001;3:7-16.
Buchanan JW, Patterson DF. Etiology of patent ductus arteriosus in dogs. J Vet Intern Med 2003;17:167-71.
Buchanan JW. Morphology of the ductus arteriosus in fetal and neonatal dogs genetically predisposed to patent ductus arteriosus. Birth Defects Orig Artic Ser 1978;14:349-60.
Gittenberger-de Groot AC, Strengers JL, Mentink M, Poelmann RE, Patterson DF. Histologic studies on normal and persistent ductus arteriosus in the dog. J Am Coll Cardiol 1985;6:394-404.
Patterson DF, Pyle RL, Buchanan JW, Trautvetter E, Abt DA. Hereditary patent ductus arteriosus and its sequelae in the dog. Circ Res 1971;29:1-13.
Saunders AB, Gordon SG, Boggess MM, Miller MW. Long‐term outcome in dogs with patent ductus arteriosus: 520 cases (1994–2009). J Vet Intern Med 2014;28:401-10.
Côté E, Ettinger SJ. Long‐term clinical management of right‐to‐left (“reversed”) patent ductus arteriosus in 3 dogs. J Vet Intern Med 2001;15:39-42.
Kittleson MD. Patent ductus arteriosus. I: Kittleson MD, Kienle RD, eds. Small animal cardiovascular medicine. St. Louis, Missouri: Mosby, 1998:218-30.
Nguyenba TP, Tobias AH. Minimally invasive per‐catheter patent ductus arteriosus occlusion in dogs using a prototype duct occluder. J Vet Intern Med 2008;22:129-34.
Broaddus KD, Tillson DM. Patent ductus arteriosus in dogs. Compend Contin Educ Vet 2010;32:E1-14.
Eyster GE, Eyster JT, Cords GB, Johnston J. Patent ductus arteriosus in the dog: characteristics of occurrence and results of surgery in one hundred consecutive cases. J Am Vet Med Assoc 1976;168:435-8.
Van Israël N, French AT, Dukes-McEwan J, Welsh EM. Patent ductus arteriosus in the older dog. J Vet Cardiol 2003;5:13-21.
Oyama MA, Sisson DD. Evaluation of canine congenital heart disease using an echocardiographic algorithm. J Am Anim Hosp Assoc 2001;37:519-35.
Ackerman N, Burk R, Hahn AW, Hayes HM. Patent ductus arteriosus in the dog: a retrospective study of radiographic, epidemiologic, and clinical findings. Am J Vet Res 1978;39:1805-10.
Van Israël N, French AA, Dukes‐McEwan J, Corcoran BM. Review of left‐to‐right shunting patent ductus arteriosus and short term outcome in 98 dogs. J Small Anim Pract 2002;43:395-400.
Bureau S, Monnet E, Orton EC. Evaluation of survival rate and prognostic indicators for surgical treatment of left-to-right patent ductus arteriosus in dogs: 52 cases (1995–2003). J Am Vet Med Assoc 2005;227:1794-9.
Van Overmeire B, Smets K, Lecoutere D, Van de Broek H, Weyler J, De Groote K et al. A comparison of ibuprofen and indomethacin for closure of patent ductus arteriosus. New Engl J Med 2000;343:674-81.
Walters B, Bramer C. Patent ductus arteriosus. North Am Vet 1952;33:252-5.
Singh MK, Kittleson MD, Kass PH, Griffiths LG. Occlusion devices and approaches in canine patent ductus arteriosus: comparison of outcomes. J Vet Intern Med 2012;26:85-92.
Nguyenba TP, Tobias AH. The Amplatz® canine duct occluder: a novel device for patent ductus arteriosus occlusion. J Vet Cardiol 2007;9:109-17.
Wesselowski S, Saunders AB, Gordon SG. Relationship between device size and body weight in dogs with patent ductus arteriosus undergoing Amplatz canine duct occluder deployment. J Vet Intern Med 2017;31:1388-91.
Rishniw M, Erb HN. Evaluation of four 2‐dimensional echocardiographic methods of assessing left atrial size in dogs. J Vet Intern Med 2000;14:429-35.
Rishniw M, Caivano D, Dickson D, Vatne L, Harris J, Matos JN. Two-dimensional echocardiographic left-atrial-to-aortic ratio in healthy adult dogs: a reexamination of reference intervals. J Vet Cardiol 2019;26:29-38.
Cornell CC, Kittleson MD, Torre PD, Häggström J, Lombard CW, Pedersen HD et al. Allometric scaling of M‐mode cardiac measurements in normal adult dogs. J Vet Intern Med 2004;18:311-21.
Visser LC, Scansen BA, Schober KE, Bonagura JD. Echocardiographic assessment of right ventricular systolic function in conscious healthy dogs: repeatability and reference intervals. J Vet Cardiol 2015;17:83-96.
Brown DJ, Knight DH, King RR. Use of pulsed-wave Doppler echocardiography to determine aortic and pulmonary velocity and flow variables in clinically normal dogs. Am J Vet Res 1991;52:543-50.
Kittleson MD, Eyster GE, Knowlen GG, Bari Olivier N, Anderson LK. Myocardial function in small dogs with chronic mitral regurgitation and severe congestive heart failure. J Am Vet Med Assoc 1984;184:455-9.
Schober KE, Hart TM, Stern JA, Li X, Samii VF, Zekas LJ et al. Detection of congestive heart failure in dogs by Doppler echocardiography. J Vet Intern Med 2010;24:1358-68.
Schober KE, Fuentes VL. Effects of age, body weight, and heart rate on transmitral and pulmonary venous flow in clinically normal dogs. Am J Vet Res 2001;62:1447-54.
Visser LC, Ciccozzi MM, Sintov DJ, Sharpe AN. Echocardiographic quantitation of left heart size and function in 122 healthy dogs: a prospective study proposing reference intervals and assessing repeatability. J Vet Intern Med 2019;33:1909-20.
Holler PJ, Wess G. Sphericity index and E‐point‐to‐septal‐separation (EPSS) to diagnose dilated cardiomyopathy in Doberman Pinschers. J Vet Intern Med 2014;28:123-9.
Seldinger SI. Catheter replacement of the needle in percutaneous arteriography. A new technique. Acta Radiol Suppl 2008;434:47-52.
Ranganathan B, LeBlanc NL, Scollan KF, Townsend KL, Agarwal D, Milovancev M. Comparison of major complication and survival rates between surgical ligation and use of a canine ductal occluder device for treatment of dogs with left-to-right shunting patent ductus arteriosus. J Am Vet Med Assoc 2018;253:1046-52.
Hildebrandt N, Stosic A, Henrich E, Wiedemann N, Wurtinger G, Schneider M. Transvenous embolization of moderate to large patent ductus arteriosus in dogs using the Amplatzer vascular plug II. J Vet Intern Med 2022;36:20-8.
Hulsman AH, Breur JMPJ, Szatmári V. Low profile vascular plug for transarterial occlusion of patent ductus arteriosus in small dogs. J Vet Intern Med 2021;35:98-106.
Birchard SJ, Bonagura JD, Fingland RB. Results of ligation of patent ductus arteriosus in dogs: 201 cases (1969-1988). J Am Vet Med Assoc 1990;196:2011-3.
Piantedosi D, Piscitelli A, De Rosa A, Serrano Lopez B, Claretti M, Boz E et al. Evaluation of left ventricular dimension and systolic function by standard transthoracic echocardiography before and 24-hours after percutaneous closure of patent ductus arteriosus in 120 dogs. PLoS ONE 2019;14:e0223676.
De Monte V, Staffieri F, Caivano D, Nannarone S, Birettoni F, Porciello F et al. Heart rate and blood pressure variations after transvascular patent ductus arteriosus occlusion in dogs. Res Vet Sci 2017;113:73-8.
Sarotti D, Rabozzi R, Franci P. Impact evaluation of two different general anesthesia protocols (TIVA with propofol vs isoflurane) on the total number of interventions to treat cardiovascular depression or arousal/movement episodes in dogs undergoing orthopedic surgery receiving an intrathecal anesthesia. J Vet Med Sci 2016;78:1549-55.
Medina‐Serra R, Palacios C, McMillan M. Alternative anaesthetic management in a reintervention for correction of a left‐to‐right shunting patent ductus arteriosus (PDA) in a dog. Vet Rec Case Rep 2021;9(1):e25.
Seibert RL, Maisenbacher HW, Prošek R, Adin DB, Arsenault WG, Estrada AH. Successful closure of left-to-right patent ductus arteriosus in three dogs with concurrent pulmonary hypertension. J Vet Cardiol 2010;12:67-73.