Aktuelle sykdomsutbrudd og diagnoser
Veterinærinstituttet
Pharmaq Analytiq
Aktuelle diagnoser, «nye» sykdommer og spesielle tilfeller har i mange år blitt presentert under vignetten «Aktuelle sykdomsutbrudd og diagnoser fra Veterinærinstituttet, Mattilsynet og NMBU Veterinærhøgskolen». Redaksjonen er av den oppfatning at dette er nyttig og lett tilgjengelig informasjon som bidrar til å opprettholde medlemmenes kunnskap om utviklingen innen diagnostikk og overvåkning av sykdomssituasjonen i Norge. Vi har inntrykk av at denne spalten oppfattes som nyttig og interessant informasjon som gjerne leses av tidsskriftets lesere.
Det er i det alt vesentlige Veterinærinstituttets diagnostiske laboratorier, Mattilsynet og NMBU Veterinærhøgskolen som har bidratt med nytt om sykdom og helse hos produksjonsdyr, fisk, vilt og familiedyr. I tillegg har veterinærer i felten bidratt med selve forutsetningen for at kasuistikkene kan beskrives; innsendelse av materiale, informasjon om besetning/anlegg, anamnese og behandling. I de senere år har det dukket opp flere aktører, særlig innen fiskehelse, som tilbyr diagnostiske tjenester i konkurranse med de offentlige og veletablerte laboratorier. Det er grunn til å anta at private aktører vil ta over en stadig større del av denne diagnostiske virksomheten. Redaksjonen i NVT mener at mange av de funn/diagnoser som gjøres ved disse laboratorier vil være av interesse for NVTs lesere, og vi inviterer private laboratorier til å sende inn meddelelser om interessante kasus på lik linje med det etablerte offentlige laboratorier gjør i dag. Innlegg fra private aktører vil bli gjenstand for samme redaksjonelle behandling som dagens innlegg.
Stikkord er korte og konsise innlegg som er anonymisert, og med stedsangivelse på fylkesnivå. Lengden på innlegget bør normalt ikke overstige 500 ord, og det er ønskelig med illustrasjoner/bilde(r). Både vanlige og spesielle diagnoser/sykdomsutbrudd er ønsket, men diagnosen må ha en viss aktualitet. Sykdomstilfellet/utbruddet kan beskrives kort med hensyn på omfang, klinikk og patologi, grunnlag for diagnosen, forløp, utfall, tiltak samt forvaltningsmessige forhold. Detaljerte beskrivelser av makroskopiske og mikroskopiske funn bør unngås, likeså mikrobiologiske detaljer. Det er aktuelt med henvisninger til eventuelle lignende utbrudd fra litteraturen.
Redaksjonskomiteen
Hjerte- og skjelettmuskelbetennelse (HSMB) hos lakseyngel i settefiskanlegg
Veterinærinstituttet
Veterinærinstituttet
I oktober 2019 mottok Veterinærinstituttet en innsendelse med 13 grams lakseyngel fra et settefiskanlegg i Nord-Norge. Det ble rapportert om vedvarende økt dødelighet etter dyppvaksinering. Andre kliniske funn var gjellelokkforkortelse av varierende grad. Det var observert få svimere, og fisken hadde god appetitt.
Innsendelsen bestod av fem svimere, fem død fisk og fem klinisk friske fra samme kar. Diagnosen HSMB ble stilt på grunnlag av mikroskopiske undersøkelser av vevsprøver. Det var histopatologiske funn forenlig med HSMB hos ett individ fra gruppen med død fisk og ett fra gruppen med klinisk frisk fisk. I tillegg var det histopatologiske funn som gav mistanke om HSMB hos tre individer fra gruppen med død fisk og tre individer fra gruppen med klinisk frisk fisk. Funn i hjertet var blant annet panmyokarditt i sparsom til moderat grad (Figur 1), epikarditt i sparsom til moderat grad og endokarditt i sparsom grad. I rød skjelettmuskulatur ble det observert inflammasjon i sparsom til moderat grad (Figur 2).
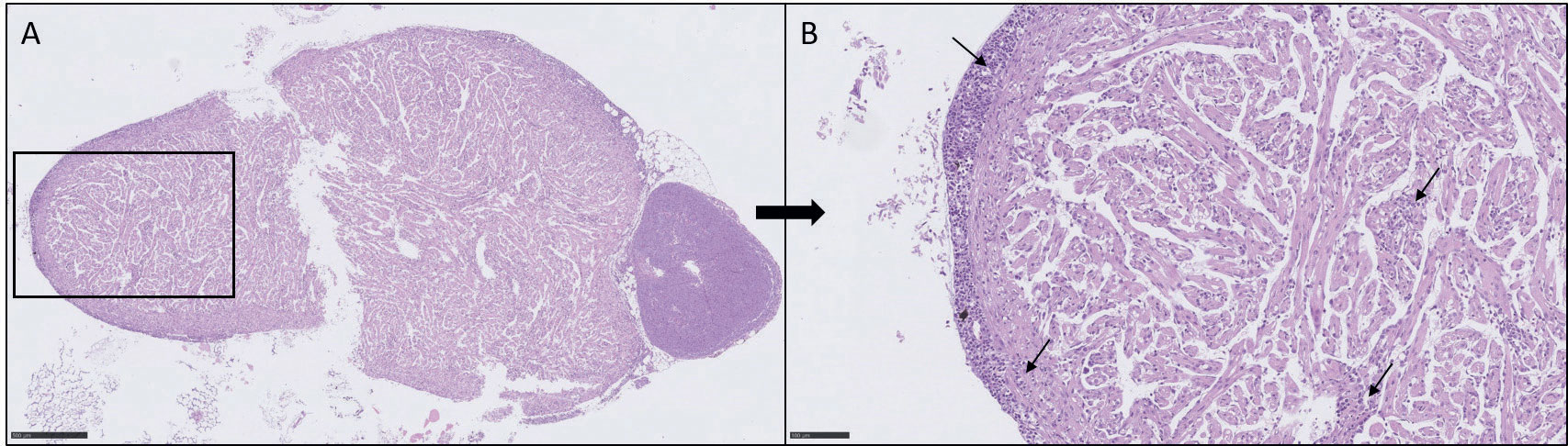
Figur 1. A) Hjertet fra 13 grams lakseyngel med forandringer forenlige med HSMB. B) Panmyokarditt (inflammasjon i alle hjertets lag) i hjertet (svarte piler). Det sees i tillegg degenerasjon av enkelte myocytter. Målestokk viser A) 500 μm B) 100 μm.
Foto: Lisa Furnesvik.
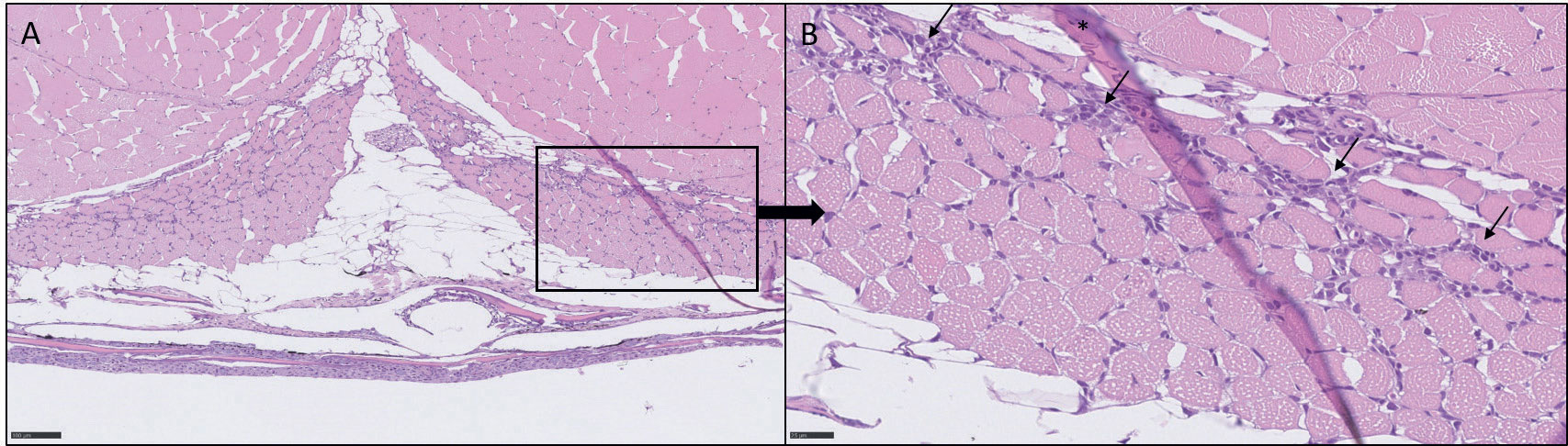
Figur 2. A) Skjelettmuskulatur fra 13 grams lakseyngel med forandringer forenlige med HSMB. B) Inflammasjon i rød skjelettmuskulatur (svarte piler). Svart stjerne viser artefakt (skjell). Målestokk viser A) 500 μm B) 100 μm.
Foto: Lisa Furnesvik.
Andre funn var sparsomme sirkulasjonsforstyrrelser i milt, hypervakuolisering av hepatocytter og stuvning i leversinusoidene i sparsom grad, sparsom vakuolisering av eksokrint pankreasvev, sparsom peritonitt og påkjente gjeller i sparsom til moderat grad med funn av bakterier mellom lamellene hos fire individer. Funn av bakterier på gjellene kan tyde på at vannkvaliteten ikke var optimal.
Det er viruset Piscine orthoreovirus (PRV) som er satt i sammenheng med HSMB-syk laks. PRV infiserer de røde blodcellene i fisken og kan smitte ved vannkontakt mellom syk og klinisk frisk fisk. Viruset er svært utbredt og finnes både hos frisk villaks, oppdrettslaks, sjøørret og regnbueørret. Betennelse og celledød i hjertet kan oppstå på et tidlig tidspunkt i sykdomsutviklingen og kan vedvare i flere måneder etter klinisk sykdom. Under sykdomsutbruddet har fisken også betennelse i skjelettmuskulaturen (1).
Hovedtyngden av fisk som får HSMB-diagnose, utvikler sykdommen det første året i sjøvannsfasen, men det har vært et økende antall rapporterte tilfeller i settefiskanlegg de siste årene. Siden 2007 har det vært en økende trend med tilfeller av HSMB i Nord-Norge (2).
Det finnes foreløpig ingen vaksine på markedet, men det har blitt gjennomført to eksperimentelle vaksineforsøk som rapporterer om moderat beskyttelse mot HSMB. Det finnes heller ingen kurerende behandling mot HSMB, men det er rapportert om spesialfôr med noe betennelsesdempende effekt på sykdomsutviklingen. Å unngå håndtering som vil stresse fisken, er et av de viktigste tiltakene for å redusere dødeligheten når fisken er svekket på grunn av HSMB (2).
Referanser:
Kibenge FS, Godoy MG. Reoviruses of aquatic organisms. I: Kibenge FS, Godoy MG, eds. Aquaculture virology. London: Academic Press, 2016: 220-9.
Dahle MK, Olsen AB. Hjerte- og skjelettmuskelbetennelse (HSMB) i atlantisk laks og HSMB-liknende sykdom i regnbueørret. I: Hjeltnes B, Bang Jensen B, Bornø G, Haukaas A, Walde CS, red. Fiskehelserapporten 2018. Oslo: Veterinærinstituttet, 2019: 48-51.
Obstipasjon og gastrisk dilatasjon («stuffing») hos lakseyngel (Salmo salar)
Veterinærinstituttet
Veterinærinstituttet
Veterinærinstituttet
Veterinærinstituttet
Veterinærinstituttet mottok høsten 2019 innsendelser av hel lakseyngel fra to settefiskanlegg (A og B) hvor det var registrert forøket dødelighet etter overføring til startfôring. Begge anleggene var ferskvann gjennomstrømmingsanlegg. Fisken var uvaksinert og hadde kroppsvekt på rundt 0,3 gram (anlegg A), og fra 2 til 12 gram (anlegg B).
På anlegg A var det observert kraftig økning i dødelighet hos yngel i tre kar, omtrent en uke etter overføring. Det hadde vært kraftig regnvær fire dager i forkant som førte til grumsete og uklart vann. Vanntemperatur var 13,8 grader. Ved inspeksjon av svimere var det lite å se. Enkelte fisk hadde soppinfeksjon på brystfinner, noen blødning rundt gattet og et par individer tegn til begynnende hudsår. Nær samtlige hadde mye fôr i mage-tarm-kanalen (Figur 1). Det ble sendt inn ti svimere fiksert på formalin samt bakterieutstryk fra fire. Ved anlegg B var det også registrert økning i dødelighet etter innflytting på startfôringsavdeling. Yngelen hadde blitt stående lengre på klekkeavdeling enn planlagt på grunn av tidligere klekking enn forventet og plassproblemer. Det ble sendt inn 34 yngel (svimere, død og klinisk frisk fisk) på formalin fra to kargrupper.

Figur 1. Lakseyngel med dilatert buk.
Foto: Privat.
Ved histologisk undersøkelse ble det observert gjelleforandringer hos individer fra begge anlegg. Yngel fra anlegg A hadde sparsomme til moderate forandringer og sparsomt til rikelig debris under gjellelokk og mellom filamentene. Fra anlegg B ble det registrert sparsomme, moderate og uttalte gjelleforandringer. Fire yngel hadde filamentøse bakterier i gjellene og én sopphyfer. Hos enkelte ble det observert sparsomme eller moderate forandringer i andre organer.
Ved bakteriologisk dyrking av innsendt materiale fra anlegg A ble det påvist blandingsflora. Immunohistokjemisk analyse for Flavobacterium psychrophilum hos individer fra anlegg B var negative.
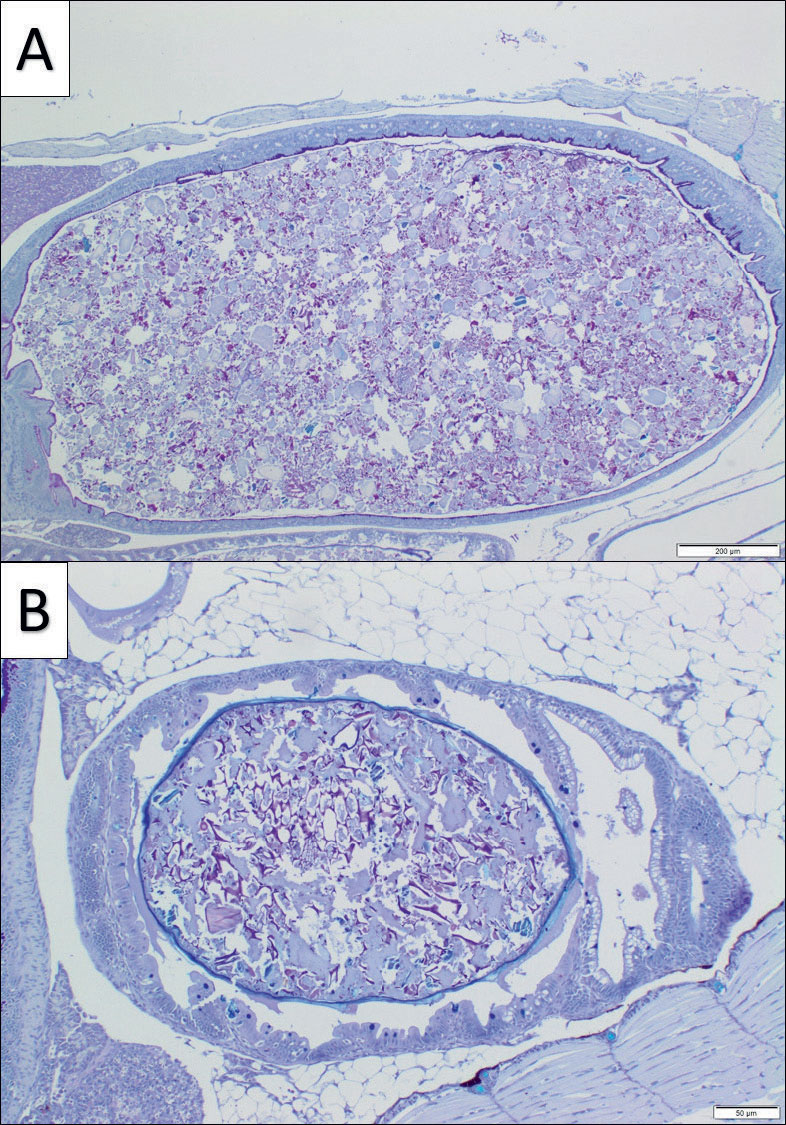
Figur 2. Magesekk (A) og baktarm (B) hos yngel fra anlegg A farget med AB/PAS. Lumen er velfylt, og det sees rikelig med fôr dekket av et lag med mucus. Veggen på organene fremstår som tynnvegget og kraftig dilatert med reduserte eller manglende deler av slimhinnen. Målestokk: 200 µm (A) og 50 µm (B).
Foto: Toni Erkinharju.
Prøver fra yngel med mage-tarm forandringer ble farget med spesialfarging for slimceller, kombinert Alcian blue/PAS. Samtlige individer fra anlegg A hadde svært utspilt magesekk og tarmpartier. Særlig magesekken og baktarm var kraftig dilatert og fylt med fôrpartikler, ofte tildekket av et lag med slim. Veggen fremstod flere steder tynnvegget med redusert eller fraværende slimhinne (Figur 2). Lignende funn ble observert hos seks yngel fra anlegg B, tre død fisk og tre klinisk friske (Figur 3). Det ble konkludert at dette var obstipasjon og forenlig med «stuffing», et innarbeidet begrep for sykelig opphopning av store mengder fôr i mage-tarm-kanalen hos yngel. Fisk affisert av denne tilstanden blir ofte liggende på rista og kan dø i store antall.
Det er beskrevet få tilstander som leder til uttalt gastrisk dilatasjon hos oppdrettet laksefisk, og det meste er observert hos stor fisk. Spesielt kan nevnes «gastric dilatation and air sacculitis» (GDAS) hos kongelaks (Oncorhynchus tshawytscha) på New Zealand. Lignende tilstander har vært observert hos andre arter laksefisk flere steder i verden. Syk fisk utvikler dilatert, tynnvegget magesekk eller væskefylt, betent svømmeblære, eller en kombinasjon av begge. Fremre deler av tarmpartiet kan også være dilatert. De patofysiologiske mekanismene bak GDAS er ikke fullstendig kjent, men det er vist at syndromet kan oppstå ved å benytte visse typer fôr (1, 2).
I vårt beskrevne tilfelle er det ikke kjent hva bakenforliggende årsak(er) kan være. Trolig kan den forøkte dødeligheten være relatert til faktorer som drift av anlegget, vannkvalitet, stress og/eller gjellehelse.
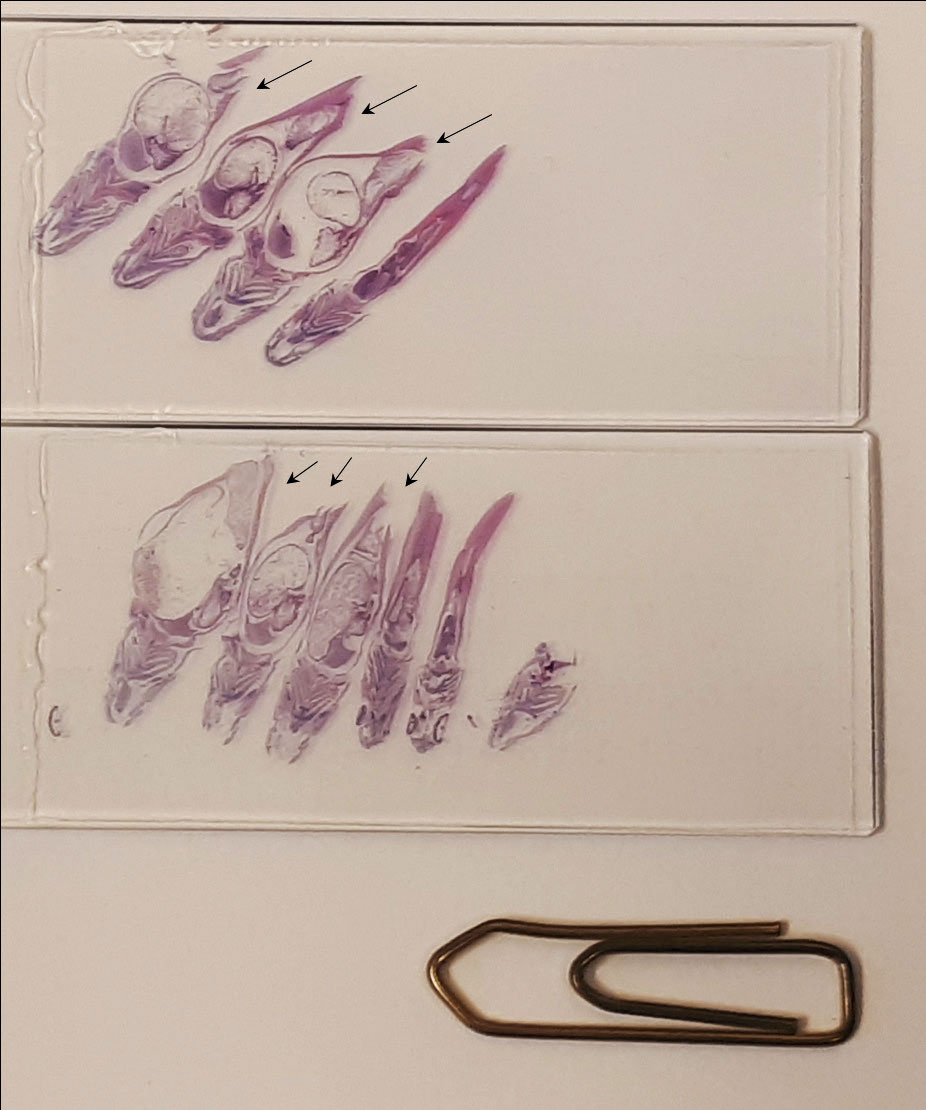
Figur 3. Histologiske preparater med horisontalkuttede snitt av hel yngel fra anlegg B. Buken hos enkelte (piler) fremstår som kraftig forstørret med dilatert mage-tarm-kanal. Binders inkludert for referansestørrelse.
Foto: Toni Erkinharju.
Referanser:
Lumsden JS. Gastrointestinal tract, swimbladder, pancreas and peritoneum. I: Ferguson HW, ed. Systemic pathology of fish: a text and atlas of normal tissues in teleosts and their responses in disease. 2nd ed. London: Scotian Press, 2006: 168-99.
Lumsden JS, Wybourne B, Minamikawa M, Tubbs L. Gastric dilation and air sacculitis in Chinook salmon, Oncorhynchus tshawytscha (Walbaum): correlation of macroscopic and microscopic lesions, and relationship of the syndrome to glomerulonephritis and serum biochemistry. J Fish Dis 2010; 33: 737-47.
Koksidieinfeksjon påvist i leppefisk
Fish Vet Group / Benchmark Norway AS
Fish Vet Group / Benchmark Norway AS
Fish Vet Group / Benchmark Norway AS
Åkerblå
FoMAS - Fiskehelse og Miljø as.
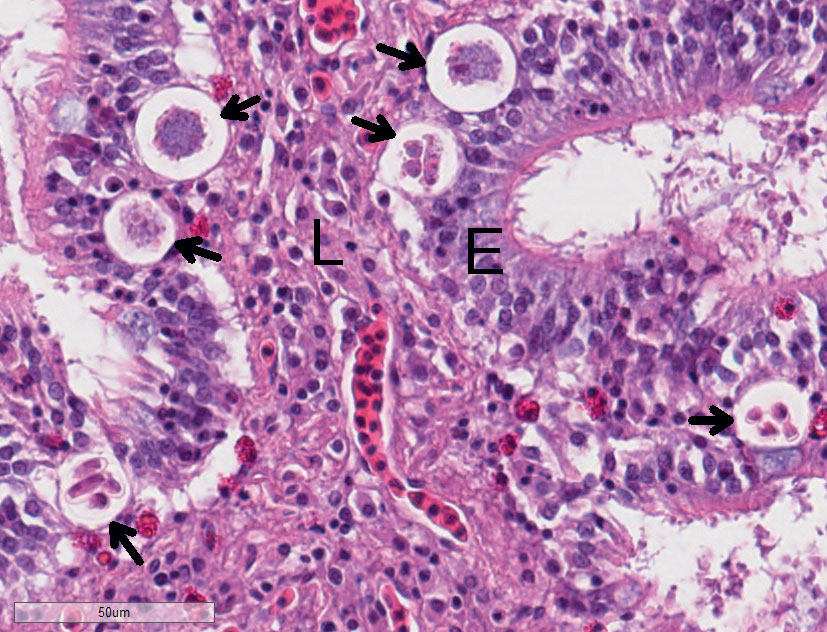
Figur 1. Histologisk snitt av tarmslimhinne som viser koksidier (piler) i ulike stadier multifokalt i tarmepitelet (E). Lamina propria (L).
Foto: Caroline Piercey Åkesson.
I oktober 2019 mottok Fish Vet Group/Benchmark Norway AS prøver til bakteriologisk og histologisk undersøkelse fra fem selvdøde leppefisk, både grønngylt (Symphodus melops) og berggylt (Labrus bergylta), fra en sjølokalitet i Sør-Trøndelag. Det var observert høy dødelighet i forbindelse med utfisking av rensefisk i forkant av avlusing, og det ble mistenkt bakterieinfeksjon. Alle fem fisk ble diagnostisert med sepsis og atypisk Aeromonas salmonicida-infeksjon (atypisk furunkulose) som ble tolket som hovedårsaken til den økte dødeligheten. Utover dette ble det i flere av de innsendte fiskene påvist ulike parasitter i både gjeller (mest forenlig med Trichodina sp. og amøber) og tarm (mest forenlig med trematoder/ikter). Vedundersøkelseav tarmen fra en grønngyltble det påvist moderate mengder koksidier i ulike stadier multifokalt i tarmepitelet, forenlig med Eimeria sp. infeksjon (Figur 1). Koksidiene ble påvist intraepitelialt, og bortsett fra en mild infiltrasjon av eosinofile granulære celler/mastceller i epitelet ble det ikke observert vevsskade eller betennelsesreaksjon i assosiasjon med parasittene (Figur 2). I tillegg til denne saken ble det samme uke mottatt prøver fra en berggylt fra en sjølokalitet i Rogaland med bakteriell dermatitt som hovedfunn. I denne fisken ble det også påvist koksidieinfeksjon i tarm. Etter vår erfaring er koksidieinfeksjon ikke noe vi observerer til vanlig hos leppefisk i Norge.
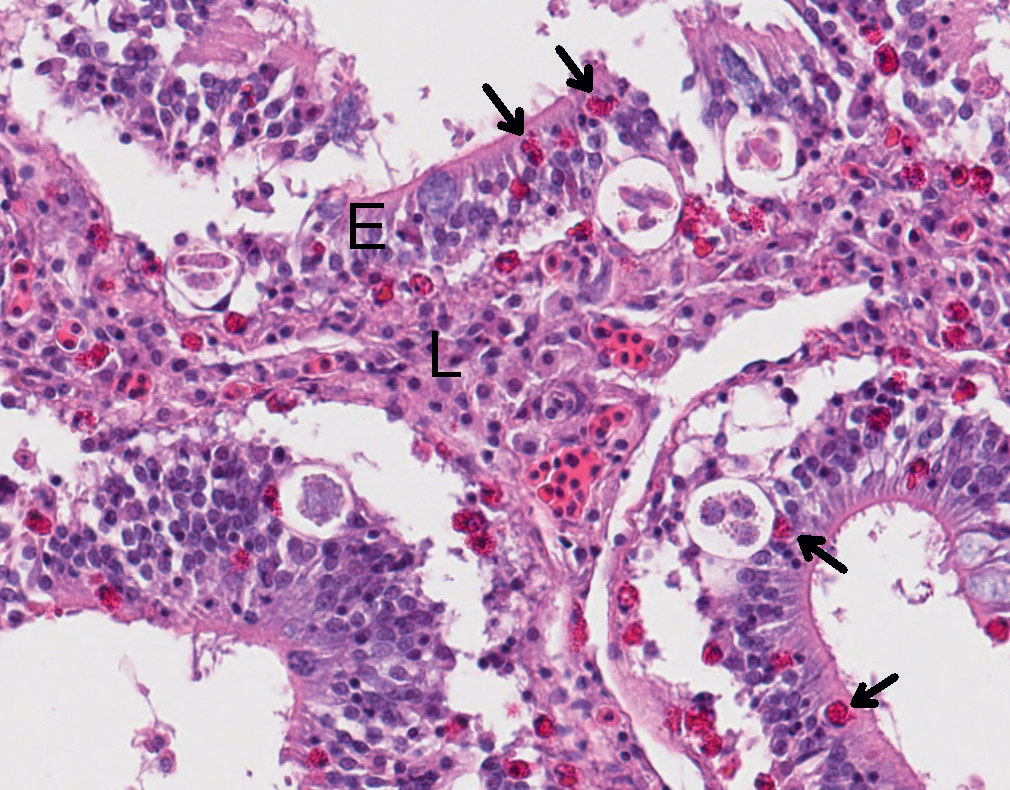
Figur 2. Histologisk snitt av tarmslimhinne med mild infiltrasjon av eosinofile granulære celler/mastceller (piler) i epitelet i assosiasjon med koksidier. Epitel (E), Lamina Propria (L).
Foto: Caroline Piercey Åkesson.
Etterspørselen etter ulike arter av rensefisk er stor. Ettersom produksjonssyklusen til leppefisk er veldig lang, så møtes etterspørselen etter leppefisk i stor grad av villfanget fisk (1, 2). I 2017 var antallet villfanget leppefisk som ble satt ut i merdene, 22,9 millioner (3). Kunnskapen om rensefiskens helsestatus i det fri er begrenset. Det er påvist et bredt spekter av ulike parasitter i rensefisk, og det er relativt vanlig forekommende at villfanget leppefisk er infisert med ulike parasitter (2, 4). De viktigste parasittene som er kjent å forårsake sykdom hos leppefisk, eller som potensielt kan smitte over til laks eller annen fisk i Norge, er Paramoeba perurans, Trichodina sp., Caligus sp. (lus) og flere arter av nematoder (4, 5). Nylig ble det publisert en helsestudie utført på 75 klinisk friske villfangede berggylt fanget utenfor sør-vest kysten av Storbritannia (4). Det ble påvist flere ulike typer parasitter, hvorav den vanligst forekommende var Eimeria sp. som ble påvist i tarmen i 26,6 % av de undersøkte fiskene. I tillegg beskrev Molnar et al (6) at Eimeria sp. er en vanlig parasitt å finne i mange fiskearter. Hvorvidt dette gjelder for fisk langs norskekysten er ikke beskrevet. Av leppefiskmateriale som Fish Vet Group har fått innsendt til undersøkelse, er det til nå ikke påvist koksidier i et stort omfang. McMurtrie et al (4) beskrev videre at det ikke ble påvist betennelsesforandringer i tarmslimhinnen i forbindelse med koksidiene. Dette stemmer overens med det som ble påvist i leppefiskene vi mottok til undersøkelse. Det er uvisst i hvilken grad Eimeria sp-infeksjon påvirker leppefisk, eller rensefisk generelt, i det fri, eller i fangenskap og under stress. Om det er en fare for å smitte laks eller annen oppdrettsfisk er ikke kjent, men anses som lite sannsynlig ettersom Eimeria sp. viser høy vertsspesifisitet (6).
Referanser:
Hjeltnes B, Bang Jensen B, Bornø G, Haukaas A, Walde CS, red. Fiskehelserapporten 2018. Oslo: Veterinærinstituttet, 2019.
Brooker AJ, Papadopoulou A, Gutierrez C, Rey S, Davie A, Migaud H. Sustainable production and use of cleaner fish for the biological control of sea lice: recent advances and current challenges. Vet Rec 2018; 183: 383.
Mo TA, Poppe TT. Hvorfor er det ingen som bryr seg om dyrevelferd hos rensefisk? Nor Vet Tidsskr 2019; 131: 235-6.
McMurtrie J, Verner-Jeffreys DW, Cochrane-Dyet T, White P, van Aerle R, Ryder D et al. Health assessment of the cleaner fish ballan wrasse Labrus bergylta from the British south-west coast. Dis Aquat Org 2019; 136: 133-46.
Johansen LH, Colquhoun DJ, Hansen Hildre S, Wergeland HI, Mikalsen HE. Analyse av sykdomsrelatert risiko forbundet med bruk av villfanget og oppdrettet rensefisk for kontroll av lakselus. Tromsø: Nofima, 2016. (Rapport 9/16, 2016).
Molnár K, Ostoros G, Dunams-Morel D, Rosenthal BM. Eimeria that infect fish are diverse and are related to, but distinct from, those that infect terrestrial vertebrates. Infect Genet Evol 2012; 12: 1810-5.
Sannsynlig overføring av Leishmaniasmitte mellom hunder i Norge
Veterinærinstituttet
AniCura Dyreklinkk Drammen
Mattilsynet
Veterinærinstituttet,
NMBU-Veterinærhøgskolen
I 2019 ble det påvist et tilfelle av leish-maniose hos hund uten reisehistorikk i Norge. Det er ikke tidligere dokumentert smitteoverføring med denne parasitten i Norge.
I august påviste en privatpraktiserende veterinær symptomer forenlig med leishmaniose hos en syv år gammel blandingshund født i 2012, i Buskerud. Diagnosen ble bekreftet på grunnlag av et høyt nivå av leishmaniaspesifikke antistoffer påvist ved ELISA (IDEXX). Hunden ble satt på behandling (Allupurinol) for å kontrollere infeksjonen. Den hadde aldri vært i utlandet, men var født av en tispe som hadde hatt opphold i Italia og Ungarn før parring og drektighet. I tillegg hadde den bodd sammen med en hund importert fra Spania som tidligere er diagnostisert med og satt under behandling for leishmaniose.
Behandlende veterinær meldte tilfellet (B-sykdom) til Mattilsynet. Veterinærinstituttet ble konsultert for å gi råd om diagnostikk og vurdere mulige kilder til smitte for den syke hunden.
To alternative smitteruter ble vurdert som sannsynlige:
Smitteoverføring fra Leishmania-positiv hund i husholdningen.
Transplacental smitte.
For å undersøke alternativ 1, ble NMBU-Veterinærhøgskolen forespurt om å bistå med utvidet prøvetakning av hundene. Hensikten var å genotype parasitten fra de to hundene og eventuelt også fra tispen (mor til den aktuelle hunden) for å forsøke å finne ut hvilken hund som var opphavet til smitte. Begge hundene i den aktuelle husholdningen ble undersøkt, men tispen hadde flyttet til utlandet og var ikke tilgjengelig. Nye blodprøver ble tatt av begge hundene, men eieren samtykket ikke til anestesi for uttak av beinmargsprøve. Blodprøvene ble undersøkt ved PCR ved IDEXX og serologisk (ELISA) ved Veterinærinstituttet. PCR var negativ for begge hundene, mens antistoffer mot Leishmania ble påvist hos begge. Da genotyping er avhengig av en PCR-positiv test (tilgjengelig parasitt-DNA), kunne ikke dette utføres.
For å undersøke alternativ 2, var det ønskelig å teste tispen (mor til den aktuelle hunden) for Leishmania. Den var flyttet ut av landet, men på forespørsel fra Mattilsynet var eieren villig til å få den testet hos lokal veterinær. Vedkommende informerte senere Mattilsynet om at Leishmania ikke ble påvist. Journalutskrift med beskrivelse av utført «snap-test» (IDEXX) for påvisning av Leishmania-spesifikke antistoffer, med negativt resultat, ble sendt til Mattilsynet.
Canine Leishmaniasis er en alvorlig sykdom hos hund som forårsakes av protozoer av genus Leishmania. Flere leishmaniaarter kan gi sykdom, men Leishmania infantum er den viktigste hos hund. Parasitten er zoonotisk og kan gi alvorlig sykdom hos menneske. I land hvor L. infantum er endemisk, er hunder det viktigste smittereservoaret, men overføring fra smittede til ikke-smittede individer skjer hovedsakelig med sandmygg (Phlebotominae og Lutzomya).
Leishmaniainfantum er ansett som en importsykdom i Norden, og er det «eksotiske» smittestoffet som oftest diagnostiseres på importerte hunder i Norge (https://www.vetinst.no/overvaking/smittsomme-sykdommer-i-hunder-importert-til-norge). Det er ikke tidligere dokumentert smitteoverføring i Norge. I tilfellet som er beskrevet her, anses det som sannsynlig at hunden er smittet ved at den har hatt tett kontakt med en annen smittet hund i Norge. Tilsvarende smitteoverføring mellom hunder i samme husholdning er beskrevet for to hunder i Finland (1) og en hund i Tyskland (2). Nøyaktig hvordan smitteoverføringen har skjedd er usikkert, men bittskader og kontakt med kroppssekret ved slikking og liknende er en mulighet.
Transplacental smitte med Leishmania fra mor til avkom og mellom hunder ved parring (3, 4) er også beskrevet. Parasitten kan skilles ut i sæd (5), og i USA har det vist seg at vertikal smitte mest sannsynlig har bidratt til å vedlikeholde og spre Leishmania-smitte i enkelte hundepopulasjoner (6). Mor til den aktuelle hunden hadde oppholdt seg i Leishmania-endemiske områder før parring og drektighet, så det var en mulighet for at hunden var smittet transplacentalt. På bakgrunn av negativ snap-test fra tispen vurderes dette som mindre sannsynlig. Ideelt sett burde hunden vært undersøkt ved en serologisk metode med noe høyere sensitivitet.
Gjennomsnittstemperaturen i Norge anses å være for lav for at sandmygg skal etablere seg her. Tilfellet er en påminnelse om at hunder med Leishmania-smitte likevel kan spre smitten ved tett kontakt med andre hunder, ved parring og til avkom og ved blodoverføring. Mattilsynet har allerede tatt høyde for dette ved forbud mot eierskifte og avl samt pålegg om at smittede hunder ikke skal brukes som blodgivere.
Det vurderes som lite sannsynlig at en hund smittet med Leishmania vil kunne spre smitten i stort omfang til andre hunder i Norge, men enkelttilfeller er mulig enten ved tett og direkte kontakt, ved parring eller ved at smitte overføres transplacentalt til valper. Sannsynligheten for smitteoverføring vil antakeligvis reduseres når hunden står under behandling fordi konsentrasjonen av parasitten i blod og kroppsvæsker reduseres. Ytterligere beskrivelse av tilfellet beskrevet her, og andre leishmaniatilfeller i Norge, vil følge i en planlagt oversiktsartikkel i Norsk veterinærtidsskrift.
Referanser
Karkamo V, Kaistinen A, Näreaho A, Dillard K, Vainio-Siukola K, Vidgrén G et al. The first report of autochthonous non-vector-borne transmission of canine leishmaniosis in the Nordic countries. Acta Vet Scand 2014; 56: 84.
Naucke TJ, Amelung S, Lorentz S. First report of transmission of canine leishmaniosis through bite wounds from a naturally infected dog in Germany. Parasit Vectors 2016; 9: 256.
Rosypal AC, Troy GC, Zajac AM, Frank G, Lindsay DS. Transplacental transmission of a North American isolate of Leishmania infantum in an experimentally infected beagle. J Parasitol 2005; 91: 970-2.
Naucke TJ, Lorentz S. First report of venereal and vertical transmission of canine leishmaniosis from naturally infected dogs in Germany. Parasit Vectors 2012; 5: 67.
Silva FL, Oliveira RG, Silva TM, Xavier MN, Nascimento EF, Santos RL. Venereal transmission of canine visceral leishmaniasis. Vet Parasitol 2009; 160: 55-9.
Petersen CA. Leishmaniasis, an emerging disease found in companion animals in the United States. Top Companion Anim Med 2009; 24: 182-8.
Lungebrann (smittsom lungebetennelse) hos mink forårsaket av Pseudomonas aeruginosa
Veterinærinstituttet
Veterinærinstituttet
Vetlab, Bryne
Veterinærinstituttet i Oslo mottok i begynnelsen av oktober 2019 tre minker i 5-6 måneders alder fra en gård i Rogaland til obduksjon.
Eier hadde mistet 2800 dyr (38,8 %) av totalt 7220 mink med to dødelighetstopper, en i mai-juni og en i september-oktober. Økningen av døde valper i mai-juni ble etter obduksjoner på gården knyttet til akutt mage-tarminfeksjon. Etter behandling med amoxicillin per os sank dødeligheten til 0-2 valper per dag.
I midten av august økte dødeligheten på valper til 30-40 med topp på 140-150 valper daglig. Sykdomsforløpet var akutt (1-3 timer) med blod og blodtilblandet skum fra nese som eneste symptom. Ved feltobduksjon var lungene mørke og blodfylte, og det var mye væske i bryst- og bukhule.
De obduserte valpene, to tisper (nr. 1 og 2) og en hann (nr. 3), var i svært godt hold og veide mellom 1,90 kg og 3,95 kg. Øye- og munn-slimhinner var blekrosa. Alle hadde blodtilblandet væske i pelsen rundt snuten. Lungene var mørke, blodige og gummiaktige, og vevet sank i vann (Figur 1). Alle minkene hadde svullen milt og blodtilblandet innhold i magesekken, og det var også blodtilblandet innhold i duodenum hos mink nr. 2 og 3.
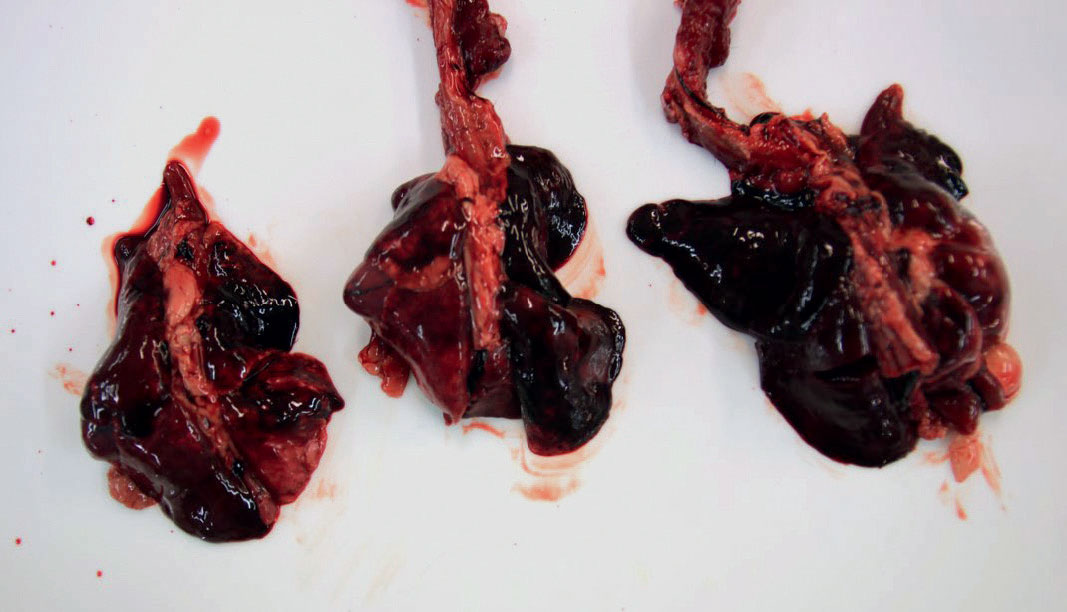
Fig. 1. Mørke og blodige lunger fra tre minker med lungebrann.
Foto: Øyvor Kolbjørnsen.
Ved histologisk undersøkelse av lungene fantes områder med blødninger, hyperemi, ødem og nekroser. Det var store mengder bakterier og varierende mengde nøytrofile granulocytter i vevet (Figur 2).
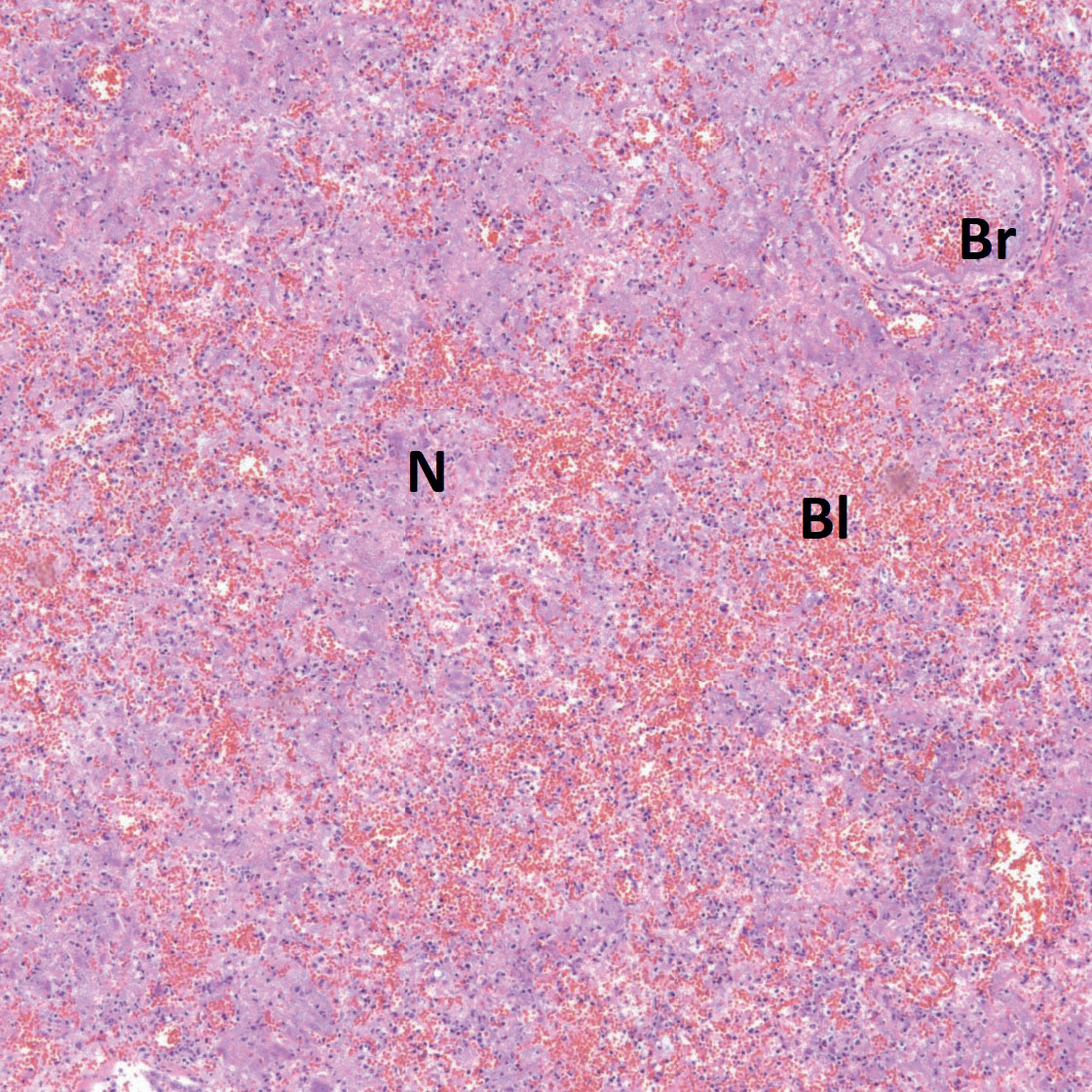
Figur 2. Histologisk preparat fra minklunge med lungebrann (hemoragisk nekrotiserende pneumoni) viser blødninger (Bl) og nekroser (N) av alveolesepta med myriader av bakterier (Pseudomonas aeruginosa – sees som blålig farge) og en bronkiole fylt med bakterier, blod og debris (Br). HE x 4.
Foto: Øyvor Kolbjørnsen.
Ved bakteriologisk undersøkelse av milt, lunge og mageinnhold vokste det rikelig med Pseudomonas aeruginosa fra alle dyr. I tillegg vokste det rikelig med Clostridium perfringens fra mageinnhold fra mink nr. 1 og rikelig med Streptococcus dysgalactiae equisimilis fra mageinnhold fra mink nr. 2 og 3.
P. aeruginosa er en vanlig miljøbakterie som særlig har evne til å bryte ned proteiner. I råtnende kjøtt og fisk vil den nesten alltid være til stede. Proteinholdige eksudater og puss er god næring for P. aeruginosa. Store, åpne sår som for eksempel brannsår kan lett infiseres. I friske småsår er den sjelden førsteårsak til infeksjoner, men som siste ledd i en økologisk suksesjon av infiserende bakterier vil den kunne dominere bakteriefloraen ved kroniske infeksjoner. Noe av suksessen kan forklares med en iboende resistens mot en rekke antibiotika og desinfeksjonsmidler som gjør P. aeruginosa i stand til å overleve terapi. Er den ikke resistent mot et bestemt virkestoff, erverver den gjerne resistens i løpet av kort tid. Bakterien er alltid resistent mot ampicillin, amoxicillin, tetrasykliner og kombinasjonen av sulfonamider og trimetoprim.
P. aeruginosa kan forbigående finnes på slimhinner hos friske mennesker og dyr. Ser man bort fra de beskrevne sårinfeksjonene, synes predisponerende faktorer å være nødvendig for å utløse infeksjon med P. aeruginosa eller lungebrann hos mink. Infeksjonen fører til store tap og høy dødelighet. Sykdommen opptrer hyppigst i høstmånedene september og oktober, særlig under fuktige klimaforhold. Smitten kan komme fra vann og fôr med nedsatt hygienisk kvalitet. Dårlig miljø vil favorisere overlevelse av smittestoffet, og stor dyretetthet vil øke smittepresset. Maternale antistoff hos valpene på dette tidspunktet er redusert. Skiftende vær og røyteperiode vil også kunne medvirke til nedsatt motstandsdyktighet mot infeksjon.
Når infeksjonen har etablert seg, spres den raskt mellom dyr med aerosoler og med hår og støv. Forløpet er akutt. Dyr som var friske dagen før kan bli funnet døde morgenen etter. Synlig syke dyr har blodtilblandet fråde fra nesen. Det er bakteriens eksotoksiner og hemolysin som forårsaker skadene. Toksinskadene, det raske og dramatiske forløpet og bakteriens resistensegenskaper gjør medikamentell behandling lite effektiv. Ukritisk bruk av antibiotika mot andre bakterieinfeksjoner kan føre til utrydding av konkurrerende bakterier og favorisering av P. aeruginosa.
Når sykdommen har brutt ut, er det viktig å finne smittekilden.
For å hindre spredning på gården anbefales streng isolasjon av syke dyr. Det bør gjennomføres desinfeksjon og eventuell kalkning av grunnen.
På denne gården har det i tidligere år vært noe økt hoste og lungebetennelse på høsten som ebbet ut av seg selv etter få uker. I startfasen antok en at det var situasjonen også denne gangen selv om utbruddet startet tidligere enn vanlig. I begynnelsen av september ble det forsøksvis behandlet med doksysyklin, som da var eneste tilgjengelige preparatet i Norge vi kunne bruke, uten at det hadde effekt. All mink ble vaksinert mot P. aeruginosa (Biocom-P) i slutten av september og behandlet med trimetoprim-sulfadiazin per os i begynnelsen av oktober. I midten av oktober gikk dødeligheten raskt ned til 2-15 dyr per dag. Gården mistet totalt 4100 (56,7 %) av til sammen 7220 dyr.
Det ble ikke funnet noen direkte smittekilde, men det er nærliggende å tro at de problemene en hadde i mai har svekket valpene. Det kan samtidig ha bygget seg opp et smittepress i miljøet som utløste et alvorlig utbrudd av lungebrann da høsten kom.
Det finnes en vaksine mot lungebrann, Biocom-P, men denne er ikke blitt brukt i besetningen tidligere siden de har færre enn 1500 avlstisper. Årsaken til den høye dødeligheten kan også skyldes at det var svært vanskelig å få tak i egnet antibiotika og vaksine på grunn av flere ukers leveringstid.
I løpet av 17 år (2002-2019) har Veterinærinstituttet påvist hemoragisk bronkopneumoni med vekst av P. aeruginosa hos obduserte mink i 37 saker. Tre av sakene var fra Telemark, en fra Østfold og de øvrige fra Rogaland.
Forebyggende tiltak er god hygiene, rent drikkevann, vaksinasjon og unngå høy dyretetthet og kannibalisme i burene.
Infeksjonen pleier ebbe ut av seg selv når det blir kjølig.