Portosystemisk shunt hos hund – litteraturstudie og to kasuistikker
Portosystemisk shunt (PSS) betegner en abnormal kobling mellom portal sirkulasjon og systemisk sirkulasjon slik at abdominalt venøst blod «shuntes» forbi leveren. PSS forekommer hos hunder og katter. Denne artikkelen beskriver PSS hos hund og ulike behandlingsalternativer for ulike typer av PSS. Perkutan transvenøs coil-embolisering (PTCE) beskrives brukt på ett kasus med kongenital intrahepatisk portosystemisk shunt (cIHPSS) og total ligering beskrives brukt på ett kasus med kongenital ekstrahepatisk portosystemisk shunt (cEHPSS).
Veterinær. Spesialist i smådyrsykdommer, hund og katt
Fredrikstad Dyrehospital
Forfatter har fylt ut ICMJE-skjemaet og oppgir ingen interessekonflikter
morten@f-d.no
Veterinær. Spesialist i smådyrsykdommer, hund og katt
Fredrikstad Dyrehospital
Forfatter har fylt ut ICMJE-skjemaet og oppgir ingen interessekonflikter.
Innledning
Klassifisering, patofysiologi og forekomst
Portosystemisk shunt (PSS) kan være kongenital eller ervervet. Kongenital PSS (cPSS) kan enten være ekstrahepatisk (cEHPSS) eller intrahepatisk (cIHPSS) og er angitt å forekomme hos 0,18 % av hundepopulasjonen (1). PSS transporterer portalt blod forbi leveren til den systemiske sirkulasjonen. Manglende tilførsel av portalt blod fratar leveren viktige næringsstoffer som hemmer normal leverutvikling, og hunder med PSS utvikler ofte ikke normal leverfunksjon (2). I tillegg til at leveren ikke utvikles normalt vil passasjen av portalt blod utenom leveren bety at skadelige substanser som for eksempel ammoniakk og bakterielle toksiner ikke blir nøytralisert i leveren og kommer ut i det systemiske kretsløpet (3, 4). Som en hovedregel forekommer cEHPSS primært hos små hunderaser. Yorkshire terrier, mops og malteser angis å være overrepresentert (1, 5, 6). cIHPSS utgjør rundt 30 % av tilfellene og er vanligere hos de store hunderasene (6, 7). Labrador retriever og irsk ulvehund angis å være overrepresentert og for irsk ulvehund er det en kjent arvbarhet for venstresidig cIHPSS (8).
Symptomer
Hunder med cPSS presenterer ofte symptomer før to års alder (9, 10). Symptomene kan være upåfallende og uspesifikke (7, 11), men relateres ofte til tre organsystemer: urinveiene, gastrointestinaltraktus og sentralnervesystemet. Symptomer fra sentralnervesystemet er vanligst (9). Stranguri kan forekomme sekundært til dannelse av ammoniumurat urinstein (10, 12). Den vanligste og mest fremtredende kliniske presentasjonen er symptomer på hepatisk encefalopati (9). Patogenesen for hepatisk encefalopati er kompleks og ikke fullt forstått. Ved PSS transporteres toksiner og substanser fra portalt blod utenom leveren til den systemiske sirkulasjonen og påvirker sentralnervesystemet (13, 14). Det er kun 30-50 % av hunder med PSS som viser en klar forverring av symptomer på hepatisk encefalopati postprandialt slik at fravær av dette utelukker ikke PSS (3). Symptomer forårsaket av hepatisk encefalopati er typisk nevrologiske, som tretthet, sløvhet, hodepressing, hvileløs vandring og ataksi (9). I noen tilfeller forekommer det tonisk-kloniske anfall (10).
Diagnostikk
Hematologisk analyse kan vise en mild non-regenerativ, mikrocytær, hypokrom eller normokrom anemi (11, 15). Konsentrasjonene av albumin, totalprotein, kolesterol, urea og glukose i serum er ofte lave grunnet redusert leverfunksjon (11, 16). En mild økning i alanin aminotransferase (ALT) og alkalisk fosfatase (ALP) kan også forekomme (11, 16). Selv om pasienter med PSS ofte er polyuriske så vil urinanalyse kunne vise hyperstenuri (17).
Gallesyrer produseres i leveren og skilles ut via gallen til tarm. I ileum reabsorberes gallesyrene og transporteres via v. porta til leveren. Leveren er effektiv i å filtrere ut gallesyrer og hunder med normal enterohepatisk sirkulasjon og normal leverfunksjon viser bare svakt forhøyet plasmakonsentrasjon av gallesyrer postprandialt i motsetning til hunder med PSS (18). Ved en gallesyre- stimulasjonstest fastes hunden i 12 timer før det tas en blodprøve uten tilsatt antikoagulans. Deretter gis et fettrikt fôr og en ny blodprøve tas to timer senere. Denne testen gir viktig informasjon om leverens evne til å filtrere ut gallesyrene. Unormal høy serumkonsentrasjon av gallesyrer to timer postprandialt er rapportert å være 100 % sensitivt for PSS (18). Hos malteser må tolkningen av en gallesyretest baseres på at det er rapportert høyere normale konsentrasjoner av gallesyrer enn hos andre hunderaser (19).
Ammoniakk (NH3)tas opp fra mage-tarmkanalen og blir i leveren metabolisert til urea. Hos pasienter med PSS øker NH3 i blodet. NH3 bidrar til utviklingen av hepatisk encefalopati, men det er ikke noen klar sammenheng mellom nivåene av NH3 og grad av hepatisk encefalopati (13). Gallesyre-stimulasjonstest er angitt å ha høyere sensitivitet for PSS enn påvisning av økte serumkonsentrasjoner av NH3 (10).
Røntgenundersøkelse kan ikke sikkert diagnostisere PSS, men sekundærforandringer som liten lever, store nyrer, mineralisering av nyrebekken og urinstein kan påvises (12).
Ultralyd kan brukes for å diagnostisere PSS. IHPSS som er omgitt av levervev påvises lettest. Det er rapportert stor variasjon i spesifisitet og sensitivitet ved bruk av ultralyd for å stille diagnosen, og det er ofte nødvendig med andre billeddiagnostiske hjelpemidler (20-22).
CT-angiografi er en lite invasiv prosedyre som etter intravenøs injeksjon av kontrastmiddel visualiserer hele den venøse abdominale sirkulasjonen, inkludert v. porta og dens tilhørende blodkar. CT-angiografi er derfor et svært godt hjelpemiddel for å diagnostisere både EHPSS og IHPSS (23). CT-angiografi vil også kunne være til hjelp i planleggingen av kirurgisk intervensjon.
Scintigrafi (24), MRI og portal-venografi (25) kan også benyttes for å diagnostisere PSS, men dette er mindre aktuelt nå med tilgang til mindre invasive, raskere og bedre modaliteter.
Behandlingsalternativer
PSS kan behandles medisinsk eller kirurgisk. Medisinsk behandling tar sikte på å redusere symptomene. Kirurgisk behandling tar sikte på å korrigere PSS for å oppnå en normalt fungerende lever.
Medisinsk behandling
Medisinsk behandling av PSS innebærer endring av fôr til en diett med optimal mengde lettfordøyelige proteiner. Melkebaserte og vegetabilske proteiner reduserer risikoen for hepatisk encefalopati (4).
Laktulose er et disakkarid som enten kan gis peroralt (PO) eller rektalt. Laktulose blir metabolisert til organiske syrer av bakterier i tykktarmen og reduserer pH i tykktarmen. Dette bidrar til å omgjøre NH3 til ammonium (NH4+). NH4+ blir evakuert via feces og dette reduserer mengden NH3 som absorberes fra colon. Dersom gitt peroralt så senker laktulose også passasjetiden i tarm og kan på den måten bidra til lavere opptak av bakterielle toksiner og andre skadelige substanser (26).
Hepatisk encefalopati bør så langt det er mulig forebygges med diett og annen medisinering (27). Ved refraktær hepatisk encefalopati kan antibiotika vurderes brukt (28). Bruken av antibiotika ved hepatisk encefalopati er kontroversielt og bør reserveres til de pasienter der symptomene på hepatisk encefalopati ikke kontrolleres ved vanlig symptomatisk behandling. Antibiotika vil hos disse pasientene kunne redusere produksjonen av bakterielle toksiner i gastrointestinaltraktus og redusere symptomene på hepatisk encefalopati (29). Metronidazol er et godt alternativ dersom antibiotikabehandling er indisert (29).
De antioksidative og antiinflamma-toriske egenskapene til substrater som ursodeoksykolsyre, S-adenosyl-L-Metionin og silybin kan hjelpe pasienter med kronisk leverskade og bør vurderes som en del av den medisinske behandlingen (28).
Én studie har vist redusert letalitet sekundært til gastrointestinale blødninger dersom det tilføres protonpumpehemmer som for eksempel omeprazol før operasjon av PSS, og når denne medisineringen fortsetter resten av livet (30). Den underliggende årsaken til de gastrointestinale blødningene hos hundene i denne studien er imidlertid uklar og årsaken trenger ikke å ha vært nedsatt leverfunksjon på grunn av PSS. Det er publisert et «ACVIM consensus statement» som konkluderer med at det kun er svak evidens for bruk av magebeskyttende medisiner hos leverpasienter uten gastrointestinal blødning (31).
Medisinsk behandling av cIHPSS har vist seg vanskeligere enn tilsvarende behandling av cEHPSS da cIHPSS gir flere symptomer (4). Det er publisert en undersøkelse som viser at over halvparten av alle pasienter på medisinsk behandling blir avlivet i løpet av 10 måneder og at i de tilfeller der det er mulig, bør kirurgisk korreksjon av PSS velges som behandlingsalternativ (32).
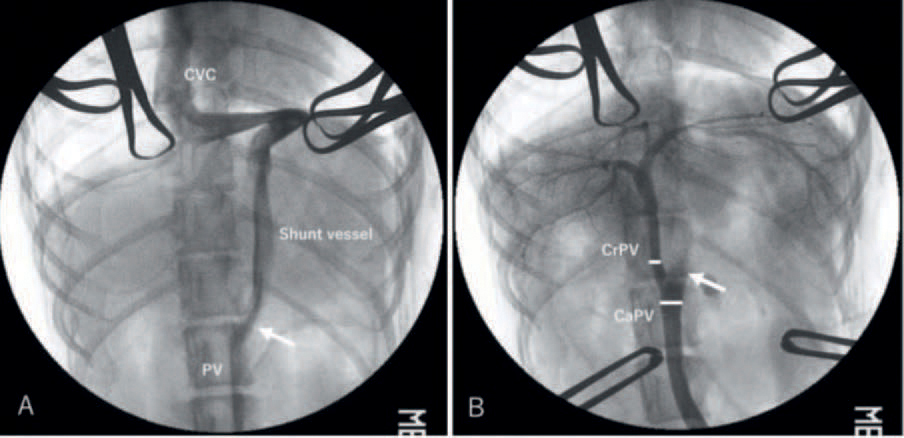
Figur 1 A: Intraoperativt portalvenogram tatt før midlertidig okklusjon av shunt. B: Intraoperativt portalvenogram tatt etter midlertidig okklusjon av shunt. Legg merke til tre tydelige forgreininger av portalvenen intrahepatisk. Pilen markerer punkt for midlertidig okklusjon. CVC: Kaudal vena cava, PV: Portalvene. CrPV: kranial del av portalvene, CaPV: kaudal del av portalvene. (Illustrasjon fra Dr. Hideki Kayanuma, gjengitt med tillatelse fra School of Veterinary Medicine, Azabu University, Japan)
Kirurgisk behandling
Hos pasienter med hepatisk encefalopati og IHPSS eller EHPSS gir kirurgisk behandling signifikant økt overlevelse og færre symptomer (33-35). Kirurgiske teknikker som kan benyttes er «ameroid constrictor», cellofanbinding og embolisering av shunt ved bruk av intrakaval stent og trombogene coiler (36, 37). Felles for disse teknikkene er at shuntingen av blod forbi leveren gradvis skal reduseres og at v. porta og leveren skal tilpasse seg den økte blodtilførselen. Til slutt lukkes shunten helt. Shunter kan også ligeres operativt, enten partielt eller totalt (25).
Ligering av ekstrahepatisk shunt
En fullstendig ligering av shunten intraoperativt bør gi bedre post-operative resultater enn delvis ligering og cellofanbinding. En studie rapporterte bruk av denne prosedyren hos 76,4 % av hunder med EHPSS (25). Alle hundene i denne gruppen (55 hunder) hadde portalt trykk innenfor normalområdet etter ligering, og ingen utviklet ervervet EHPSS postoperativt. Kombinert intraoperativt portalvenogram og måling av portalt trykk vil gi en indikasjon på om total ligering av shunten er mulig (25, 38).
Intraoperativt portalvenogram foretas ved å legge et venekateter i portasirkulasjonen og deretter gi kontrast intravenøst. Fluoroskopi brukes til å visualisere shunten. Etter dette foretas en midlertidig okklusjon av shunten og portalvenogram gjentas. På denne måten vil intrahepatisk forgreining av v. porta kunne vurderes samtidig som portalt trykk måles via venekateteret (Figur 1). Hunder med PSS som har tre eller flere forgreininger av portalvenen intrahepatisk, økning i portalt trykk på under 10cm H20 etter midlertidig ligering av shunt, eller et postligerings portalt venetrykk på under 20cm H20 er gode kandidater for total okklusjon av shunt ved ligering (25). Økt peristaltikk samt cyanose eller ødem av abdominale organer påvist intraoperativt kan være tegn til økt portalt trykk (39) og det bør da vurderes om total ligering av shunt er tilrådelig. Hos hunder med PSS hvor komplett ligering av shunten ikke er tilrådelig kan shunten ligeres delvis til ønsket portalt trykk. I tillegg plasseres en ekstra sutur rundt shunten. Denne kan strammes i en planlagt ny operasjon når leveren har tilpasset seg økningen i portalt trykk.
Perkutan transvenøs coil-embolisering (PTCE) av IHPSS
cIHPSS kan være vanskelig å korrigere kirurgisk (40). Shunter som er omgitt av levervev kan være vanskelig å dissekere frem. IHPSS i venstre mediale og venstre laterale leverlapp er rapportert å være mindre kompliserte å operere enn IHPSS i midtre eller høyre del av leveren (41).
Grunnet den høye komplikasjons-raten forbundet med kirurgisk korreksjon av IHPSS (42) har det blitt utviklet nye teknikker for å korrigere disse. PTCE er en intervensjonsradiologisk prosedyre hvor det under generell anestesi, via en perkutan jugular veneport, foretas stenting av v. cava og coiling av cIHPSS. Prosedyren utføres med fluoroskopi (11).
Preoperativ CT-angiografi for å måle diameteren på v. cava caudalis og shuntens lokalisasjon er nødvendig for å velge riktig stent. En jugular veneport blir så lagt og en guidewire brukes til å føre kateter inn veneporten, via v. jugularis og v. cava cranialis, til hjertet, gjennom høyre forkammer og ut i v. cava caudalis.
Ved bruk av katetre kan det gis kontrastmateriale i v. cava og shunten slik at shunten kan lokaliseres ved hjelp av fluoroskopi. Når dette er gjort, plasseres en selvekspanderende nitinolstent i v. cava caudalis slik at denne dekker for shunten. Deretter plasseres, ved hjelp av kateter, trombogene coiler på utsiden av stenten. Det er nødvendig med gjentatte målinger av blodtrykk i v. cava og i shunten for å sikre riktig trykkgradient og portalt trykk (11). Denne prosedyren gir både en umiddelbar delvis okklusjon samt en progressiv okklusjon som resulterer i total tilstopping. Om nødvendig kan ekstra coiler plasseres ved et nytt inngrep senere. En film av prosedyren kan sees på https://vimeo.com/70131130
Komplikasjoner ved kirurgisk behandling av PSS
Når shuntingen stoppes helt ved total ligering, eller reduseres ved partiell okklusjon, så stiger det portale trykket. Dersom leveren tilpasser seg denne økte blodstrømmen så bør det resultere i en normal funksjonell lever. Dersom trykket i v. porta øker for mye kan det resultere i akutt portal hypertensjon karakterisert ved hypovolemisk sjokk, diaré og oppkast (7, 16). Status epileptikus er også observert som en følgetilstand av for høyt trykk i v. porta (43).
PTCE for behandling av IHPSS ble beskrevet i 1993 (44). Denne prosedyren har senere blitt kombinert med en intraluminal cavalstent for å hindre migrering av coiler og er brukt både for IHPSS og EHPSS (45, 46). PTCE er en sikker, lite invasiv behandling for PSS og studier har vist lite komplikasjoner og en svært høy suksessrate (92 %) (11, 47). I tillegg til de allerede beskrevne komplikasjonene ved operasjon av PSS så forekommer det andre komplikasjoner ved PTCE. Når coilen føres inn i shunten via kateteret er denne rettet ut og når den går ut av kateteret begynner den å coile seg opp. Den kan ikke flyttes på når den er lagt og derfor er nøyaktig plasseringen viktig. Kateteret bør være et stykke inn i shunten når coilene plasseres, slik at disse vrir seg opp i shunten, på utsiden av stenten, og ikke kan migrere til hjerte og lunger (46). Blødning fra jugulær veneport er også en mulig komplikasjon ved denne prosedyren.
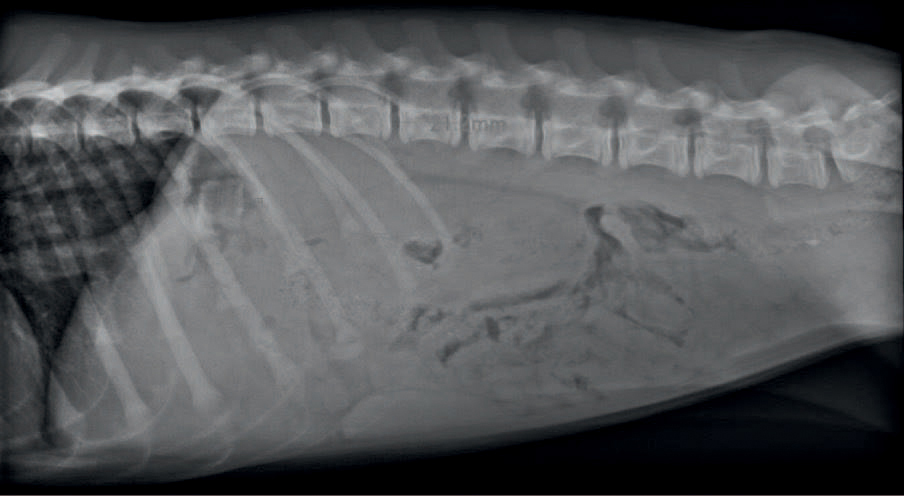
Figur 2. Røntgenbilde av abdomen. Lateralplan, høyre side ned. Det er tydelig store nyrer, og leveren ser subjektivt sett liten ut. Det er ubestemmelig materie i magesekken. Gjengitt med tillatelse fra Fredrikstad Dyrehospital.
Materiale og metoder
Laboratorieanalyser
Hematologiske undersøkelser med unntak av hematologisk prøve for Kasus 2 er analysert med Idexx Procyte (Idexx Laboratories, Inc. Westbrook, Maine USA). For Kasus 2 er hematologisk prøve samt biokjemisk prøve, inkludert første gallesyretest analysert ved Sentrallaboratoriet, NMBU Veterinærhøgskolen i Oslo. Alle andre biokjemiske undersøkelser er analysert med Idexx Catalyst (Idexx Laboratories, Inc. Westbrook, Maine USA), med unntak av de andre gallesyre-stimulasjonstestene som er analysert hos Idexx Laboratories Norge AS. Urinprøvene ble analysert med Idexx UA Analyzer, (Idexx laboratories, Inc. Westbrook, Maine USA)
Dag |
HK |
RBC |
HGB |
MCV |
RETIC |
Monocytter |
Blodplater |
aPTT |
PT |
|---|---|---|---|---|---|---|---|---|---|
(L/L) |
(10e12/L) |
(g/L) |
(fL) |
(10e9/L) |
(10e9/L) |
(10e9/L) |
(sekund) |
(sekund) |
|
RI: 0,37 - 0,62 |
RI: 5,65-8,87 |
RI: 131-205 |
RI: 61,6-73,5 |
RI: 10-110 |
RI: 0,16-1,12 |
RI: 148-484 |
RI: 72-102 |
RI: 11-17 |
|
-38 (pre op.) |
0,38 |
6,18 |
131 |
60,7* |
161* |
1,32* |
301 |
- |
- |
0 (operasjon) |
0,30* |
5,85 |
112* |
51,8* |
105 |
1,61* |
272 |
92 |
15 |
2 (post op.) |
0,27* |
5,24* |
99* |
52,3* |
61 |
1,70* |
97* |
- |
- |
10 (post op.) |
0,30* |
5,84 |
106* |
51,2* |
130* |
1,08* |
132* |
- |
- |
52 (post op.) |
0,34* |
7,31 |
114* |
46,9* |
162* |
0,71 |
344 |
- |
- |
HK: Hematokrit, RBC: Erytrocytter, HGB: Hemoglobin, MCV: Gjennomsnittlig erytrocyttvolum, RETIC: Retikulocytter, aPTT: aktivert partiell tromboplastintid,
PT: Protrombintid,
RI: Referanseintervall (voksne hunder). Resultater utenfor referanseintervallet er markert med *
Kasuistikker
Begge hundene i denne artikkelen var pasienter ved Fredrikstad Dyrehospital. Den ene eieren oppsøkte selv klinikken for en ny vurdering av sin hund (kasuistikk 1) mens den andre pasienten ble henvist (kasuistikk 2).
Kasuistikk 1
Signalement og anamnese
En border collie, intakt tispe, fire måneder gammel som veide 8,25 kg hadde vist varierende allmenntilstand med nedstemthet og oppkast over tid. Oppkast hadde økt i frekvens og omfang den siste måneden.
Klinisk undersøkelse
Valpen ble presentert på klinikken med overbitt, mild avmagring og svært nedsatt allmenntilstand. Den var afebril (38,8 ˚C), lett sjanglete, svært slapp og sovnet i løpet av undersøkelsen. Generell klinisk undersøkelse, inkludert auskultasjon og palpasjon av bryst- og bukhule var uten unormale funn.
Diagnostiske undersøkelser
Basert på avmagring og svært nedsatt allmenntilstand ble det tatt blodprøve til hematologiske analyser (Tabell 1A). Videre ble det tatt blodprøve til klinisk-kjemiske analyser (Tabell 1B). Urin ble samlet ved cystocentese for kjemisk analyse. Spesifikk vekt var 1.013, pH 8 og 1+ utslag for blod. Bakteriologisk dyrkningsundersøkelse var negativ.
Basert på symptomene fra GI-traktus ble det utført røntgen-undersøkelse av abdomen.
Denne undersøkelsen viste store nyrer. Venstre nyre hadde en lengde på 8,8 cm målt på røntgenbildet. Lengden på lumbalvirvel var 2,1 cm, som ga et forhold mellom lengdene av nyre/lumbalvirvel på 4,2. Dette forholdet skal være cirka 3 (48). Ellers viste røntgenbildene nedsatt serosadetalj i abdomen og leveren ble vurdert som liten. Lateralprojeksjon av abdomen viste som eneste avvik et røntgentett område på 1,5x1,5 cm i ventrikkelen som ga mistanke om fremmedlegeme (Figur 2). Det ble derfor utført ny røntgenundersøkelse av GI-traktus med kontrast. Resultatet viste normal passasje av bariumsulfat. Repeterte røntgenbilder kunne ikke ettervise røntgentett område i ventrikkelen og dette ble derfor ikke fulgt opp.
Ultralydundersøkelse av abdomen viste en liten, karfattig lever, med en stor anekkogen struktur i tillegg til galleblæren. Det var bilateral renomegali. De andre bukorganene var normale.
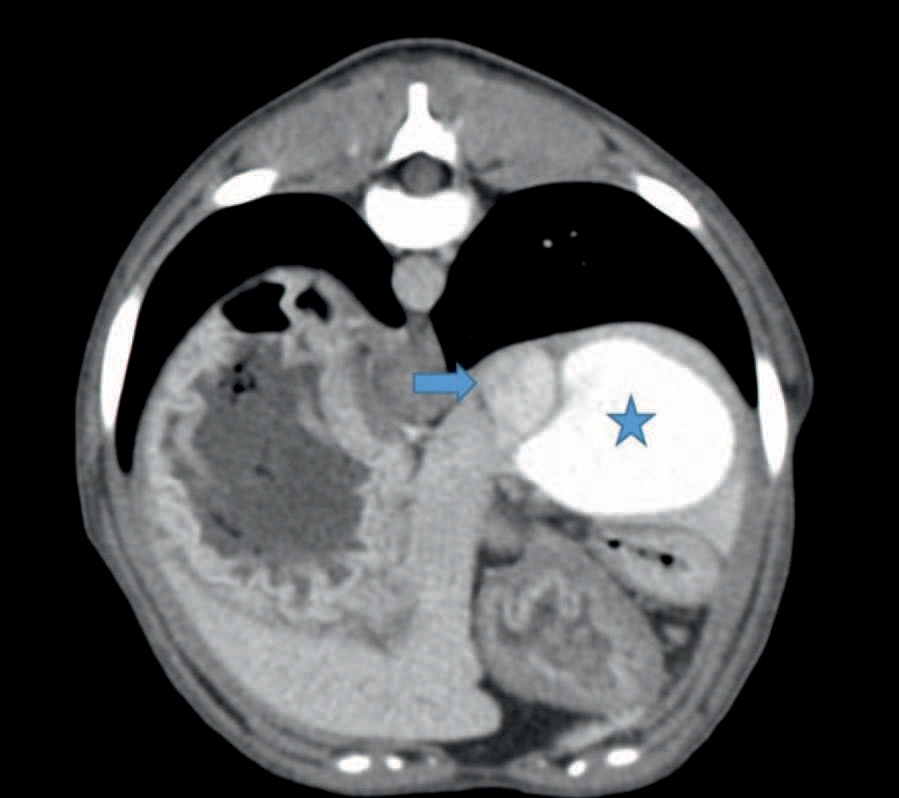
Figur 3. Transversalt CT-snitt gjennom abdomen etter intravenøs kontrast. Intrahepatisk shunt har samlet kontrast og sees som en stor godt avgrenset struktur markert med en stjerne. Vena cava sees til venstre for shunten og er markert med en pil. Gjengitt med tillatelse fra Fredrikstad Dyrehospital.
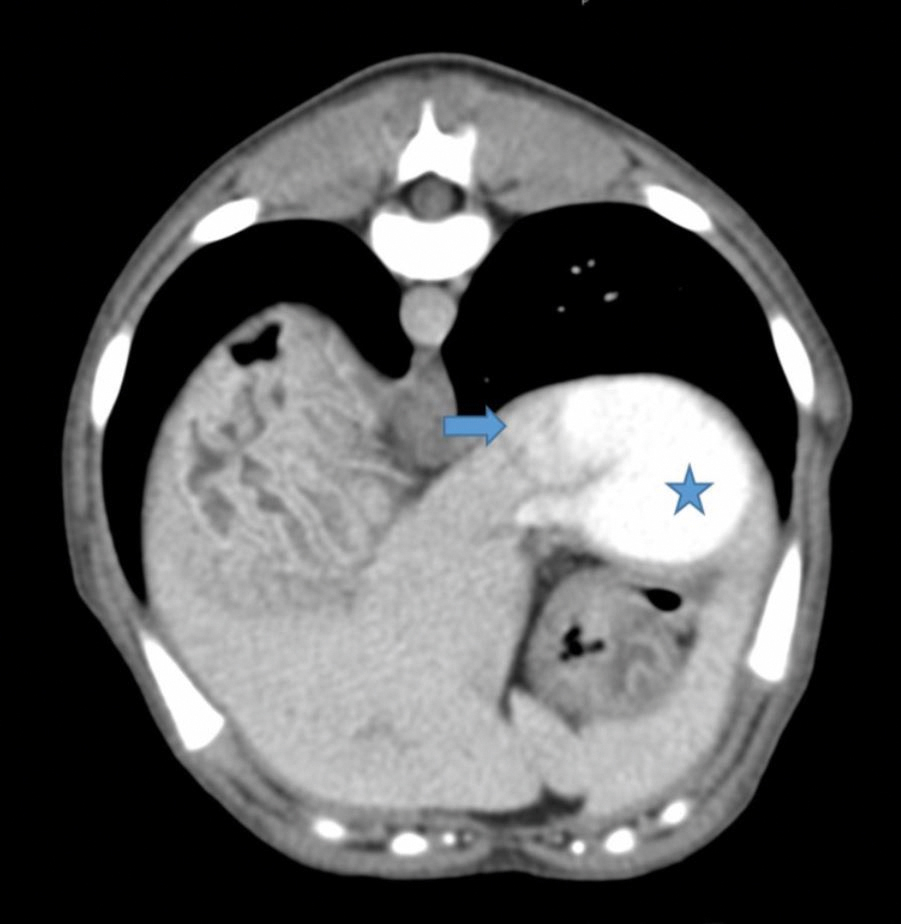
Figur 4. Transversalt CT-snitt gjennom abdomen, viser sammenkobling av shunt og kaudal vena cava. Shunt og vena cava markert som på forrige bilde. Gjengitt med tillatelse fra Fredrikstad Dyrehospital.
Differensialdiagnose
Anamnese og kliniske symptomer, sammen med blodprøveresultatene og konklusjonen av de billeddiagnostiske undersøkelsene gjorde PSS til en sannsynlig differensialdiagnose.
Videre utredning for sannsynlig PSS
Etter 12 timers faste ble det foretatt en gallesyre-stimulasjonstest som viste unormalt høye konsentrasjoner av gallesyrer både i 0-prøven og i prøven to timer postprandialt (Tabell 1B).
Pasienten ble sendt hjem med beskjed til eier om å fôre hunden med en optimal diett (Hill’s® Prescription Diet® l/d® Canine). Den fikk også laktulose (Duphalac mikst, «Mylan IRE Healthcare Ltd.») 404 mg/kg PO BID, samt omeprazol (Omeprazol Pensa, «Pensa pharma») 0,6 mg/kg PO SID inntil videre.
Etter en uke hadde hundens vekt økt med 150 gram. Hunden hadde ikke hatt oppkast eller diaré og ikke vist symptomer forenlig med hepatisk encefalopati. Appetitten var god, men hunden hadde ifølge eier vist økt væskeinntak og urinering. Klinisk undersøkelse viste en sirkulatorisk og respiratorisk stabil pasient.
Pasienten ble premedisinert med deksmedetomidin hydroklorid (Dexdomitor® vet. «Orion») 3,0 µg/kg og metadonhydroklorid (Metadon®, «NAF») 0,3 mg/kg IM. Propofol (PropoVetTM Multidose, «Zoetis») ble gitt via venekateter til effekt, totalt 0,8 mg/kg. Etter intubering ble anestesi opprettholdt med en blanding av sevofluran (Sevofluran Baxter®, «Baxter Healthcare Ltd.»), oksygen og luft. Det ble først foretatt en nativ CT-undersøkelse av abdomen med en slicetykkelse på 1,25 mm i bløtvevsalgoritme. Pasienten fikk deretter joheksol (Omnipaque®, «GE Healthcare») 581 mg/kg IV og det ble foretatt ny CT-skanning 30 sekunder etter administrasjon av kontrast.
Diagnose
CT-skanningen viste en enkel høyresidig IHPSS som kommuniserte med v. cava caudalis rett ved diafragma. Ingen andre shunter var synlige. CT-skanningen viste også bilateralt store nyrer og liten lever, men ingen andre unormale funn. Shuntens størrelse var tre cm i lengde og største diameter var tre cm (Figur 3 og 4). Pasienten hadde normal postoperativ oppvåkning og ble sendt hjem samme dag.
Behandling av cIHPSS med PTCE
Ved fem måneders alder, en måned etter diagnosen, ble pasienten hospitalisert for PTCE av intrahepatisk shunt. Hundens vekt var nå økt til 10,65 kg. Allmenntilstanden var god, uten symptomer på hepatisk encefalopati. På grunn av bløt avføring var tilførselen av laktulose seponert. Preoperativ undersøkelse avdekket retinerte melketenner og overbitt. Rektaltemperaturen var 39,1 ˚C. Det ble tatt blodprøver til analyse preoperativt (Tabell 1A og 1B)
Pasienten ble premedisinert med acepromazin (Plegicil® vet. “Pharmacia Upjohn”) 0,018 mg/kg og metadonhydroklorid (Metadon® «NAF») 0,23 mg/kg IM og anestesi ble indusert med propofol (PropoVetTM Multidose, «Zoetis») gitt med venekateter til effekt, totalt 3,12 mg/kg, før intubering. Pasienten ble holdt i generell anestesi med sevofluran (Sevofluran Baxter®, «Baxter Healthcare Ltd.») blandet med oksygen og luft til PTCE var gjennomført.
Grunnet forventet anestesilengde og bruk av implantater ble det gitt antibiotika (Cefalotin, «Villerton» ®15 mg/kg) IV 30 minutter før induksjon, en dose 15 mg/kg intraoperativt, 90 minutter etter første dose, samt en tilsvarende dose postoperativt.
I hundens høyre jugularvene ble en 10 French (3,3 mm) veneport lagt med Seldinger-teknikk. Deretter førtes en guidewire og så et cobrakateter inn veneporten, gjennom v. jugularis, via v. cava cranialis til høyre forkammer, gjennom høyre forkammer og ut i v. cava caudalis til leveren, hele veien under fluoroskopisk kontroll. Prosedyren ble gjentatt slik at det ble lagt to katetre i v. cava. Det ene kateteret ble så brukt til å lokalisere shunten via fluoroskopi ved å injisere joheksol (Omnipaque®, «GE Healthcare»). Etter dette ble det ene kateteret ført videre inn i shunten. Det andre kateteret ble ført nedover i v. cava caudalis slik at enden på kateteret var kaudalt for shuntens åpning. Deretter ble det foretatt angiografi ved å injisere joheksol (Omnipaque®, «GE Healthcare») samtidig i begge katetre og shuntens størrelse og avgrensing ble målt. Maksimal diameter av v. cava ved positivt ende-ekspiratorisk trykk ble målt til 15 mm. Portalt og kavalt trykk ble målt med manometer via de individuelle katetrene og trykkgradienten var 1 cm H2O. Deretter ble katetrene erstattet med guidewire og en selvekspanderende nitinolstent med 16 mm diameter ble lagt inn i v. cava, slik at den dekket over hele shuntåpningen.
Kombinasjonen av guidewire og kateter ble igjen benyttet for å få tilgang til shunten gjennom metallnettet i stenten. Portalt trykk ble målt på nytt og det ble lagt inn trombogene coiler (19 stykker totalt: 10 stykker 8 mm diameter og 9 stykker 5 mm diameter, begge 5 cm lange) inntil trykkgradienten mellom v. porta og v. cava caudalis ble 6,5 cm H2O. Denne prosedyren gir umiddelbart en delvis okklusjon som gradvis skal utvikles til en total tilstopping av shunten. Etter prosedyren ble veneporten erstattet med et Mila 5 French 13 cm Double Lumen (20 Ga + 18 Ga lumen) sentralvenøst kateter (Figur 5).
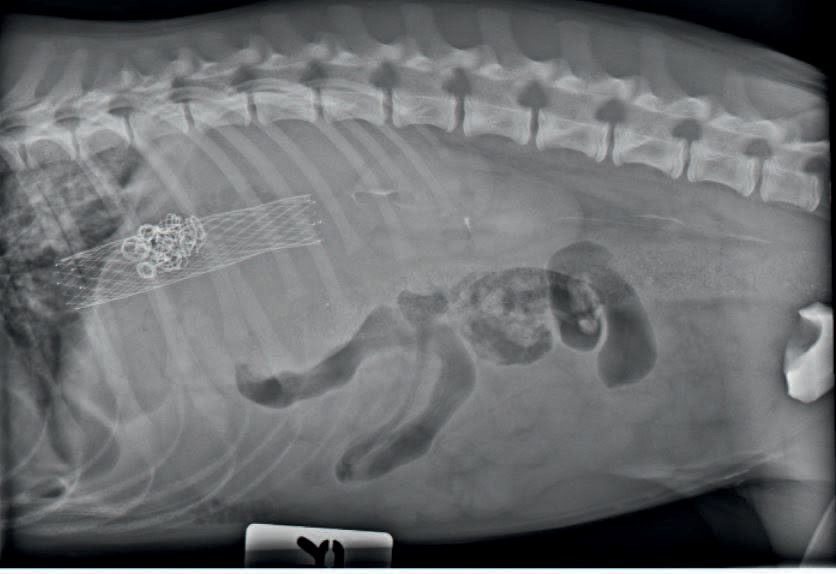
Figur 5. Røntgenbilde post operativt. Stent med koiler sees tydelig. Det er kontrastmateriale i nyrebekken, uretere og i urinblæren og noe gass i mage-tarmkanalen. Det er et blandet alveolært og interstitielt lungemønster forenelig med atelektase. Gjengitt med tillatelse fra Fredrikstad Dyrehospital.
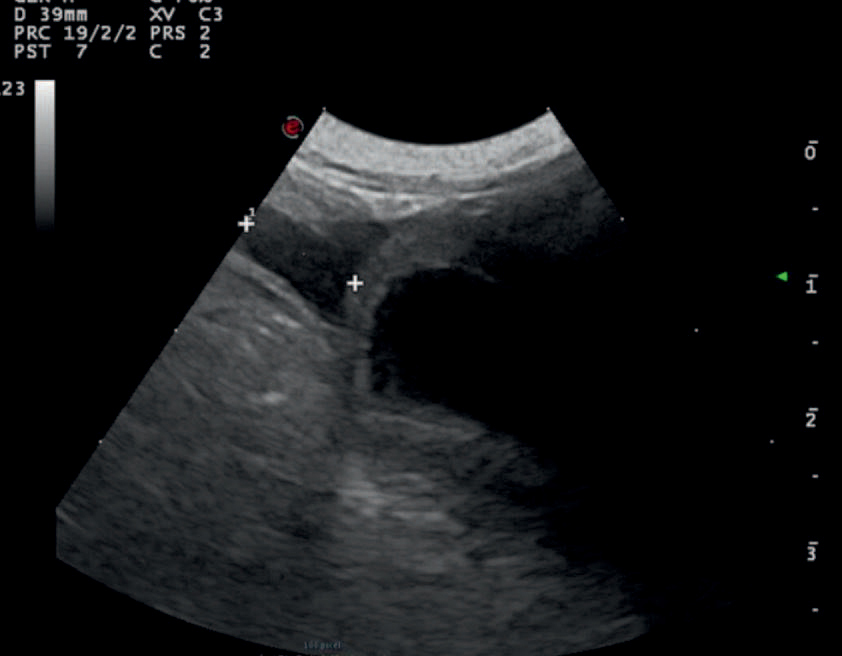
Figur 6. Ultralydundersøkelse dag 1 post-operativt. Det er litt fri abdominal væske, (rent transudat, bekreftet via abdominocentese) rett kranialt for blæren. Ascitesvæsken sees mellom kryssene til venstre i bildet, urinblæren sees til høyre i bildet. Gjengitt med tillatelse fra Fredrikstad Dyrehospital.
Kontroll postoperativt
Ved klinisk undersøkelse morgenen etter prosedyren var hunden afebril (38,3 ˚C). Hjertefrekvensen var 110/min. Det var normal pulskvalitet i femoralarteriene. Kapillærfylningstid var ett sekund. Slimhinnene hadde lys rosa farge og normal fuktighet. Pasienten var normovolem og ikke bukøm. Det ble foretatt en abdominal ultralydundersøkelse dagen etter inngrepet. Denne viste små mengder anekkogen væske kranialt for begge nyrer samt kranialt for blære. Behandling ble startet med spironolakton (Spirix®, «Takeda») 2,2 mg/kg PO SID. Behandling med cefalotin ble fortsatt. Ultralydundersøkelsen ble gjentatt dagen etter og viste avtagende ascitesvæske (Figur 6).
Pasienten ble monitorert på klinikken i tre dager postoperativt. Hunden var hele tiden i god allmenntilstand, spiste godt, kastet ikke opp og hadde ingen nevrologiske symptomer. Det ble tatt flere laboratorieprøver i denne perioden (Tabell 1A og 1B).
Pasienten ble sendt hjem med en diett utviklet for hunder med leversykdom (Hill’s® Prescription Diet® l/d® Canine), cefalotin (Cefalotin®, «Villerton») 15 mg/kg PO BID, omeprazol (Omeprazol Pensa, «Pensa pharma») 0,47 mg/kg PO SID, spironolakton (Spirix®, «Takeda») 2,2 mg/kg SID og laktulose (Duphalac®, «Mylan IRE Healthcare Ltd.») 138 mg/kg BID fram til neste kontroll.
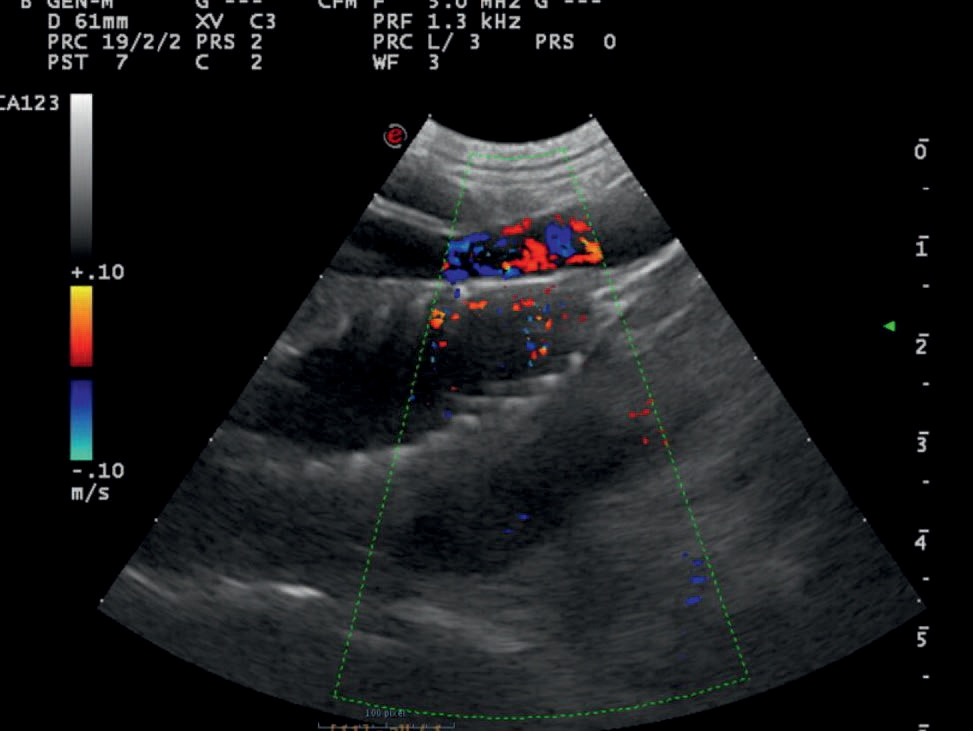
Figur 7. Ultralydbilde som viser stent i kaudal vena cava («fiskebein»). Det hypoekkogene området under stenten representerer det som er igjen av shunten. Dopplerundersøkelse viste at det ikke var turbulens i kaudale vena cava. Gjengitt med tillatelse fra Fredrikstad Dyrehospital.
Videre forløp
Pasienten kom til kontroll syv dager etter hjemsendelse. Pasienten presenterte seg som våken, alert og responsiv. Klinisk undersøkelse avdekket ingen abnormale funn. Vekten hadde økt med 800 gram. Det ble tatt blodprøver til hematologiske og klinisk-kjemiske analyser (Tabell 1A og 1B). Suturer i huden fra prosedyren ble fjernet. Medisinering med omeprazol, spironolakton og laktulose ble videreført med uendret dosering. Cefalotinbehandlingen som burde vært avsluttet før hjemsendelse ble nå seponert.
Åtte dager senere hadde vekten økt med 550 gram. Det ble avtalt ny kontroll fem uker senere for ultralydundersøkelse av abdomen og en gallesyre-stimulasjonstest.
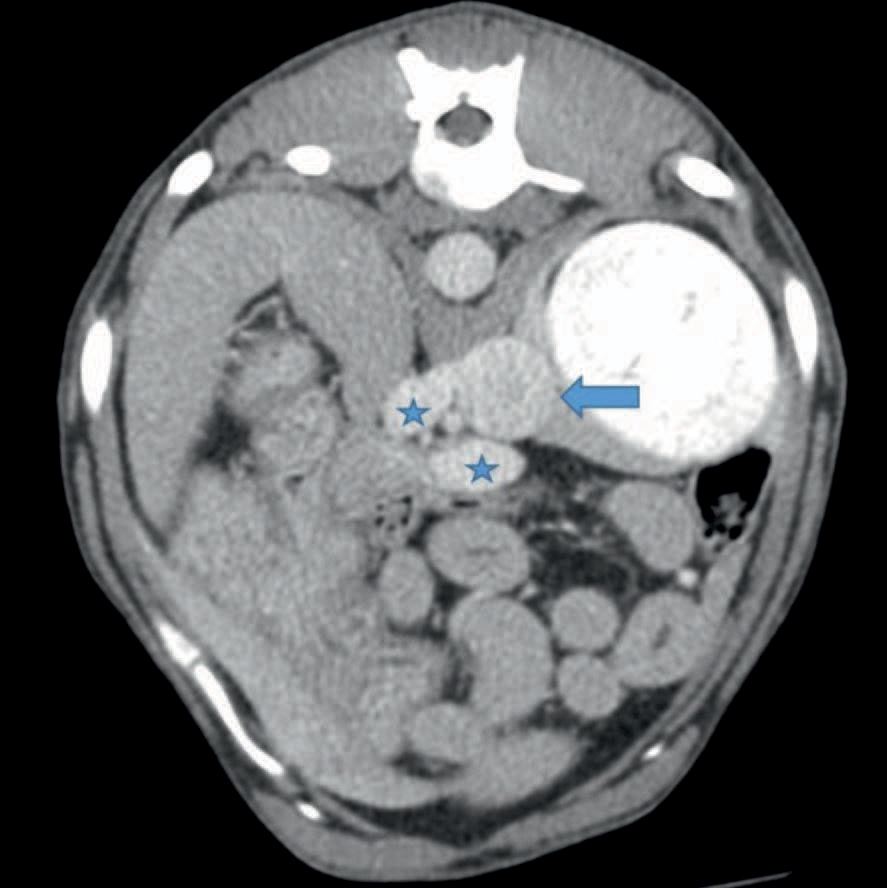
Figur 8. Transversalt CT-snitt gjennom abdomen etter intravenøs kontrast. En enslig splenokaval shunt sees tydelig. Shunt er markert med stjerner og vena cava er markert med en pil. Gjengitt med tillatelse fra Fredrikstad Dyrehospital.
Da pasienten kom til kontroll fem uker senere var den blitt syv måneder og veide 13,0 kg. Ifølge eieren var hundens allmenntilstand god, uten symptomer på sykdom. Tidligere rapportert PU/PD hadde opphørt. Det ble foretatt en gallesyre-stimulasjonstest samt ultralydundersøkelse av buken. Gallesyretesten viste nå normale konsentrasjoner (Tabell 1B) og ultralydundersøkelsen påviste ingen unormale funn. Leveren hadde økt i størrelse (Figur 7).
Fôringen med en diett optimalisert for leversykdom ble gradvis trappet ned og erstattet med et ordinært valpefôr. Behandlingen med laktulose og spironolakton ble seponert. Behandling med omeprazol (Omeprazol Pensa, «Pensa pharma») 0,5 mg/kg PO SID fortsatte i seks måneder før seponering. 39 måneder senere er hunden symptomfri og får ingen medisiner.
Dag |
Glukose |
Albumin |
Total protein |
ALT |
ALP |
GGT |
Urea |
Kolesterol |
Gallesyrer (F) |
Gallesyrer (S) |
|---|---|---|---|---|---|---|---|---|---|---|
(mmol/L) |
(g/L) |
(g/L) |
(U/L) |
(U/L) |
(U/L) |
(mmol/L) |
(mmol/L) |
(µmol/L) |
(µmol/L) |
|
RI: 4,3-8,3 |
RI: 21-36 |
RI: 48-72 |
RI: 8-75 |
RI: 46-337 |
RI: 0-2 |
RI: 2,5-10,4 |
RI: 2,6-10,3 |
RI: <20 |
RI: <25 |
|
-38 (preop) |
5,5 |
27 |
53 |
99* |
271 |
1 |
1,4* |
3,4 |
138,6* |
340,4* |
0 (operasjon) |
5,1 |
22 |
48 |
49 |
226 |
- |
1,3* |
- |
- |
- |
1 (postop) |
6,2 |
19* |
43* |
161* |
243 |
- |
<0,6* |
- |
- |
- |
2 (postop) |
4,6 |
20* |
45* |
162* |
224 |
5* |
0,6* |
4,0 |
- |
- |
3 (postop) |
- |
21 |
- |
- |
- |
- |
- |
- |
- |
- |
10 (postop) |
5,5 |
26 |
55 |
108* |
273 |
- |
2,5 |
- |
- |
- |
52 (postop) |
5,3 |
32 |
61 |
54 |
139 |
- |
5,5 |
- |
0,6 |
7,3 |
ALT: Alanin aminotransferase, ALP: alkalisk fosfatase, GGT: Gamma glutamyl transferase, F: Fastet, S: Stimulert
RI: Referanseintervall (voksne hunder). Resultater utenfor RI er markert med *
Kasuistikk 2
Signalement og anamnese
En schillerstøver, intakt tispe, to år og åtte måneder gammel som veide 17,2 kg ble henvist til klinikken for utredning av langvarig PU/PD og funn av økte gallesyrer i serum. Hunden var ellers i fin form uten å ha vist nevrologiske symptomer eller symptomer fra GI-traktus.
Klinisk undersøkelse
Allmenntilstanden var god og hunden viste normal adferd under konsultasjonen. Klinisk undersøkelse var upåfallende og avdekket en godt muskelsatt, men slank hund.
Diagnostiske undersøkelser
Basert på anamnesen så hadde henvisende veterinær tatt blodprøver til hematologisk (Tabell 2A) og klinisk-kjemisk analyse, inkludert gallesyre stimulasjonstest (Tabell 2B). Gallesyretesten viste unormalt høye konsentrasjoner både før og etter stimulering (Tabell 2B). Urinprøve hadde spesifikk vekt på 1.004. Kjemisk undersøkelse, sedimentundersøkelse og bakteriologisk undersøkelse av urinen var alle negative.
Differensialdiagnose
Basert på den unormale gallesyretesten var PSS en mulig differensialdiagnose.
Videre utredning for mulig PSS
Det ble foretatt en ultralydundersøkelse av abdomen. Denne var ikke konklusiv for PSS. Det ble derfor bestemt å utføre en CT-undersøkelse av abdomen. Pasienten ble gitt 5,8 µg/kg
deksmedetomidin hydroklorid (Dexdomitor® vet. «Orion») og metadon (Metadon®, «NAF») 0,11 mg/kg IM som premedisinering. Deretter ble det gitt propofol (PropoVetTM Multidose, «Zoetis») med venekateter til effekt, totalt 2,35 mg/kg, før intubering. Ved CT-undersøkelsen av abdomen ble det benyttet slicetykkelse 1,25 mm rekonstruert med en bløtvevsalgoritme. En tilsvarende skanning ble foretatt 30 sekunder etter tilførsel av joheksol (Omnipaque®, «GE Healthcare») 600 mg/kg IV.
Diagnose
CT-skanningen viste en ekstrahepatisk, splenokaval cPSS (Figur 8). Hunden ble sendt hjem med medisinsk behandling i form av (Hill’s® Prescription Diet® l/d® Canine) og laktulose (Duphalac mikst, «Mylan IRE Healthcare Ltd.») 187 mg/kg PO BID.
Dag |
HK |
RBC |
HGB |
MCHC |
MCV |
Blodplater |
|---|---|---|---|---|---|---|
(L/L) |
(10e12/L) |
(g/L) |
(g/L) |
(fL) |
(k/fL) |
|
RI: 0,35-0,55 |
RI: 5,1-8,5 |
RI: 120-180 |
RI: 320-360 |
RI: 62-76 |
RI: 180-500 |
|
-43 (pre op.) |
0,58* |
8,1 |
177 |
305* |
72 |
304 |
HK: Hematokrit, RBC: Erytrocytter, HGB: Hemoglobin, MCHC: Gjennomsnittskonsentrasjon av HGB i erytrocytter, MCV: Gjennomsnittlig cellevolum
RI: Referanseintervall. Resultater utenfor RI er merket med*
Dag |
Glukose |
Albumin |
Total protein |
ALT |
ALP |
Urea |
Kolesterol |
Gallesyrer (F) |
Gallesyrer (S) |
(mmol/L) |
(g/L) |
(g/L) |
(U/L) |
(U/L) |
(mmol/L) |
(mmol/L) |
(µmol/L) |
(µmol/L) |
|
RI: 3,6-6,6 |
RI: 32-44 |
RI: 54-75 |
RI: 0-80 |
RI: 0-90 |
RI: 3,5-7,2 |
RI: 3,4-10.0 |
RI: 0-10 |
RI: 0-25 |
|
-43 (pre op.) |
- |
32 |
58 |
76 |
106* |
5,2 |
4,5 |
178* |
291* |
42 post op. |
- |
- |
- |
- |
- |
- |
- |
<0,1 |
2,9 |
ALT: Alanin aminotransferase, ALP: alkalisk fosfatase, F: Fastet, S: Stimulert*
RI: Referanseintervall. Resultater utenfor RI er merket med *
Behandling av cEHPSS med total ligering
Etter en preoperativ klinisk undersøkelse uten signifikante avvik ble pasienten premedisinert med acepromazin 0,02 mg/kg (Plegicil® vet. «Pharmaxim») og metadonhydroklorid (Metadon® «NAF») 0,46 mg/kg IM. Etter dette ble anestesi indusert med propofol (PropoVetTM Multidose «Zoetis») gitt via venekateter til effekt, totalt 2,61 mg/kg før intubering.
En standard ventral celiotomi ble foretatt, og det ble inspisert etter ervervet PSS. Disse observeres oftest i nyreregionen (Vicky Lipscomb, Royal Veterinary College, personlig meddelelse). Ingen slike funn ble gjort. Etter at ervervet PSS hadde blitt utelukket, ble den omentale bursa åpnet, og den splenokavale shunten kunne sees. Det var godt synlig turbulent blodstrømning i shunten. Det ble etter dette lagt et 20 G venekateter i en stor vene fra milten, og «portalt» trykk ble målt til 5,5 cm H20. Deretter ble det foretatt et portalt venogram ved bruk av fluoroskopi og joheksol intravenøst i portalsirkulasjonen. Dette viste tydelig levershunten og lite kontrast i portalvenen og intrahepatisk vaskulatur. Etter dette ble levershunten midlertidig ligert, og et nytt portal-venogram foretatt. Portalvenogrammet viste tre intrahepatiske forgreininger av portalvenen. Det ble så foretatt en midlertidig komplett ligering av levershunten ved bruk av et penrosedren og bukorganene ble inspisert for tegn til økt portalt trykk. Portalt trykk ble målt til 12 cm H20 med manometer, godt under referansenivå for komplett ligering (25), og det ble besluttet å foreta en total ligering av shunten. Shunten ble ligert med monofilament ikke-resorberbar sutur, av typen Monosof 2-0. Etter prosedyren ble pasienten hospitalisert til neste dag (Figur 9).
Kontroll postoperativt
Dagen etter operasjonen var hundens allmenntilstand god. Klinisk under-søkelse avdekket ingen unormale funn. Ultralydundersøkelse viste ingen ascites eller tegn til ødem i pancreas og hunden ble sendt hjem med meloksikam (Metacam® vet. «Boehringer Ingelheim Vetmedica GmbH» 0,1 mg/kg PO SID i syv dager for smertestillende effekt, samt laktulose (Duphalac mikst, «Mylan IRE Healthcare Ltd.»)166 mg/kg morgen og kveld. Det ble ikke foreskrevet andre medisiner.
Videre forløp
Ved suturfjerning var pasienten i veldig god form. PU/PD, som var eiers hovedbekymring og årsak til første veterinærbesøk, var opphørt og hunden drakk nå normalt ifølge eier. Stingene ble fjernet og ny time til kontroll av gallesyrer i serum ble satt opp fem uker senere. Fem uker senere hadde pasienten lagt på seg 1,8 kg, fra 17,2 til 19 kg. En gallesyre-stimulasjonstest viste nå normale lave konsentrasjoner (Tabell 2B). Ti måneder senere lever pasienten et normalt hundeliv, uten medisiner.
Diskusjon
Pasienter med hepatisk encefalopati og eleverte gallesyrer i serum kan ha flere underliggende årsaker der PSS er en viktig differensialdiagnose. Det er viktig, og helt nødvendig for å kunne tilby riktig behandling, at disse pasientene utredes systematisk og grundig for å stille riktig diagnose. I motsetning til pasienter med hepatitt, hypoplasi av v. porta, endestadiums leversvikt og/eller ervervet PSS, så kan og bør pasienter med cPSS opereres. Det er helt nødvendig å skille disse pasienten fra hverandre preoperativt. Pasienter med cPSS presenterer gjerne i ung alder (9,10), men flere voksne og geriatriske pasienter har blitt diagnostisert med cPSS og man skal være forsiktig med å ekskludere cPSS som diagnose med bakgrunn i alder. En studie rapporterte at >10% av pasienter med cPSS diagnostiseres etter fylte 4 år (1).
Ervervet PSS oppstår grunnet økt portalt trykk over tid. Hos pasienter med ervervet PSS er det allerede portal hypertensjon, og da vil ikke kirurgisk korreksjon av PSS være indisert. Økt portalt trykk hos hund oppstår gjerne grunnet kronisk leversykdom og levercirrhose (49) og er vanligere hos eldre individer. Utredningen av pasienter med eleverte gallesyrer i serum bør derfor inkludere en abdominal ultralyd for å utelukke kronisk leversykdom og cirrhose. Ascites og ervervet PSS kan visualiseres via ultralyd. Det samme kan en forstørret venstre v. testicularis eller v. ovarica. I tillegg til dette kan portavenens størrelse også gi en indikasjon på trykket i venen (50).
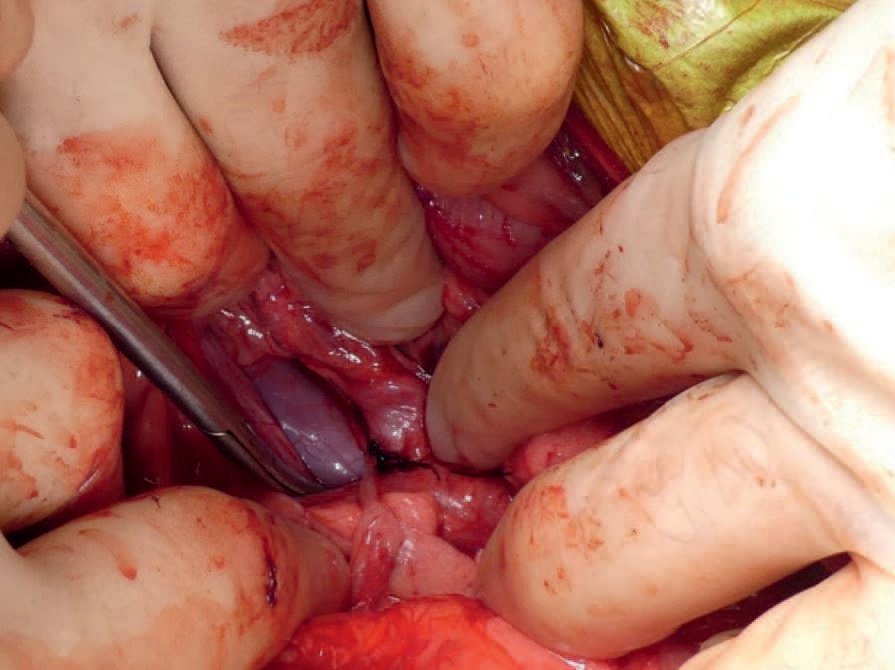
Figur 9. Intraoperativt bilde av ligert shunt. Mellom instrumentet og suturmaterialet sees kaudal vena cava. Shunten sees ikke godt på dette bilde da den delvis er dekket av assisterende kirurg sine fingre. Gjengitt med tillatelse fra Fredrikstad Dyrehospital.
Prognosen for hunder med hepatisk encefalopati og eleverte gallesyrer i serum er avhengig av den underliggende patologiske tilstanden. Pasienter med cPSS har i de fleste tilfeller en god prognose dersom kirurgisk korreksjon foretas, mens prognosen til pasienter med kronisk leversykdom, cirrhose og ervervet PSS er svært dårlig (51). Klinisk-kjemisk blodanalyse kan hjelpe til å differensiere pasienter med cPSS fra de med hypoplasi av v. porta, kronisk leversykdom og/eller ervervet PSS. Pasienter med endestadiums leversvikt presenterer gjerne med lave serumkonsentrasjoner av kolesterol, albumin, og glukose, mildt eleverte leverenzymer, trombocytopeni og ascites. De har gjerne PU/PD, har hatt vekttap og er avmagret (52). Disse funnene kan også være tilstede hos pasienter med cPSS, men er mindre vanlige og mindre uttalte. Bildediagnostikk av pasienter med hypoplasi av v. porta er gjerne upåfallende og disse hundene presenterer gjerne med normale eller lavere gallesyrer i serum enn pasienter med cPSS og uten hepatisk encefalopati (53). Prognosen for pasienter med hypoplasi av portalvenen er god sammenlignet med prognosen for pasienter med PSS som ikke korrigeres (53).
Border collien (kasuistikk 1) viste typiske symptomer og resultater av diagnostiske undersøkelser for en hund med PSS. Blodprøveresultatene ved diagnosetidspunktet var påvirket av pasientens hypovolemiske tilstand da både hematokrit og albumin i serum var betydelig høyere enn ved neste kontroll. Serum albumin, hematokrit og antall blodplater sank for denne pasienten umiddelbart postoperativt. Årsaken til dette er uklar, men plateforbruk grunnet plassering av coiler og noe prosedyrerelatert blødning kombinert med væsketerapi kan være en forklaring. Ved siste kontroll hadde antall blodplater normalisert seg, mens hemoglobinkonsentrasjonen fortsatt var noe lav sammenlignet med tre måneder tidligere. Unge hunder (border collien var syv måneder ved siste hematologiske kontroll) har imidlertid lavere hemoglobinkonsentrasjoner enn voksne hunder (54). Etter coilingen normaliserte også de biokjemiske parametrene seg. Albumin, urea og ALT i serum var alle innenfor referanseintervallet for normale hunder ved siste kontroll. Intrahepatiske shunter leder mer blod forbi levervevet, og er assosiert med flere og mer uttalte symptomer. Dette er i tråd med de beskrevne kasuistikkene, da pasienten med IHPSS (kasuistikk 1) viste mer uttalte symptomer enn pasienten med EHPSS (kasuistikk 2) (4).
Schillerstøveren (kasuistikk 2) ble diagnostisert i voksen alder og var atypisk på flere måter. Eneste symptom var PU/PD, og det var ingen hematologiske og kun milde biokjemiske avvik med unntak av de økte gallesyrene.
Begge kasus beskrevet i denne artikkelen fikk foretatt kirurgisk korreksjon av shunten, med henholdsvis PTCE for border collien (kasuistikk 1) og total ligering for schillerstøveren (kasuistikk 2). Det var kun mild forbigående ascites for pasienten som fikk utført PTCE, og ingen komplikasjoner for pasienten som fikk foretatt ligering. Begge pasientene bedret BCS fra 4/9 til 5/9 i den postoperative oppfølgingsperioden. Serumkonsentrasjonene av gallesyrer normaliserte seg for begge hundene 6 uker postoperativt, og allmenntilstanden var da normal.
Sammendrag
Portosystemiske shunt (PSS) forekommer sporadisk hos hund og diagnostiseres vanligst hos yngre individer (1). PSS er enten intrahepatisk (IHPSS) eller ekstrahepatisk (EHPSS). IHPSS er vanligere hos større hunder (1, 8). Anamnese, klinisk undersøkelse, blod- og urinanalyser gir gjerne en mistanke om tilstanden. CT-angiografi er en sikker måte å stille diagnosen på. Tilstanden kan behandles medisinsk eller kirurgisk. I de tilfeller det er mulig bør kirurgisk korreksjon utføres da dette har vist klart bedre resultater (33, 34, 36).
Det finnes mange kirurgiske behandlingsalternativer. IHPSS kan behandles med PTCE under fluoroskopisk veiledning. For EHPSS er det anbefalt å foreta komplett ligering hvis mulig (35, 40). Det kan brukes en kombinasjon av portalvenografi og måling av portalt trykk samt observasjon av bukorganer intraoperativt for å vurdere muligheten for dette. Hunder med tre intrahepatiske forgreninger av portalvenen og et post-ligerings portalvenetrykk som ikke øker med mer enn 10 cm H20 eller overstiger 20 cm H20 er gode kandidater for total okklusjon ved ligering (25).
Pasientene i denne studien opplevde få komplikasjoner og begge pasientene normaliserte sine klinisk-kjemiske parametre til siste kontroll. Noe lav hemoglobinkonsentrasjon vedvarte hos pasienten beskrevet i kasuistikk 1. Denne hematologiske prøven ble tatt åtte uker etter operasjonen og det er mulig at pasientens alder (syv måneder) ved prøvetidspunktet hadde betydning for resultatet (54). Begge pasientene hadde gått opp i vekt og viste normal BCS ved oppfølgingskonsultasjonene. Hundene har i dag, 39 måneder (kasuistikk 1) og 10 måneder (kasuistikk 2) etter operasjonene ingen symptomer, tilføres ingen medisiner eller spesialdiett og lever normale hundeliv.
Summary
Portosystemic shunts are sporadically diagnosed in dogs (1). Intrahepatic portosystemic shunts are more common in large breed dogs (1). Portosystemic shunts should be treated surgically if possible, as this has shown better long-term outcome (33, 34, 36). The two dogs treated surgically in this report (Dog 1 treated for a congenital intrahepatic portosystemic shunt with percutaneous transvenous coil embolization, (PTCE) and dog 2 treated with complete shunt ligation through a ventral midline celiotomy) had only minor complications (slight ascites for the dog who underwent PTCE). Both dogs recovered uneventfully after surgery, and post procedure haematological and biochemical parameters normalized within eight weeks. Both dogs improved their body condition score, and bile acid stimulation test were normal at six and eight weeks respectively. Both dogs are now, 39 months (dog 1) and 10 months (dog 2) after the surgical procedure, asymptomatic and not on a special diet or any medication.
Etterord
Vi vil gjerne rette en stor takk til våre kolleger Carsten Glindø, Aina Kristin Salt Myklebust Svanevik og Malin Simensen for hjelp med coiling, ligering, anestesi, overvåkning og post operativ oppfølging. En stor takk også til Martine Lund Ziener og Marte Jervan for hjelp med ultralydundersøkelser.
Referanser
Tobias KM, Rohrbach BW. Association of breed with the diagnosis of congenital portosystemic shunts in dogs: 2,400 cases (1980-2002). J Am Vet Med Assoc 2003; 223: 1636-9.
Black AM. The pathophysiology and laboratory diagnosis of congenital portosystemic shunts in dogs. N Z Vet J 1994; 42: 75.
Berent AC, Weisse C. Hepatic vascular anomalies. I: Ettinger SJ, Feldman EC, eds. Textbook of veterinary internal medicine: diseases of the dog and cat. 7th ed. St. Louis, Missouri: Saunders Elsevier, 2010: 1649-72.
Berent AC, Weisse CW. Portosystemic shunts and portal venous hypoplasia. Stand Care Emerg Crit Care Med 2007; 9.3: 1-11.
O’Leary CA, Parslow A, Malik R, Hunt GB, Hurford RI, Tisdall PL et al. The inheritance of extra-hepatic portosystemic shunts and elevated bile acid concentrations in Maltese dogs. J Small Anim Pract 2014; 55: 14-21.
Wolschrijn CF, Mahapokai W, Rothuizen J, Meyer HP, van Sluijs FJ. Gauged attenuation of congenital portosystemic shunts: results in 160 dogs and 15 cats. Vet Q 2000; 22: 94-8.
Howe LM, Boothe HW. Diagnosing and treating portosystemic shunts in dogs and cats. Vet Med 2002; 97: 448-59.
van Steenbeek FG, Leegwater PAJ, van Sluijs FJ, Heuven HCM, Rothuizen J. Evidence of inheritance of intrahepatic portosystemic shunts in Irish Wolfhounds.
J Vet Intern Med 2009; 23: 950-2.Broome CJ, Walsh VP, Braddock JA. Congenital portosystemic shunts in dogs and cats. N Z Vet J 2004; 52: 154-62.
Winkler JT, Bohling MW, Tillson DM, Wright JC, Ballagas AJ. Portosystemic shunts: diagnosis, prognosis, and treatment of 64 cases (1993-2001). J Am Anim Hosp Assoc 2003; 39: 169-85.
Culp WTN, Zwingenberger AL, Giuffrida MA, Wisner ER, Hunt GB, Steffey MA et al. Prospective evaluation of outcome of dogs with intrahepatic portosystemic shunts treated via percutaneous transvenous coil embolization. Vet Surg 2018; 47: 74-85.
Rothuizen J, van den Ingh TSGAM, Voorhoutm G, van der Luer RJT, Wouda W. Congenital porto-systemic shunts in sixteen dogs and three cats. J Small Anim Pract 1982; 23: 67-81.
Jalan R, Shawcross D, Davies N. The molecular pathogenesis of hepatic encephalopathy. Int J Biochem Cell Biol 2003; 35: 1175-81.
Holt DE, Washabau RJ, Djali S, Dayrell-Hart B, Drobatz KJ, Heyes MP et al. Cerebrospinal fluid glutamine, tryptophan, and tryptophan metabolite concentrations in dogs with portosystemic shunts. Am J Vet Res 2002; 63: 1167-71.
Simpson KW, Meyer DJ, Boswood A, White RN, Maskell IE. Iron status and erythrocyte volume in dogs with congenital portosystemic vascular anomalies. J Vet Intern Med 1997; 11: 14-9.
Martin RA, Lanz OI, Tobias KM. Liver and biliary system. I: Slatter DH, ed. Textbook of Small Animal Surgery. 3rd ed. Philadelphia: Saunders, 2003: 708-26.
Center SA, Magne ML. Historical, physical examination, and clinicopa-thologic features of portosystemic vascular anomalies in the dog and cat. Semin Vet Med Surg (Small Anim) 1990; 5: 83-93.
Center SA, ManWarren T, Slater MR, Wilentz E. Evaluation of twelve-hour preprandial and two-hour postprandial serum bile acids concentrations for diagnosis of hepatobiliary disease in dogs. J Am Vet Med Assoc 1991; 199: 217-26.
Tisdall PL, Hunt GB, Tsoukalas G, Malik R. Post-prandial serum bile acid concentrations and ammonia tolerance in Maltese dogs with and without hepatic vascular anomalies. Aust Vet J 1995; 72: 121-6.
Holt DE, Schelling CG, Saunders HM, Orsher RJ. Correlation of ultrasonographic findings with surgical, portographic, and necropsy findings in dogs and cats with portosystemic shunts: 63 cases (1987-1993). J Am Vet Med Assoc 1995; 207: 1190-3.
Tiemessen I, Rothuizen J, Voorhout G. Ultrasonography in the diagnosis of congenital portosystemic shunts in dogs. Vet Q 1995; 17: 50-3.
Lamb CR. Ultrasonographic diagnosis of congenital portosystemic shunts in dogs: results of a prospective study. Vet Radiol Ultrasound 1996; 37: 281-8.
Nelson NC, Nelson LL. Anatomy of extrahepatic portosystemic shunts in dogs as determined by computed tomography angiography. Vet Radiol Ultrasound 2011; 52: 498-506.
Morandi F. Liver scintigraphy in veterinary medicine. Semin Nucl Med 2014; 44: 15-23.
Kayanuma H, Koyama R, Kanai E. Feasibility of complete surgical ligation on 72 dogs with singular extrahepatic congenital portosystemic shunt based on portal pressure and comparison of intraoperative mesenteric portovenography. J Vet Med Sci 2019; 81: 361-4.
Bismuth M, Funakoshi N, Cadranel J-F, Blanc P. Hepatic encephalopathy: from pathophysiology to therapeutic management. Eur J Gastroenterol Hepatol 2011; 23: 8-22.
Statens legemiddelverk. Terapianbefaling: bruk av antibakterielle midler til hund og katt. Oslo 2014. https://legemiddelverket.no/Documents/Veterinærmedisin/Terapianbefalinger/Terapianbefaling_Antibakterielle midler hund og katt_2014_N.pdf (21.8.2019).
Webster CRL, Center SA, Cullen JM, Penninck DG, Richter KP, Twedt DC et al. ACVIM consensus statement on the diagnosis and treatment of chronic hepatitis in dogs. J Vet Intern Med 2019; 33: 1173-200.
Lidbury JA, Cook AK, Steiner JM. Hepatic encephalopathy in dogs and cats. J Vet Emerg Crit Care 2016; 26: 471-87.
Weisse C, Berent AC, Todd K, Solomon JA, Cope C. Endovascular evaluation and treatment of intrahepatic portosystemic shunts in dogs: 100 cases (2001-2011). J Am Vet Med Assoc 2014; 244: 78-94.
Marks SL, Kook PH, Papich MG, Tolbert MK, Willard MD. ACVIM consensus statement: Support for rational administration of gastrointestinal protectants to dogs and cats. J Vet Intern Med 2018; 32: 1823-40.
Butler LM, Fossum TW, Boothe HW. Surgical management of extrahepatic portosystemic shunts in the dog and cat. Semin Vet Med Surg (Small Anim) 1990; 5: 127-33.
Greenhalgh SN, Dunning MD, McKinley TJ, Goodfellow MR, Kelman KR, Freitag T et al. Comparison of survival after surgical or medical treatment in dogs with a congenital portosystemic shunt. J Am Vet Med Assoc 2010; 236: 1215-20.
Greenhalgh SN, Reeve JA, Johnstone T, Goodfellow MR, Dunning MD, O’Neill EJ et al. Long-term survival and quality of life in dogs with clinical signs associated with a congenital portosystemic shunt after surgical or medical treatment. J Am Vet Med Assoc 2014; 245: 527-33.
Tivers MS, Lipscomb VJ, Bristow P, Brockman DJ. Intrahepatic congenital portosystemic shunts in dogs: short- and long-term outcome of suture attenuation. J Small Anim Pract 2018; 59: 201-10.
Falls EL, Milovancev M, Hunt GB, Daniel L, Mehl ML, Schmiedt CW. Long-term outcome after surgical ameroid ring constrictor placement for treatment of single extrahepatic portosystemic shunts in dogs. Vet Surg 2013; 42: 951-7.
Case JB, Marvel SJ, Stiles MC, Maisenbacher HW, Toskich BB, Smeak DD et al. Outcomes of cellophane banding or percutaneous transvenous coil embolization of canine intrahepatic portosystemic shunts. Vet Surg 2018; 47(Suppl 1): O59-O66.
Lee KCL, Lipscomb VJ, Lamb CR, Gregory SP, Guitian J, Brockman DJ. Association of portovenographic findings with outcome in dogs receiving surgical treatment for single congenital portosystemic shunts: 45 cases (2000-2004). J Am Vet Med Assoc 2006; 229: 1122-9.
Kirby B. Portosystemic. I: Griffon DJ, Hamaide A, eds. Complications in small animal surgery. Ames, Iowa: Wiley Blackwell, 2016: 461-6.
Hunt GB, Hughes J. Outcomes after extrahepatic portosystemic shunt ligation in 49 dogs. Aust Vet J 1999; 77: 303-7.
White RN, Burton CA, McEvoy FJ. Surgical treatment of intrahepatic portosystemic shunts in 45 dogs. Vet Rec 1998; 142: 358-65.
Komtebedde J, Forsyth SF, Breznock EM, Koblik PD. Intrahepatic portosystemic venous anomaly in the dog. Perioperative management and complications. Vet Surg 1991; 20: 37-42.
Hardie EM, Kornegay JN, Cullen JM. Status epilepticus after ligation of portosystemic shunts. Vet Surg 1990; 19: 412-7.
Partington BP, Partington CR, Biller DS, Toshach K. Transvenous coil embolization for treatment of patent ductus venosus in a dog. J Am Vet Med Assoc 1993; 202: 281-4.
Léveillé R, Pibarot P, Soulez G, Wisner ER. Transvenous coil embolization of an extrahepatic portosystemic shunt in a dog: a naturally occurring model of portosystemic malformations in humans. Pediatr Radiol 2000; 30: 607-9.
Gonzalo-Orden JM, Altónaga JR, Costilla S, Gonzalo Cordero JM, Millán L, Recio AO. Transvenous coil embolization of an intrahepatic portosystemic shunt in a dog. Vet Radiol Ultrasound 2000; 41: 516-8.
Bussadori R, Bussadori C, Millán L, Costilla S, Rodríguez-Altónaga JA, Orden MA et al. Transvenous coil embolisation for the treatment of single congenital portosystemic shunts in six dogs. Vet J 2008; 176: 221-6.
Lee R, Leowijuk C. Normal parameters in abdominal radiology of the dog and cat. J Small Anim Pract 1982; 23: 251-69.
Agg EJ. Acquired extrahepatic portosystemic shunts in a young dog. Can Vet J 2006; 47: 697-9.
Buob S, Johnston AN, Webster CRL. Portal hypertension: pathophysiology, diagnosis, and treatment. J Vet Intern Med 2011; 25: 169-86.
Sevelius E. Diagnosis and prognosis of chronic hepatitis and cirrhosis in dogs. J Small Anim Pract 1995; 36: 521-8.
Elhiblu MA, Dua K, Mohindroo J, Mahajan SK, Sood NK, Dhaliwal PS. Clinico-hemato-biochemical profile of dogs with liver cirrhosis. Vet World 2015; 8: 487-91.doi:10.14202/vetworld.2015.487-491
Akiyoshi M, Hisasue M, Akiyoshi M. Clinicopathological findings and prognosis in canine cases diagnosed as primary hypoplasia of the portal vein. Front Vet Sci 2017; 4: 224.
Harper EJ, Hackett RM, Wilkinson J, Heaton PR. Age-related variations in hematologic and plasma biochemical test results in Beagles and Labrador Retrievers. J Am Vet Med Assoc 2003; 223: 1436-42.