Bruk av bakteriofagproduktet Custus®YRS til smittepresskontroll og sykdomsforebygging hos atlantisk laks
Håndtering av atlantisk laks som har subklinisk infeksjon med Yersinia ruckeri kan utløse sykdomsutbrudd med høy akutt dødelighet. Håndtering medfører økt utskillelse av bakterien til vann og medfører risiko for naiv fisk som håndteres i det samme vannet. Denne artikkelen beskriver hvordan bakteriofagproduktet Custus®YRS ble benyttet til å kontrollere smittepressutviklingen i brønnbåtvann under håndtering og derigjennom forebygget sykdomsutbrudd i fiskepopulasjoner med subklinisk yersiniose.
veterinær (1), forfatter har fylt ut ICMJE-skjemaet og oppgir ingen interessekonflikter.
molekylærbiolog, forskningsdirektør (2)
Forfatter har fylt ut ICMJE-skjemaet og oppgir følgende interessekonflikter: ACD Pharma har utviklet og selger bakteriofagproduktet Custus®YRS. Forfatter er ansatt og aksjeeier i selskapet.
molekylærbiolog, operasjonsleder FoU (2), Forfatter har fylt ut ICMJE-skjemaet og oppgir følgende interessekonflikter: Forfatter er ansatt i ACD Pharma.
Mikrobiolog, senioringeniør (2), forfatter har fylt ut ICMJE-skjemaet og oppgir følgende interessekonflikter: Forfatter er ansatt i ACD Pharma.
biomedisiner, forskningsingeniør (2), forfatter har fylt ut ICMJE-skjemaet og oppgir følgende interessekonflikter: Forfatter er ansatt i ACD Pharma.
veterinær, konsernleder fiskehelse og kvalitet (1), forfatter har fylt ut ICMJE-skjemaet og oppgir ingen interessekonflikter.
(1) SinkabergHansen AS, Marøya, 7900 Rørvik
(2) ACD Pharma, Storeidøya 60, 8370 Leknes
Introduksjon
I forbindelse med utsett av laksesmolt høsten 2021 (H21) på to lokaliteter (Lokalitet A og B) hos SinkabergHansen AS oppstod det høy dødelighet og redusert fiskevelferd hos flere fiskegrupper like etter utsett. Bakteriesykdommen yersiniose ble diagnostisert på bakgrunn av kliniske funn, bakteriologiske undersøkelser, histologiske undersøkelser og PCR. Diagnosen ble verifisert av Pharmaq Analytic AS og Veterinærinstituttet (VI).
Yersiniose er en bakteriell sykdom som forårsakes av virulente varianter av bakterien Yersinia ruckeri, og sykdommen er primært en utfordring i oppdrett av laksefisk. Yersiniose har tradisjonelt vært forbundet med sykdomsutbrudd i settefiskfasen, men har i de senere år også forårsaket omfattende dødelighet i hele sjøfasen av lakseoppdrett (1). Det er vist at bakterien kan opprette gi subklinisk yersiniose i laks i settefiskfasen som fortsetter gjennom sjøfasen. Stress, for eksempel gjennom håndtering, utløser en kraftig forøkt utskillelse av Y. ruckeri fra smittebærende fisk (2). Stress i kombinasjon med høyt smittepress er sannsynlige utløsende faktorer for yersinioseutbrudd i sjøfasen. Akutt dødelighet opptrer oftest 1-3 uker etter håndtering (smoltutsett, trenging, transport, lusebehandling) av subklinisk infisert fisk eller klinisk syk fisk. Akuttfasen varer vanligvis i 1-3 uker. Akkumulert dødelighet etter akuttfasen kan variere fra 1 % til over 30 %, hvoretter sykdommen enten dør ut eller fortsetter som en latent sykdomssituasjon (SinkabergHansen AS, upubliserte data). Sykdommen kjennetegnes også ved redusert fiskevelferd, appetitt og tilvekst.
Bakteriofager er virus som har spesialisert seg på å infisere bakterier. Denne spesialiseringen har pågått like lenge som bakterier har eksistert på jorden, om lag tre milliarder år. Den lange spesialiseringen har gjort bakteriofagene vertsspesifikke – de kan bare infisere et smalt spekter av bakterier, oftest innenfor samme bakterieart. Alle bakterier har spesifikke bakteriofager de blir infisert av. Noen bakteriofager dreper vertsbakterien som del av infeksjonssyklusen (3, 4). Slike bakteriofager kan benyttes til å bekjempe uønskede bakterier.
Bakterier og bakteriofager finnes alltid i de samme miljøene. De kan ha en stabil sameksistens så lenge både bakteriofag og vertsbakterie finnes i så lav konsentrasjon at hyppigheten av møter mellom dem er for lav til å påvirke bestanden av vertsbakteriene. Dette samspillet kan manipuleres i bakteriofagenes favør og bakterienes disfavør ved å dramatisk øke tettheten av bakteriofager som infiserer og dreper en bestemt uønsket bakterie.
I 1 L Custus®YRS er det 500 tusen milliarder (5x1014) bakteriofager som helt spesifikt infiserer og dreper Y. ruckeri serotype O1. Når produktet tilsettes i brønnbåtvann endres styrkeforholdet mellom Y. ruckeri og dens bakteriofager i vannets mikroflora på en slik måte at det spesifikke smittepresset av Y. ruckeri i vannet effektivt kontrolleres. Y. ruckeri lar seg infisere med CUSTUS-bakteriofagene både i ferskvann og i saltvann (ACD Pharma, upubliserte data).
I Bindalsfjorden praktiserer SinkabergHansen AS produksjon etter Bindalsmodellen, som går ut på at smolten de første åtte månedene i sjø står på lokaliteter med lav salinitet (Figur 1, lokalitet A og B) og dermed også lavt påslag av lakselus (Lepeophtheirus salmonis). Deretter flyttes fisken til mer eksponerte påvekstlokaliteter lenger ut i fjordsystemet (Figur 1, lokalitet C og D), hvor fisken står frem til slakt. Redusert påslag av lus ved lavsalinitetslokalitetene medfører redusert behov for avlusingstiltak både før og etter flytting mellom lokalitetstypene.
Figur 1 viser flyt av fisk fra settefiskanlegg, via de to lavsalinitetslokalitetene (A og B) til påvekstlokalitetene (C og D). Grunnet lavt påslag av lus på lavsalinitetslokalitetene, ble avlusing kun utført ved påvekstlokalitetene, og under transport 2, som ble gjennomført med lusemiddelet Ectosan® Vet (Benchmark® Animal Health) i transportvannet.
I denne artikkelen beskrives sykdomsutredningen av yersiniose etter utsettet i 2021 og viser den forebyggende effekten av å benytte Custus®YRS til smittepresskontroll i brønnbåtvann under transport og avlusing. Dette er så vidt vi kjenner til, første gang effektdata for bakteriofager som risikoreduserende tiltak mot yersinioseutbrudd etter flytting og avlusing blir publisert.
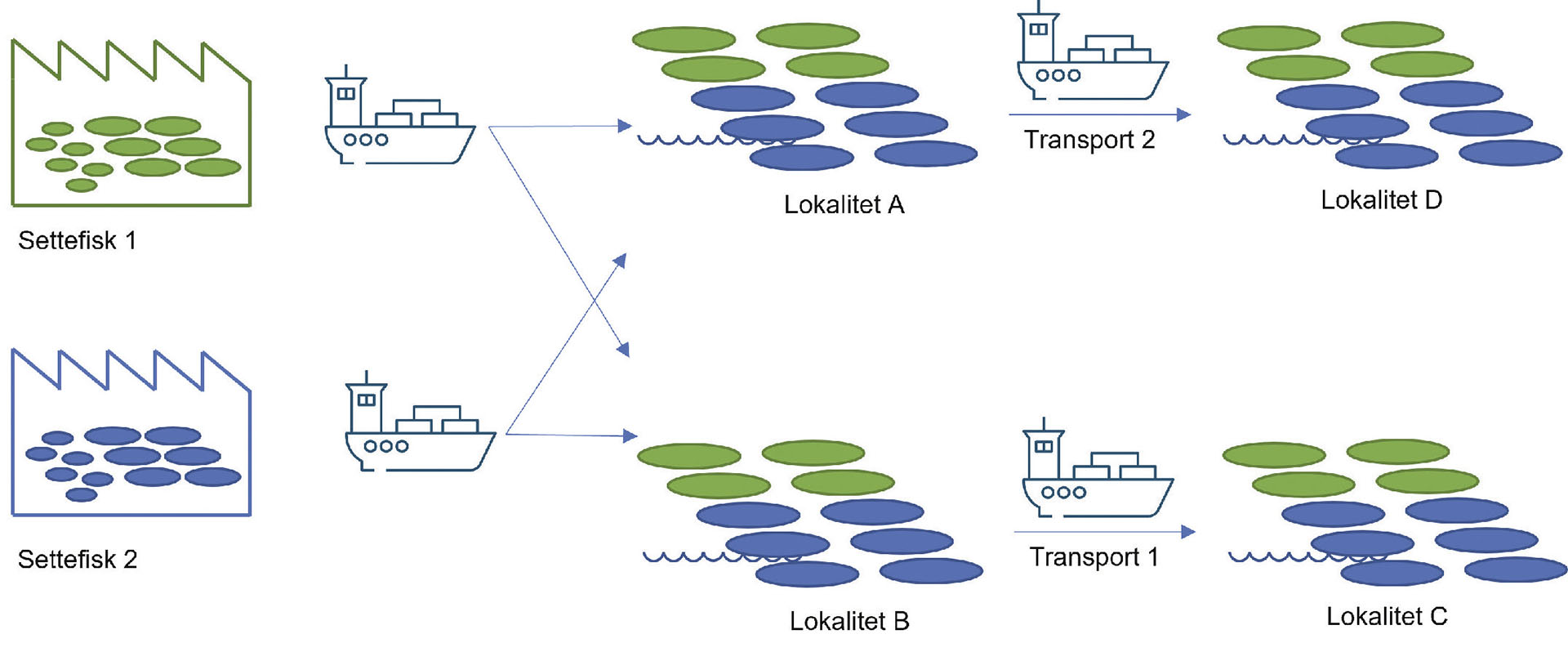
Figur 1: Oversikt over lokaliteter og prosessflyt i «Bindalsmodellen» høst 2021 til høst 2022. Fisk fra to settefiskanlegg («settefisk 1» og «settefisk 2») ble i juli 2021 overført til sjø på lokalitetene A og B som er lokaliteter med lav salinitet hvor fisken tilbringer de første 8 mnd. i sjø før de flyttes til tilvekstlokalitetene C og D hvor de står frem til slakt. Transport 1 ble gjennomført i januar 2022 og Transport 2 i mai 2022.
Materialer, metoder og resultater
Yersinioseutbruddene som oppstod like etter sjøutsettet i 2021 medførte omfattende sykdomsutredning, smittesporing og tilrettelegging av driften for å minimere sykdoms-belastningen på fisken. Fisken ble gitt så mye ro som mulig. Nødvendig transport i brønnbåt fra lokalitet B til C og A til D ble gjennomført med bakteriofagproduktet Custus®YRS i brønnbåtvannet for å hindre smittepresset av Yersinia ruckeri i å blomstre opp under håndteringen. Custus®YRS ble også benyttet under enkelte «Freshwell»-avlusinger på lokalitet C. I avsnittene under beskrives punktvis de ulike tiltakene og resultatene av disse.
Sykdomsutredning
Sykdomsutbruddene i de ulike merdene på lokalitet A og B hadde likt forløp. Utbruddene startet med forøket dødelighet og kliniske funn forenlig med bakteriell septikemi 1-3 uker etter utsett (Figur 2 og Tabell 1). Dyrking fra hodenyre på blodskål i romtemperatur i 1-2 døgn (Blodagar med 2 % NaCl, Pharmaq Analytic AS) ga fremvekst av typiske kolonier av Y. ruckeri (Figur 2). Yersinia ruckeri ble bekreftet med PCR (Pharmaq Analytic AS). Den forøkte dødeligheten varte fra 11 til 35 dager for enhetene på lokalitet A og B. De typiske patologiske forandringene kan beskrives som kraftige blødninger i øyne, blødninger rundt gattåpningen og tydelig rødbuk. I tillegg hadde en stor andel av fisken også punktblødninger over thymus. Blødninger i svømmeblære, bukhinne og lever var framtredende funn i tillegg til splenomegali. Disse funnene er forenlige med systemisk bakteriell infeksjon (septikemi). Funn ved histopatologisk vurdering støttet også mistanken om systemisk bakteriell infeksjon.
Median opptreden av yersiniose på merdnivå var 16 dager etter utsett med tidligste påvisning fem dager etter utsett og seneste påvisning 25 dager etter utsett på de to lokalitetene. Med opptreden menes Yersinia-relatert dødelighet. Klinikk og avvikende adferd kan ha oppstått i en periode før dødelighet ble oppdaget i de aktuelle enhetene. Utbruddene ble definert som over når dødeligheten var tilbake til normalutgang etter en periode med høy dødelighet. Varigheten av utbruddene hadde en medianverdi på 31 dager, med korteste varighet på 11 dager og lengste varighet på 35 dager. Den totale Yersinia-relaterte dødeligheten på de to lokalitetene ble 52 107 individer, noe som tilsvarer 5 % av fisken som ble satt ut i de aktuelle merdene.
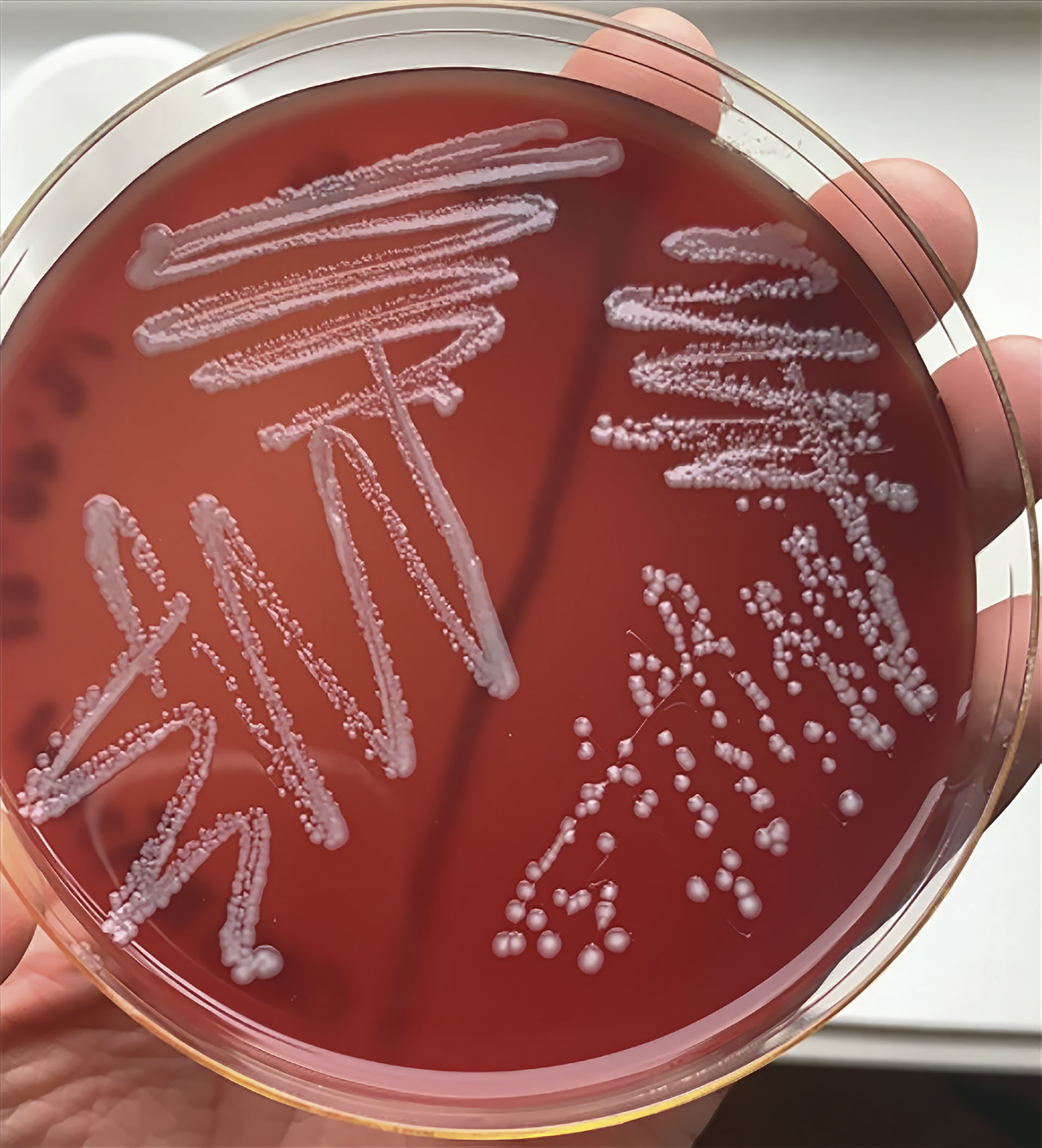
Figur 2: Typisk kolonivekst av Yersinia ruckeri på blodagar. Anhemolytiske grå kolonier med søtlig duft.
Smittesporing
Som et ledd i utbruddsoppklaringen ble det iverksatt et omfattende sporingsarbeid som blant annet innebar MLVA-typing (Multi-Locus Variable number of tandem repeat Analysis) hos Veterinærinstituttet for å se på slektskap mellom bakterieisolater (5) MLVA-profilene sammen med kliniske og epidemiologiske observasjoner indikerte at det forelå to smitteveier inn til de nevnte anleggene. Den ene smitteveien var med brønnbåt som smittevektor (Smittevei 1) og den andre var direkte smitte fra et settefiskanlegg (Smittevei 2).
Brønnbåten koblet til Smittevei 1 hadde kontakt med Yersinia-infisert fisk i et pågående sykdomsutbrudd, i forkant av transport av smolt fra Settefisk 1 til lokalitet A og B. Transporten fra Settefisk 1 til Bindalsfjorden var lang (>25 timer) og gikk store deler av strekningen med lukkede brønner.
Smittevei 2 omfattet direkte overføring av smittebærende fisk fra Settefisk 2 til lokalitet A og B. Det var før utsett ikke påvist yersiniose ved Settefisk 2, men senere uttak og sammenligning av Yersinia-isolater fra settefiskanlegget og sjølokalitetene viste at det dreide seg om den samme stammen av Y. ruckeri.
I tillegg til MLVA, ble et utvalg av isolatene fullgenomsekvensert (Illumina). Genomsekvensene viste 100 % identitet i kodede regioner, hvilket indikerer at de ulike MLVA-variantene sannsynligvis har samme opphav eller at det finnes en felles vektor i forkant av begge smitteveier (data ikke vist). Smittesporingsarbeidet er fremdeles pågående som del av et større arbeid med å identifisere smittekilder og vektorer, og forbedre biosikkerheten rundt fisken.
Lokalitet |
Lokalitetstype |
Merd / fiskegruppe |
Utbrudd (dager etter utsett) |
Varighet (dager) |
Dødelighet (%) |
|---|---|---|---|---|---|
A |
Lavsalinitet |
A1 |
6 |
31 |
15,30 |
A2 |
6 |
35 |
2,55 |
||
B |
Lavsalinitet |
B1 |
22 |
35 |
0,74 |
B2 |
5 |
31 |
5,13 |
||
B3 |
25 |
33 |
3,38 |
||
B4 |
16 |
11 |
3,61 |
||
B5 |
17 |
11 |
5,03 |
Smittepresskontroll med bakteriofager i brønnbåtvann under transport
Med bakgrunn i yersinioseutbrudd utløst av tidligere håndteringer og at Y. ruckeri danner (asymptomatisk) infeksjon i smittet fisk og at bakterien kan skilles ut i store mengder ved stress, ble bakteriofagproduktet Custus®YRS brukt som et risikoreduserende tiltak ved flere av brønnbåthåndteringene i sjøfasen.
I januar 2022 ble all fisk fra lokalitet B flyttet til lokalitet C, og i mai 2022 ble all fisk fra lokalitet A flyttet til D. Under begge transportene ble det benyttet Custus®YRS i alt transportvannet for å kontrollere smittepresset av Y. ruckeri.
Transport 1 (Figur 1) bestod av ni individuelle fisketransporter fra lokalitet B til lokalitet C. Den samme brønnbåten ble benyttet til alle transportene. Totalt ni fiskegrupper (merder) ble flyttet, én merd per tur. Til sammen utgjorde de ni gruppene 1,28 millioner individer med en snittvekt på 1294 gram (657 gram - 2205 gram). Transporttiden fra B til C var cirka seks timer, hvorav to timer ble utført med lukkede brønner for å hindre uttynning av bakteriofagene under transporten. Custus®YRS ble tilsatt direkte i brønnbåtvannet etter lukking av brønnene. Det ble benyttet 1 L produkt per 200 m3 vann, til en sluttkonsentrasjon av aktive Yersinia-bakteriofager på> 2 x 109 pfu/L (plakk-dannende enheter per liter). To timer holdetid med Custus®YRS ble valgt på bakgrunn av bakterio-fagenes generasjonstid, som er om lag 90 minutter. Først etter cirka 90 minutter vil bakteriofagreplikasjonen være fullført og de infiserte bakteriene ødelagt slik at eventuell smittereduksjon er målbar.
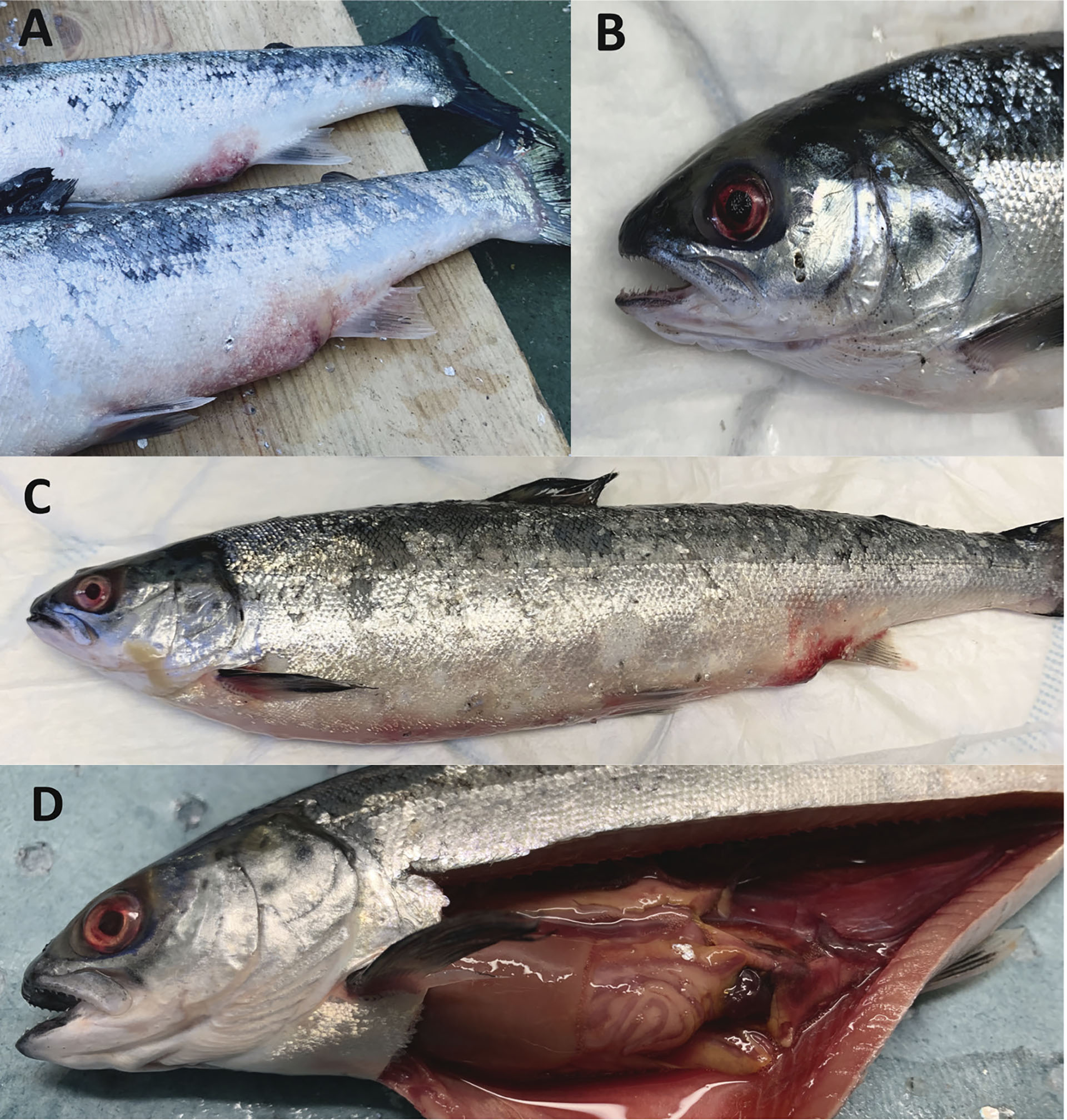
Figur 3: Bildene av fisk med bekreftet yersiniose hos SinkabergHansen AS. Bildene viser typiske patologiske forandringer ved yersiniose hos laks i sjøfasen av produksjonen. A: Tydelig risttap, erytematøs hud og blødninger i området rundt gattet B: «Blodøye» C: Postsmolt med blodøye, risttap, erytematøs hud i buken og blødninger rundt gattet. D: Septikemisk bilde med et hyperemisk preg i bukhulen, blek lever, væske i bukhulen, tom gastrointestinaltraktus og blødninger i fettvevet rundt blindsekkene.
Foto: SinkabergHansen AS.
Transport 2 (Figur 1) bestod av syv individuelle fisketransporter hvor én merd ble flyttet for hver tur. Hver transport varte cirka seks timer. De syv fiskegruppene som ble flyttet utgjorde til sammen 880 000 individer med en snittvekt på 2127 gram (1549 gram - 3099 gram). Under transport 2 ble lusemiddelet Ectosan® Vet. (Imidakloprid, 1000 mg/g; Benchmark Animal Health) benyttet i transportvannet i tillegg til Custus®YRS. Dette for å sikre lusefri fisk i dypvannsdriften på lokaliteten (Nautilus og Atlantis). Siden Ectosan® Vet. ble benyttet gikk hele transporten med lukkede brønner. Behandlingsvannet ble behandlet med CleanTreat™ før utslipp. Custus®YRS ble benyttet i transportvannet under hele transporttiden for hver tur.
Under begge transportene ble det for en av transportene tatt ut prøver av transportvannet før og etter tilsetting av Custus®YRS. Ved hvert prøvetidspunkt ble 100 mL fra hver av båtenes tre brønner overført til rene flasker, kjølt ned og samlet opp. Én dag senere ble bakteriefraksjonen i hver vannprøve høstet ved filtrering (membranfilter, 0,2 µm) og resuspendert i lysisbuffer før DNA ble isolert ved hjelp av QIAwave DNA Blood and Tissue Kit (Qiagen) utført i henhold til tilvirkers instruksjon. Smittepress (konsentrasjon) av Y. ruckeri i vannprøvene ble analysert ved hjelp av kvantitativ real-time PCR, med primere som spesifikt binder genet EntC hos Y. ruckeri, serotype O1 (SsoAdvanced Universal SYBR Green Supermix; Bio-Rad) utført i henhold til tilvirkers instruksjon (primere: fwd 5’-GGTGCAGATTACCTTAGTGC-ATTAC og rev 5’-GGTATTTTC-GATGGTGATTTT-GGGT). Hver av de tre brønnene ble behandlet som uavhengige paralleller i analysene. Resultat av smittepressmålingene er gitt i Figur 4.
I forbindelse med Transport 2, ble det gjennomført en interaksjonsstudie mellom imidakloprid (Merck, produktnummer 37894), aktivsubstansen i Ectosan® Vet og Yersinia-bakterio-fagene i Custus®YRS. Ingen endring i bakteriofagaktivitet ble funnet etter to timers eksponering med imidakloprid 20 mg/L ved 9 grader (data ikke vist). Doseverifisering for Ectosan® Vet utført av Benchmark Animal Health på vannprøver tatt ut etter endt behandlingstid for alle 7 transporter viste at alle prøvene var innenfor anbefalt dosering (20 mg/L ± 10 %) for Ectosan® Vet. Gjennomsnittlig målt konsentrasjon av Ectosan® Vet i prøvene var 19,32 ± 0,98 mg/L.
Til tross for betydelige yersinioseutfordringer før transportene (Tabell 1) ble det ikke observert Yersinia-relatert klinikk eller dødelighet i perioden etter flytting med Custus®YRS i transportvannet, verken på lokalitet C eller D.
Først 182 dager etter flytting til lokalitet C ble det igjen observert dødelighet relatert til yersiniose på denne fisken, etter andre gangs behandling mot lakselus. Dette oppstod 1,5-2 uker etter avlusing med «Freshwell» (6) sommeren 2022. Det ble ikke observert akutt dødelighet etter avlusingen, men tre grupper (merd C1, C2 og C3) viste først avvikende adferd med påfølgende eskalering til forøket dødelighet i to av merdene (C1 og C3). Sykdomsutbruddene i de to merdene varte henholdsvis 20 og 17 dager, med en samlet dødelighet på 5656 individer. Fisken i de tre affiserte merdene hadde da snittvekter fra 3,7 til 4,3 kg.
Det ble ikke observert utbrudd med yersiniose på lokalitet D etter flytting. Det ble observert enkeltfisk med klinikk forenlig med yersiniose, men bakterien ble ikke påvist på lokaliteten. Lokalitet D er ny type nedsenket driftsmodell (Atlantis og Nautilus; AkvaGroup ASA) som er forebyggende mot påslag av lakselus, og fiskegruppene på lokaliteten ble derfor ikke utsatt for håndteringsstress som følge av behandlinger mot lakselus.
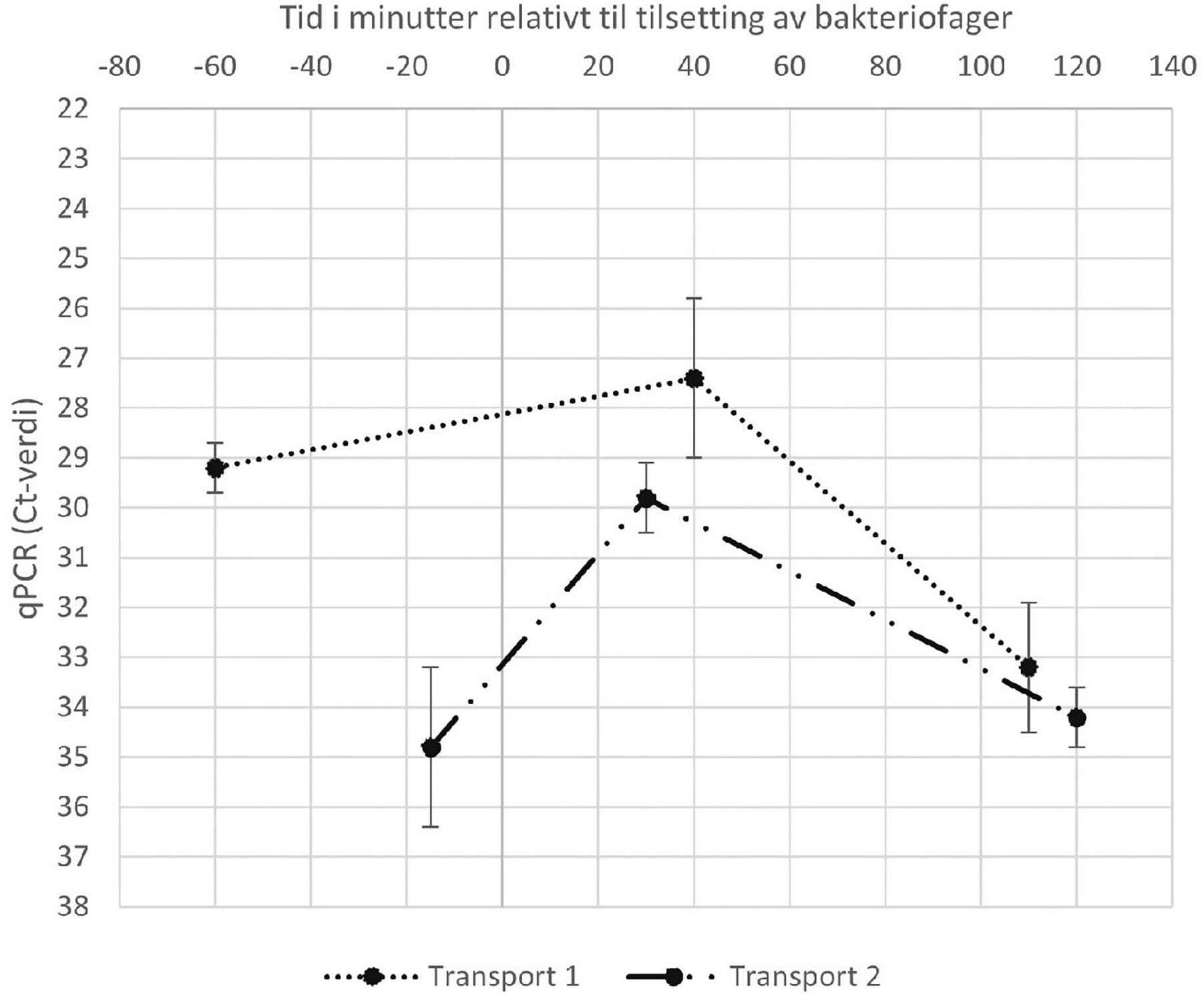
Figur 4: Smittepress av Yersinia ruckeri serotype O1 i brønnbåtkammere under transport av smittebærende fisk med Custus®YRS tilsatt i transportvannet. Bakteriofagene ble tilsatt ved T=0. Transport 1 ble gjennomført i januar 2022, fra lokalitet B til lokalitet C. Transport 2 ble gjennomført i mai 2022 fra lokalitet A til lokalitet D. Ct-verdiene som vises på Y-aksen er tilnærmet log2-transformerte verdier av konsentrasjonen av DNA fra Y. ruckeri i prøvematerialet. (En differanse på 2 Ct-verdier mellom to prøver betyr at det var 4 ganger mer templat-DNA i prøven med lavest Ct-verdi enn i prøven som ga høyest Ct-verdi.)
Smittepresskontroll med bakteriofager i brønnbåt under avlusing med «Freshwell»
Sensommeren 2022 ble det på nytt behov for behandling mot lakselus på lokalitet C. Dødeligheten i de to merdene (C1 og C3) hadde stabilisert seg på et lavt nivå, men det var grunn til å forvente at håndteringsstress på nytt skulle utløse yersinioseutbrudd. Det er ikke kjent om det er håndteringsstress alene, smittepress alene eller de to faktorene i kombinasjon som utløser utbrudd. For å evaluere dette og samtidig bygge erfaring på hvorvidt bruk av bakteriofager kan redusere risiko for yersiniosedødelighet etter avlusing i brønnbåt, ble Custus®YRS benyttet under avlusing av merd C1, mens merd C3 ble avluset uten bakteriofager i vannet.
Merd C2 som også hadde påvisning av Y. ruckeri ble på dette tidspunktet ikke behandlet mot lakselus da fiskegruppen skulle slaktes ut. De øvrige merdene på lokaliteten ble ikke tatt med i forsøket da de ikke hadde vist tegn til dødelighet forårsaket av yersiniose etter flytting fra lokalitet B til C.
«Freshwell» -avlusingen ble gjennomført i en brønnbåt med tre like store brønner med samlet volum 3200 m3. For å holde fisketettheten lav under avlusing, ble hver merd behandlet i to laster, med gjenbruk av ferskvannet mellom hver last. Under avlusingen av merd C3, ble det tilsatt 5,4 L Custus®YRS per brønn like etter lasting av første last og etterdosert 2,7 L Custus®YRS per brønn etter andre last. For øvrig ble avlusingen gjennomført likt som for merd C1 og de øvrige 5 merdene på lokaliteten som ble avluset i samme periode uten Custus®YRS. Holdetid i ferskvann var to timer for hver last i henhold til standard prosedyre for «Freshwell».
Figur 5 viser daglig dødelighet i gruppene C1 (kontroll uten Custus®YRS) og C3 (avluset med Custus®YRS i ferskvannet), samt i de øvrige 5 merdene som ble holdt utenfor forsøket grunnet god helsestatus og ingen mistanke om pågående yersiniainfeksjon. Alle merdene viste normal dødelighet relatert til håndteringen de første 3-4 dagene etter avlusing. Kun den ubehandlede kontrollmerden, C1, viste betydelig dødelighet forenlig med et yersinioseutbrudd i perioden 6-21 dager etter avlusing (Figur 5).
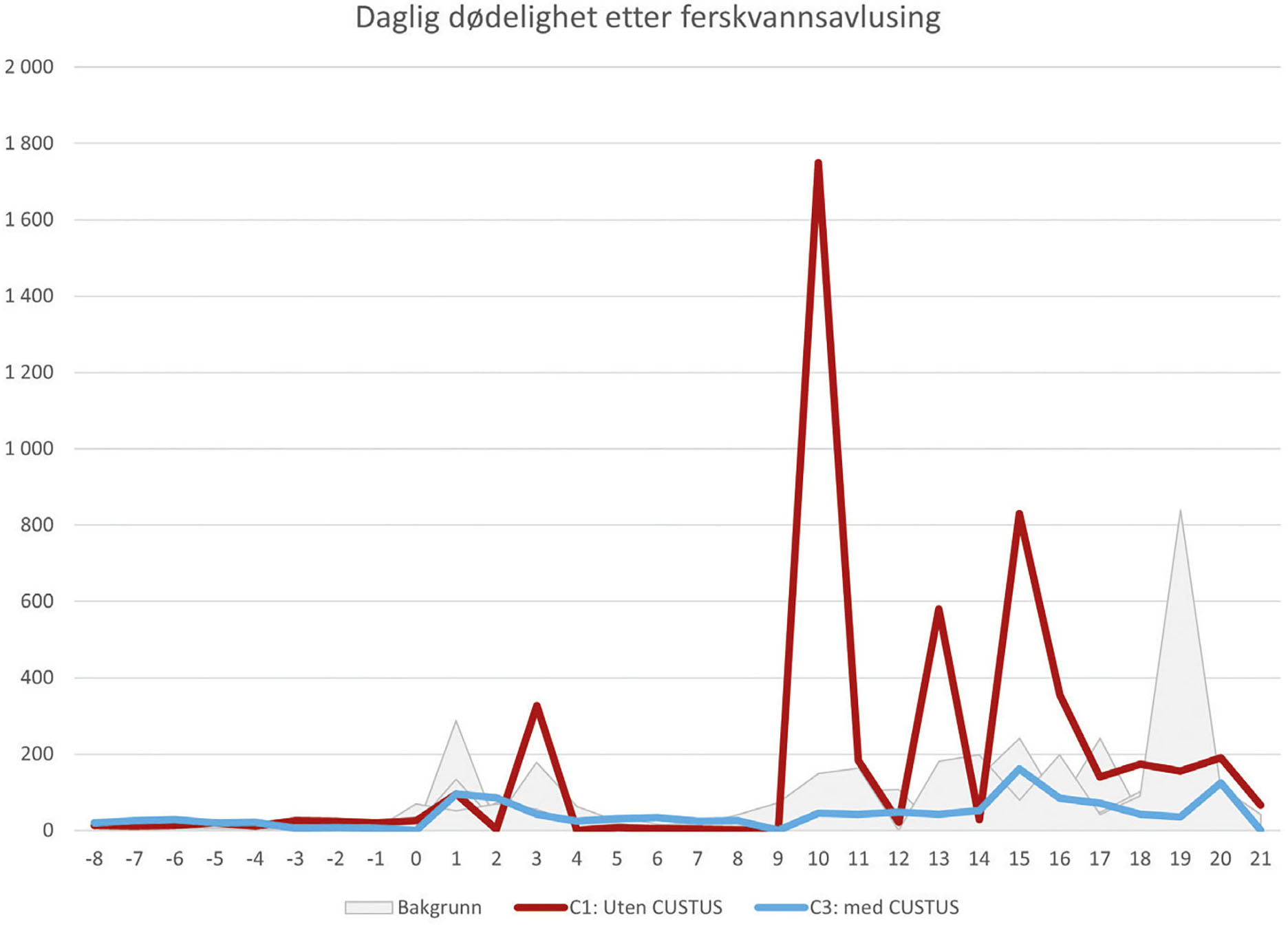
Figur 5: Daglig dødelighet per merd i perioden 8 dager før og 21 dager etter ferskvannsavlusing («Freshwell»). To merder med forutgående yersinioseutfordringer (C1 og C3) ble avluset uten (C1; rød linje) og med (C3; blå linje) Custus®YRS som smittepresskontrollerende tiltak i behandlingsvannet. Grå arealdiagram viser daglig dødelighet i 5 andre merder på samme lokalitet uten forutgående yersinioseutfordringer og som ble avluset på samme tid uten bruk av Custus®YRS. X-aksen viser tid i dager før og etter avlusing gjennomført ved T=0. Akkumulert dødelighet i perioden 6-21 dager etter avlusing var 4482 individer i gruppe C1, 833 individer i gruppe C3 og i gjennomsnitt 969 individer i merdene som tidligere ikke hadde hatt yersiniosedødelighet (laveste 247, høyeste 2225).
Diskusjon
Etter utsett på to lokaliteter i Bindalsfjorden opplevde Sinkaberg-Hansen AS sine første utbrudd av systemisk yersiniose hos postsmolt i sjø. Det kliniske bildet sett i sammenheng med obduksjonsfunn og histologisk vurdering av vevssnitt ga mistanke om systemisk bakteriell sykdom. Bakteriedyrking fra hodenyre på blodagar ga fremvekst av typiske Y. ruckeri-lignende kolonier. Diagnosen ble verifisert med PCR av Pharmaq Analytiq AS og Veterinærinstituttet. Ingen andre sykdommer ble diagnostisert under denne sykdomsutredningen.
Fisken som fikk påvisning av yersiniose på lokalitet A og B kom fra to forskjellige settefiskanlegg med stor geografisk avstand. Resultat av MLVA-typing av bakterieisolater fra de ulike fiskegruppene, samt forskjeller i sykdomsforløp mellom fisk fra Settefisk 1 og Settefisk 2, indikerte at det forelå to smitteveier inn til lokalitet A og B. «Smittevei 2» var direkte overføring av smittebærende fisk fra settefiskanlegg til sjølokalitet. Dette stemmer med tidligere funn om subklinisk infeksjon av Y. ruckeri i laks og overføring fra settefisk til sjølokaliteter (2).
Brønnbåten koblet til «Smittevei 1» hadde kontakt med Yersinia-syk fisk i forkant av transport av smolt fra Settefisk 1 til lokalitetene A og B. Det er vist at Y. ruckeri er sensitiv for kommersielt tilgjengelige desinfeksjonsmidler, selv når den vokser som biofilm (7) , og det ble ikke avdekket svikt i vaske- og desinfeksjonsrutinene til brønnbåten. Smolttransporten fra Settefisk 1 hvor smittepåslaget mistenkes å ha hendt, var lang (>25 timer) og gikk deler av strekningen med lukkede brønner. Under slike betingelser er det mulig at en oppformering av Y. ruckeri kan ha funnet sted fra en i utgangspunktet lav kontaminering fra tidligere transport. Den indirekte overføringen via brønnbåt er ikke bekreftet, og smittesporingsarbeidet rundt driften i Bindalsfjorden er fremdeles pågående. Resultatene så langt understreker viktigheten av kontinuerlig fokus på hygiene og biosikkerhet gjennom hele produksjonskjeden fra rogn til slakt. Steder og situasjoner som gir Y. ruckeri og andre patogener mulighet til å oppformeres må i større grad hensyntas i sporingsarbeid og påfølgende hygiene- og biosikkerhetsplaner.
Flytting av fisk fra lavsalinitetslokalitetene (A og B) til påvekstlokalitetene (C og D) i henhold til Bindalsmodellen var operasjoner hvor trenging, stress og opphold av smittebærende fisk ble identifisert som sannsynlige årsaker til anrikning av Yersinia ruckeri i lukket brønn, med stor fare for smittespredning innad i og mellom fiskegruppene. Gitt tidligere yersinioseutbrudd utløst av håndtering var det også stor risiko for at flytteoperasjonene skulle utløse nye akutte yersinioseutbrudd. For å redusere denne risikoen ble bakteriofager som spesifikt infiserer og dreper Y. ruckeri (Custus®YRS) benyttet i transportvannet. Måling av bakteriekonsentrasjon i vannprøver tatt ut under transporten viste at bakteriofagene effektivt forhindret oppformering av Y. ruckeri i vannet. Smittepressmålingene viste at Yersinia-konsentrasjonen i vannet fortsatte å stige den første tiden etter tilsetting av bakteriofager før bakteriekonsentrasjonen falt. Dette stemmer overens med at redusert smittepress først er mulig å måle når bakteriofagene har fått tid til å gjennomføre sin første replikasjonssyklus (cirka 90 minutter) og bakteriene blir ødelagt.
Det ble vist at Custus®YRS kan benyttes sammen med Ectosan® Vet. Dette er et viktig funn siden bruk av Ectosan® Vet krever lukkede brønner og dermed større risiko for at høye bakteriekonsentrasjoner oppnås i vannet under prosedyren.
De forventede yersinioseutbruddene etter transportene uteble. Først etter gjentatte avlusinger i brønnbåt ble det igjen observert akutt yersiniose-dødelighet i to merder på lokalitet C (C1 og C3). En viktig medvirkende årsak til at yersiniose ikke ble observert på lokalitet D var trolig at denne opereres i nedsenkbare merder med redusert behov for avlusing og håndteringsstress frem til slakt.
Utvikling av klinisk yersiniose i to enheter på lokalitet C (C1 og C3) i etterkant av behandlinger mot lakselus viser at bakterien kan ligge latent hos fisken i lang tid og utløse sykdomsutbrudd etter håndtering som medfører stress og forhøyet smittepress.
For å evaluere effekten av Custus®YRS som risikoreduserende tiltak under avlusing med ferskvann i brønnbåt («Freshwell»), ble de to merdene med tidligere yersiniose-utfordringer avluset med (C3) og uten (C1) bakteriofager i avlusingsvannet. En betydelig forskjell mellom de to fiskegruppene ble observert. I enheten som ble avluset uten Custus®YRS i avlusingsvannet ble det påvist et typisk akutt yersinioseutbrudd etter håndteringen, mens dette ikke ble påvist i enheten som ble avluset med Custus®YRS.
Konklusjon
Behandlingene og forsøkene gjennomført med bruk av Custus®YRS viser at bakteriofager kan brukes til å redusere smittepress i vann og derigjennom forebygge sykdomsutvikling ved kjente subkliniske bakterieinfeksjoner i en fiskepopulasjon.
Utbruddene hos SinkabergHansen AS viser både bakteriens potensial til å forårsake alvorlige sykdomsutbrudd i sjøanlegg og til å etablere smitte som er vanskelig å bli kvitt når smitten først har blitt etablert i et produksjonsmiljø. Arbeidet som presenteres her viser at bakteriofager kan benyttes til effektiv smittepresskontroll og som verktøy for å håndtere en slik vanskelig smittesituasjon.
Etterskrift
Takk til Benchmark Animal Health for deling av analysedata for Ectosan® Vet.
Sammendrag
To sjølokaliteter hos SinkabergHansen AS fikk påvist bakteriesykdommen yersiniose etter at det oppstod høy dødelighet og redusert fiskevelferd hos flere fiskegrupper like etter utsett av laksesmolt høsten 2021. Det ble lagt en omfattende plan for håndtering av sykdomssituasjonen til beste for fisken. Planen omfattet blant annet bruk av bakteriofagproduktet Custus®YRS for å kontrollere smittepress av Yersinia-bakteriene under transport og avlusing, håndteringssituasjoner som er kjente utløsende faktorer for yersinioseutbrudd. Gjennom analyser av vannprøver tatt fra brønnbåt under lukket håndtering (transport og avlusing) ble det vist at bakteriofagene effektivt reduserte smittepresset av Y. ruckeri i vannet. Etter transporten ble det heller ikke observert tegn på yersiniose eller yersiniose-relatert dødelighet i noen av fiskegruppene. Det ble også gjennomført et forsøk hvor effekten av bakteriofagene på dødelighet etter en ferskvannsavlusing ble sammenlignet med dødelighet etter avlusing uten bruk av Custus®YRS. Det ble her registrert betydelige forskjeller i dødelighet etter behandlingen mellom bakteriofag-behandlet fiskegruppe og ikke behandlet fiskegruppe.
Behandlingene og forsøkene vi har gjennomført med bruk av Custus®YRS viser at bakteriofager kan brukes for å redusere smittepress og derigjennom forebygge sykdom ved kjente bakterieinfeksjoner i en fiskepopulasjon.
Summary
Use of the bacteriophage product Custus®YRS for control of infection pressure and disease prevention in Atlantic salmon.
After incidents of yersiniosis-induced mortality and reduced fish welfare shortly after sea transfer of Atlantic salmon at two Sinkaberg-Hansen locations, the bacteriophage product Custus®YRS was included in an extensive plan for disease control. Custus®YRS was used to control the infection pressure of Yersinia ruckeriin well boat water during transport and freshwater de-licing, operations known to trigger yersiniosis outbreaks. Water sample analyses showed that the bacteriophages efficiently controlled the infection pressure of Y. ruckeriduring the operations. No yersiniosis related mortality was observed after the operations. A comparison study was performed, in which two fish groups, both sub-clinical carriers of Yersinia ruckeri,were de-liced with the freshwater treatment “Freshwell”, one group with Custus®YRS and the other without. The one group de-liced without Custus®YRS experienced a typical yersiniosis outbreak. The group de-liced with Custus®YRS-bacteriophages present in the well boat water had no signs of yersiniosis outbreak and performed similar to no-yersiniosis reference groups at the same location.
This study show that bacterio-phages can be used to control bacterial infection pressure in fish holding water, and through it prevent triggering of disease outbreaks.
Referanser
Sommerset I, Walde C S, Bang Jensen B, Wiik-Nielsen J, Bornø G, Oliveira VHS et al. Fiskehelserapporten 2021. Oslo: Veterinærinstituttet, 2022. (Veterinærinstituttets rapportserie nr. 2a/2022). https://www.vetinst.no/rapporter-og-publikasjoner/rapporter/2022/fiskehelserapporten-2021 (26.02.2023)
Strand D, Rønneseth A, Riborg AE, Gulla S, Mohammad SN, Wiik-Nielsen J et al. Miljø-DNA sporing av Yersinia ruckeri hos norsk oppdrettslaks. Nor Fiskeoppdr 2021;46:100-4.
Dion MB, Oechslin F, Moineau S. Phage diversity, genomics and phylogeny. Nat Rev Microbiol 2020;18:125-38.
Brives C, Pourraz J. Phage therapy as a potential solution in the fight against AMR: obstacles and possible futures. Palgrave Commun 2020;6:100.
Gulla S, Mohammad SN, Colquhoun DJ. Multi-locus variable-number tandem-repeat analysis of the fish-pathogenic bacterium Yersinia ruckeri by multiplex PCR and capillary electrophoresis. J Vis Exp 2019;148: e59455. https://www.jove.com/video/59455 (26.02.2023)
Jensen IR, Westgård AM, Mork A, Gillund B. Effekt og fiskevelferd ved avlusing med ”Freshwell”. Nor Vet Tidsskr 2022;134: 306-10.
Gulla S, Wiik-Nielsen J, Colquhoun DJ. Yersiniose i norsk lakseoppdrett: kunnskaps-status. Nor Fiskeoppdr 2018;43:50-3.