De tre vanligste hudsvulstene hos hest
Hudsvulster utgjør over halvparten av alle neoplasier hos hest, og kan gi store utfordringer både for eier og for behandlende veterinær, i tillegg til å forårsake åpenbar dyrevelferdsmessig lidelse. Slik som for mange andre sykdommer ligger nøkkelen til god respons på behandling og liten risiko for residiv i tidlig diagnostikk og behandling med evidensbaserte metoder. I denne artikkelserien gis en oversikt over etiologi og patogenese, diagnostikk og behandling av de tre vanligste hudsvulstene hos hest: melanom, ekvint sarkoid og plateepitelkarsinom.
Professor i hestekirurgi, DECVS, DECVSMR, Dyresykehuset - Hest
NMBU Veterinærhøgskolen
Innledning
Mens neoplasier generelt er forholdsvis uvanlig hos hest, er hudsvulster derimot relativt vanlig forekommende og utgjør langt over halvparten av alle neoplasier hos denne arten. De tre vanligste svulsttypene; melanomer, ekvint sarkoid og plateepitelkarsinomer har vært kjent i århundrer, men det er først i de senere år at årsakssammenhenger har blitt kartlagt mer i detalj. Tilsvarende har man opp gjennom tiden forsøkt ulike former for behandling, men ofte med dårlig resultater grunnet høye residivrater. I denne artikkelserien presenteres etiologi og patogenese, diagnostikk og evidensbasert behandling etter dagens kunnskapsnivå. Del 1 omhandlet melanom (‘the Good’?) og del 2 tok for seg ekvint sarkoid (‘the Bad’). Denne siste delen (Del 3) beskriver plateepitelkarsinomer (‘the ’Ugly’).
Del 3. ‘The Ugly’ – Plateepitelkarsinom
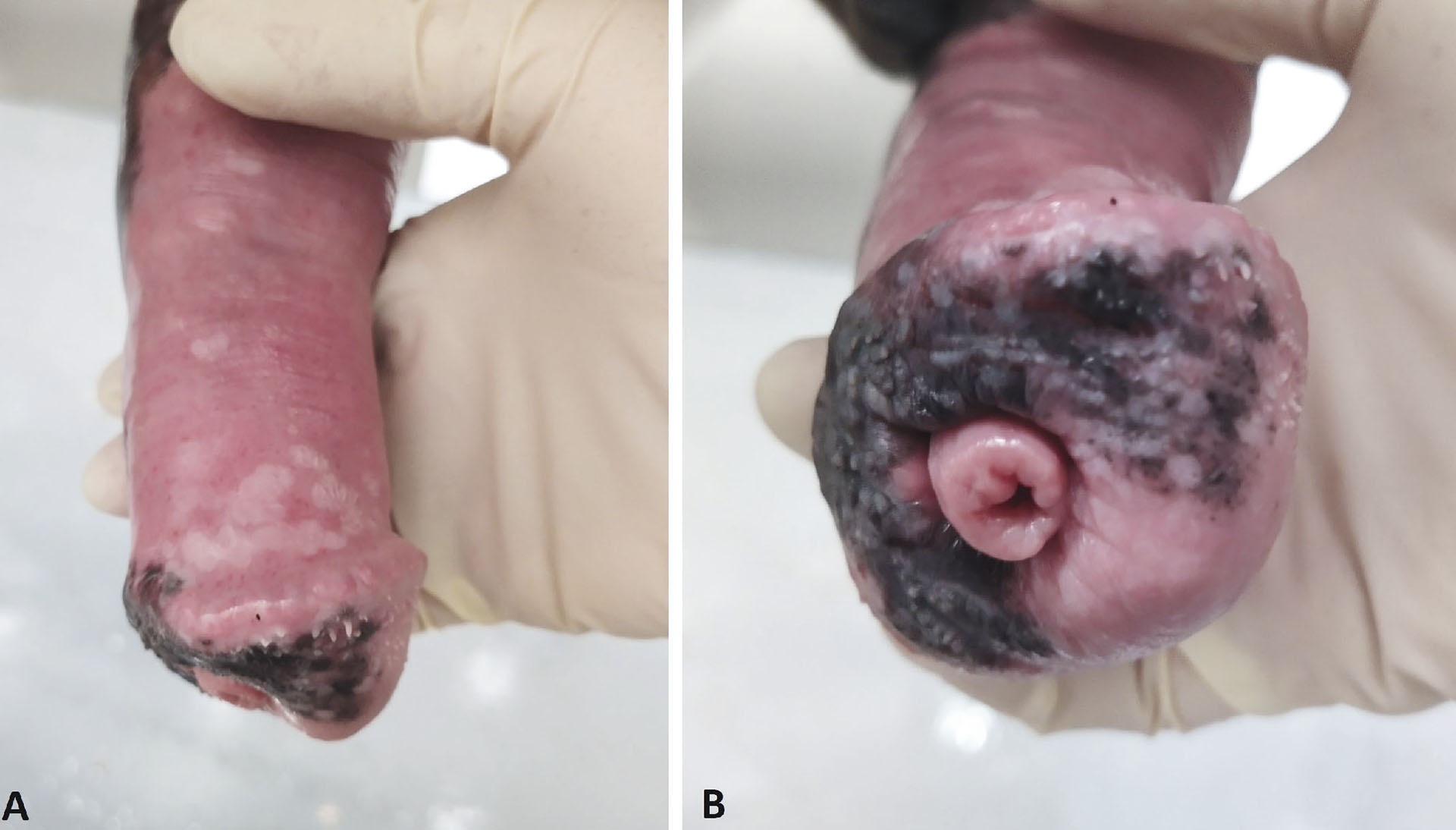
Figur 1. En 7 år gammel islandshest, vallak, presenterte for veterinær grunnet illeluktende smegma og hudforandringer på penis. Ved undersøkelse sees multiple upigmenterte flate plakk, så vidt hevet over omkringliggende hud, i stor utbredelse på skaftet (A), samt langs randen av caput, og på deler av caput (B). Disse forandringene er karakteristiske for prekankrøse papillomer, hvilket ble bekreftet med biopsi. Topikal behandling hver 14. dag med 5-FU krem ble anbefalt. Lesjonene utartet imidlertid hurtig over de neste 4 ukene, slik at partiell fallektomi ble anbefalt. Hesten har ikke vist residiv etter dette. Foto: Veterinærhøgskolen Dyresykehuset – hest
Plateepitelkarsinom er den tredje vanligste hudsvulsten hos hest. Denne svulsttypen oppstår i keratinocytter i hud eller slimhinner og kan følgelig forekomme hvor som helst på kroppen, men har predileksjon for upigmentert hud og mukokutane overganger, spesielt i og rundt øyet og ytre kjønnsorgan (1). Det er imidlertid distinkte forskjeller i etiologi og risikofaktorer mellom okulære og genitale plateepitelkarsinomer. Som for ekvint sarkoid er plateepitelkarsinom på ytre kjønnsorgan forbundet med en virusetiologi og Equus caballus papillomavirus type 2 (EcPV2) er identifisert som kausalt agens (2). Neoplasiene utvikles som regel fra forstadielesjoner som kan være papillomer, plakker eller in situ karsinomer, også disse lesjonene forårsakes av EcPV2 (3).
Okulære plateepitelkarsinomer forårsakes imidlertid av UV-skader eller andre irritasjoner og en genetisk mutasjon som resulterer i et defekt reparasjonsprotein som reparerer DNA etter UV-skade disponerer for lidelsen (4). I det følgende omtales dermed disse svulsttypene separat.
EcPV2 assosiert plateepitelkarsinom
Etiologi og patogenese
EcPV2 er et onkogent virus med en aktiv patogen rolle for genitalt plateepitelkarsinom hos hest (3). EcPV2 DNA er funnet i opptil 100 % av genitale plateepitelkarsinomer og deres forstadier, samt i smegma fra affiserte hester. Viruset finnes imidlertid i svært liten grad i hud fra ytre kjønnsorgan eller smegma fra friske hester, og heller ikke i okulære plateepitelkarsinomer (2). Funn av EcPV2 i balanopostittlesjoner indikerer at en lokal inflammasjonsprosess, der individet forsøker å kvitte seg med infeksjonen via cellemediert immunitet, kan representere et prekankrøst stadium (5,6). Likeledes regnes vorter på ytre kjønnsorgan forårsaket av EcPV2 som prekankrøse forstadier til genitale plateepitelkarsinomer (7). Det er imidlertid også holdepunkter for at en viss andel av unge, friske hester klarer å kvitte seg med viruset og bli immunkompetente for EcPV2.
Det er fortsatt uklart hvordan EcPV2 overføres mellom hester, men funn av EcPV2 hos friske hester oppstallet sammen med hester affisert med genitale plateepitelkarsinomer indikerer en horisontal smittevei via insekter, redskaper eller mennesker (3). Smegma fra affiserte hester inneholder store mengder virus og representerer dermed et betydelig smittereservoar (2). Den patogene rollen til EcPV2 illustreres ytterligere av at regelmessig forhudsvask er vist å kunne hindre progresjon av forstadielesjoner til maligne plateepitelkarsinomer (8). EcPV2 har imidlertid også blitt funnet i aborterte fostre og neonatale føll, slik at en vertikal smittevei også er mulig (9). Det er også distinkte geografiske forskjeller i EcPV2 varianter. Én spesifikk variant er funnet hos islandshester importert fra Island (2) og antas å være et resultat av at hestepopulasjonen på Island har vært isolert i over 800 år.
Det er også uvisst hvor lang inkubasjonstiden er fra hesten først smittes, til tumor oppstår. Som nevnt gir funn av en spesifikk EcPV2 variant hos islandshester importert fra Island mange år før klinisk tumorutvikling en god indikasjon på en svært langvarig latensfase (2) hvilket samsvarer med at diagnosen hovedsakelig stilles hos eldre dyr (1). Det er uklart hvilke faktorer som trigger overgangen fra en latent infeksjon til viralt indusert karsinogenese, men endringer i hestens allmennstatus og immunforsvar kan være årsaker som spiller inn (2).
Andre varianter av EcPV er funnet i enkelte orofaryngeale plateepitelkarsinomer (2), samt i en andel av plateepitelkarsinomer i magesekken (10), og i aurale plakker (EcPV3-7) (11). Lesjoner i magesekken regnes som den farligste formen for plateepitelkarsinom på grunn av sitt høye metastatiske potensiale. Aurale plakker er i den andre enden av skalaen og behandles sjeldent da de regnes for kun å ha kosmetisk betydning. Aurale plakker kan imidlertid smitte fra hest til hest, trolig via insektsvektorer, og kan en sjelden gang transformere til plateepitelkarsinomer. Residiv sees ofte etter kirurgisk eksisjon (11), men topikal behandling med imiquimod kan være kurativt (12).
Kliniske funn og diagnostikk
Genitale plateepitelkarsinomer ses som solitære eller multiple lesjoner, vanligst forekommende på penis og preputium hos middelaldrende til eldre vallaker (13,14). Denne svulsttypen er langt sjeldnere hos hopper, men kan affisere både vulva og perineum og ofte med et mer aggressivt forløp enn hos hanndyr. Hos hanndyr er glans penis involvert i majoriteten av tilfellene, og metastaser til inguinale lymfeknuter er rapportert i 13-17 % (1,13). Som for HPV-induserte kreftformer hos menneske, ses forstadier til disse svulstene i form av hvitaktige plakk hovedsakelig lokalisert til penis og preputium (15). Depigmenterte plakker, ujevnheter på hudoverflaten og ikke-helende erosjoner med eller uten granulasjonsvev er alle tegn på papillomatøse forstadier eller tidlige plateepitelkarsinomer (Figur 1). I mer uttalte tilfeller fremstår tumoren som en mer solid masse, ofte med et blomkållignende utseende (‘The Ugly’; Figur 2) med ulcererte og nekrotiske områder. Svulsten(e) kan gi problemer ved urinering og parring og hindre normal utskafting og retraksjon av penis inn i forhuden (14). Kliniske tegn sees også relatert til sekundær infeksjon og inflammasjon, med lokal irritasjon og produksjon av et illeluktende eksudat. Imidlertid kan lesjoner forbli uoppdaget av eiere over lengre tid slik at tumorutvikling ofte er langt fremskredet når hesten diagnostiseres (13).
Diagnostikk avhenger av en god klinisk undersøkelse med visuell inspeksjon og palpasjon av eksterne genitalier. Dette gjøres som regel under sedasjon, men bilateral nerveblokk av n. pudendus kan være nødvendig. Svulsten(e) vurderes med tanke på størrelse, lokalisasjon, mobilitet i forhold til underlaget, invasivitet og hvorvidt urethra og/eller svamplegemet er involvert – sistnevnte kan resultere i en fast fortykkelse av hele eller deler av penis og er en negativ prognostisk indikator siden invasjon av svamplegemet ofte er forbundet med metastaser og residiv (13). Lokal invasivitet evalueres best ved hjelp av ultralyd (14). Involvering av tunica albuginea er en negativ prognostisk indikator som fordrer mer aggressiv behandling enn om svulsten kun angår huden.
Differensialdiagnoser er ekvint sarkoid, granulomer eller andre mer uvanlige neoplasier. Endelig diagnose stilles ved histologi som viser små aggregater eller irregulære ansamlinger av neoplastiske keratinocytter prolifererende fra overflaten og som invaderer den subepiteliale stromaen av dermis. Keratindannelser, hornperler, mitoser og atypiske celler er vanlige funn (16). Tidlige plateepitelkarsinomer kan være vanskelig å skille histologisk fra papillomer, imidlertid regnes genitale papillomer som prekankrøse forstadier til plateepitelkarsinomer slik at den kliniske betydningen av å skille disse kan diskuteres (17).
Histologisk tumorgradering basert på hvor lik tumorcellene er friske celler av samme type (Tabell 1) (18), har vist seg å være en god prognostisk indikator i behandlingen av genitale plateepitelkarsinomer hos hest (1). Ufullstendig eksisjon og/eller residiv forekom i 31 % av svulstene karakterisert som Grad 1; i 43 % karakterisert som Grad 2 og i 67 % av svulstene karakterisert som Grad 3 (1). Tumorgradering gjøres basert på biopsi. Finnålsaspirat kan være vanskelig å tolke da det gjerne inneholder mange ulike differensieringsgrader av keratinocyttene (14).
Veldifferensiert, Grad 1 |
Moderat differensiert, Grad 2 |
Dårlig differensiert, Grad 3 |
|---|---|---|
|
|
|
Behandlinger og prognoser
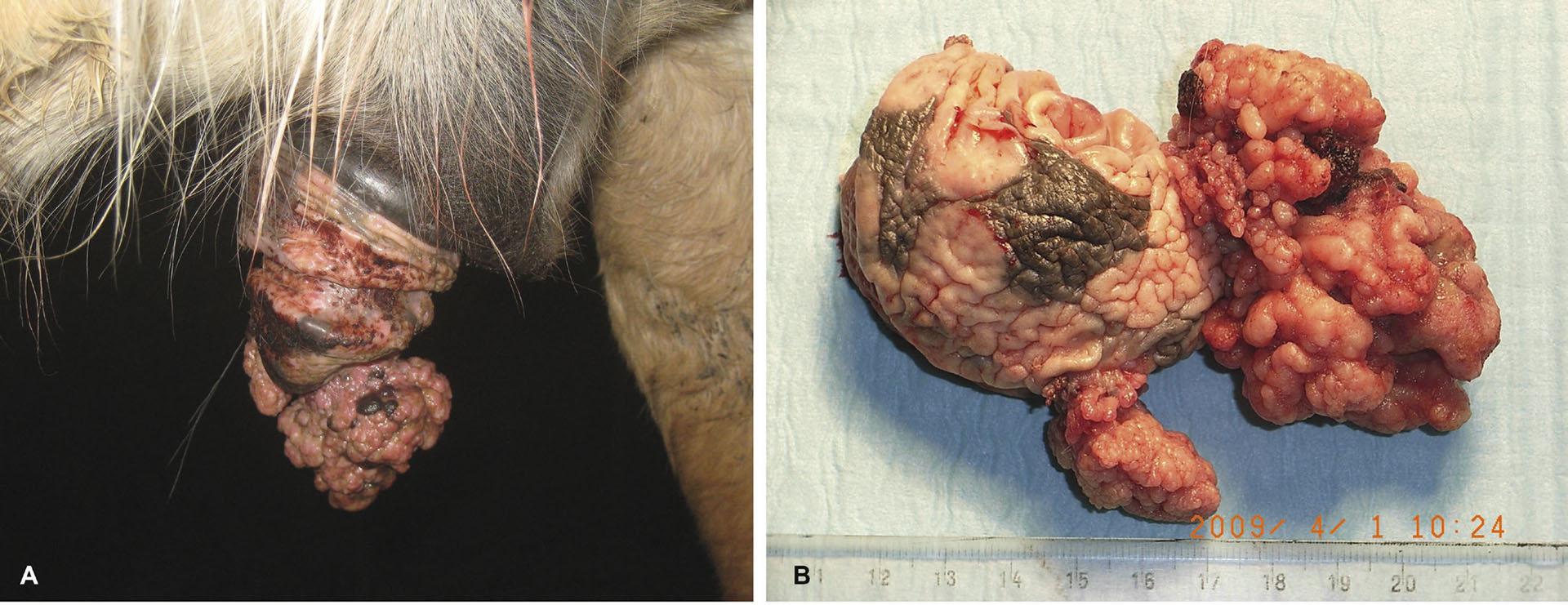
Figur 2. ‘The ugly’; langt fremskredet plateepitelkarsinom hos en 16 år gammel kaldblodstraver, vallak.
A. To stilkede, multilobulære knudrete og ulcererte lesjoner sees på caput penis. Svulstene involverte ikke urethra eller svamplegemet, slik at en partiell fallektomi ble anbefalt.
B. Den amputerte distale delen viser de to svulstene, urethra sees øverst i preparatet. Histologi bekreftet diagnosen, samt frie reseksjonsmarginer.
Begge foto: Cathrine Fjordbakk
Kirurgi er den vanligste behandlingsformen for genitale plateepitelkarsinomer, hovedsakelig siden størrelse og utbredelse av lesjonen(e) på diagnosetidspunktet vanskeliggjør mer konservativ terapi (13). Dette reflekteres også i litteraturen der kun et fåtall studier omtaler konservative behandlingsmetoder for denne svulsttypen. I det følgende legges det dermed mest vekt på kirurgi og leseren henvises til Del 1 og Del 2 av denne artikkelserien for mer inngående omtale av kjemoterapi, kryoterapi og topikal behandling.
Kirurgi
Mer eller mindre radikal kirurgi anbefales avhengig av lesjonenes størrelse og utbredelse (1). I humanmedisinen anbefales minimum 10 mm marginer ved eksisjon av Grad 1 eller Grad 2 lesjoner, og 15 mm marginer for Grad 3 lesjoner. Tilsvarende marginer er ikke etablert for lesjoner hos hest, men en kan anta at marginene bør være større siden genitale neoplasier ofte oppdages relativt sent i forløpet hos denne dyrearten (14). Lokal kirurgisk eksisjon kan være kurativt for mindre lesjoner, spesielt på preputium der det er mindre risiko for invasjon av dypere strukturer. Lokal eksisjon anbefales derimot ikke for solitære lesjoner på glans og den frie delen av penis, med mindre affeksjon av tunica albuginea, urethra og svamplegemet kan utelukkes (Figur 3). Som regel bør lesjoner i dette området behandles med en partiell fallektomi for å redusere risiko for residiv.
Partiell fallektomi kan være kurativt for lesjoner lokalisert distalt for overgangen mellom indre og ytre preputium lamina (Figur 4). Det er likevel lett å underestimere tumorutbredelse, spesielt dersom svulsten involverer urethra og svamplegemet. Svulstceller ble funnet i reseksjonsmarginer hos 30 % av hestene som gjennomgikk denne prosedyren og 26 % av hestene fikk residiv innen 18 måneder (1). I en annen studie resulterte denne prosedyren i residiv hos 19 % av hestene i løpet av oppfølgingsperioden på 1-6 år (13). Komplikasjoner forbundet med inngrepet er som regel milde og forbigående, slik som preputialt ødem i den umiddelbare postoperative fasen og hematuri i opptil fem ukers varighet (13).
Ved mer utbredte lesjoner anbefales en blocreseksjon av penis og preputium med eller uten fjerning av regionale lymfeknuter, hvilket resulterte i en residivrate på 13 % innen 18 måneder (15). Dette er imidlertid en svært invasiv prosedyre, og store hevelser samt sårhelingskomplikasjoner er ikke uvanlig (15). Både eier og behandlende veterinær må se invasiviteten av et slikt inngrep i lys av hestens allmenntilstand. Komorbiditeter som ofte ses hos eldre hester, slik som ekvint metabolsk syndrom (EMS) og pituitary pars intermedia dysfunksjon (PPID) vil begge kunne øke risikoen for komplikasjoner av et invasivt inngrep.
Kjemoterapi
Intralesjonal injeksjon med platinoler kan være effektivt for små lesjoner, eller for større lesjoner kombinert med kirurgi (19). Leseren henvises til Del 1 og 2 i denne artikkelserien for inngående omtale av denne behandlingsformen.
Kryoterapi
Kryoterapi kan være effektivt for små lesjoner, men residiv forekommer i opptil halvparten av lesjonene (1). Avstøtning av det fryste vevet sees etter 7-10 dager, og såret må stå åpent for sekundær sårheling. Leseren henvises til omtale av kryoterapi i Del 2 av denne artikkelserien.
Topikal behandling
Topikal behandling med 5-FU har en selektiv cytotoksisitet mot plateepitelkarsinomer og prekankrøse hudlesjoner, mens normal hud påvirkes i mindre grad grunnet en lavere celledelingsrate og et beskyttende keratinlag (19). Derimot vil ikke virkestoffet trenge dypt ned i huden slik at denne behandlingsformen er forbeholdt små lesjoner med en tykkelse på 2-3 mm (Figur 1) og anbefales ikke til behandling av nodulære og invasive tumorer (19).
Topikal behandling med 5-FU brukt alene for små lesjoner eller i kombinasjon med kirurgi resulterte i remisjon av plateepitelkarsinomer hos 3 hopper, 1 hingst og 7 vallaker med en oppfølgingstid på 7 til 52 måneder (20). Hoppene ble behandlet med 5-FU daglig frem til remisjon etter 1-8 måneder. Hanndyrene ble behandlet hver 14. dag frem til remisjon, 2 til 7 behandlinger var nødvendig. Forskjellen i behandlingsregimet forklares med at behandlingsintervallet kan forlenges dersom lesjonen dekkes av en tett bandasje etter påføring av kremen for å sikre lengre virketid. For lesjoner på penis påføres kremen hver 14. dag da det antas at forhuden i seg selv skaper et tett miljø (19).
Immunterapi
En vaksine mot EcPV2 har blitt utviklet og testet på muse- og kaninmodeller (21). Kanskje enda mer interessant er pågående arbeid med en kombinasjonsvaksine mot BPV1 og EcPV2 som har vist å gi en robust typespesifikk antistoffrespons hos naive hester (22). Det gjenstår imidlertid fortsatt mange ubesvarte spørsmål og videre forskning, samt klinisk utprøving, før disse vaksinene kan bli kommersielt tilgjengelige.
Okulære / periokulære plateepitelkarsinomer
Etiologi
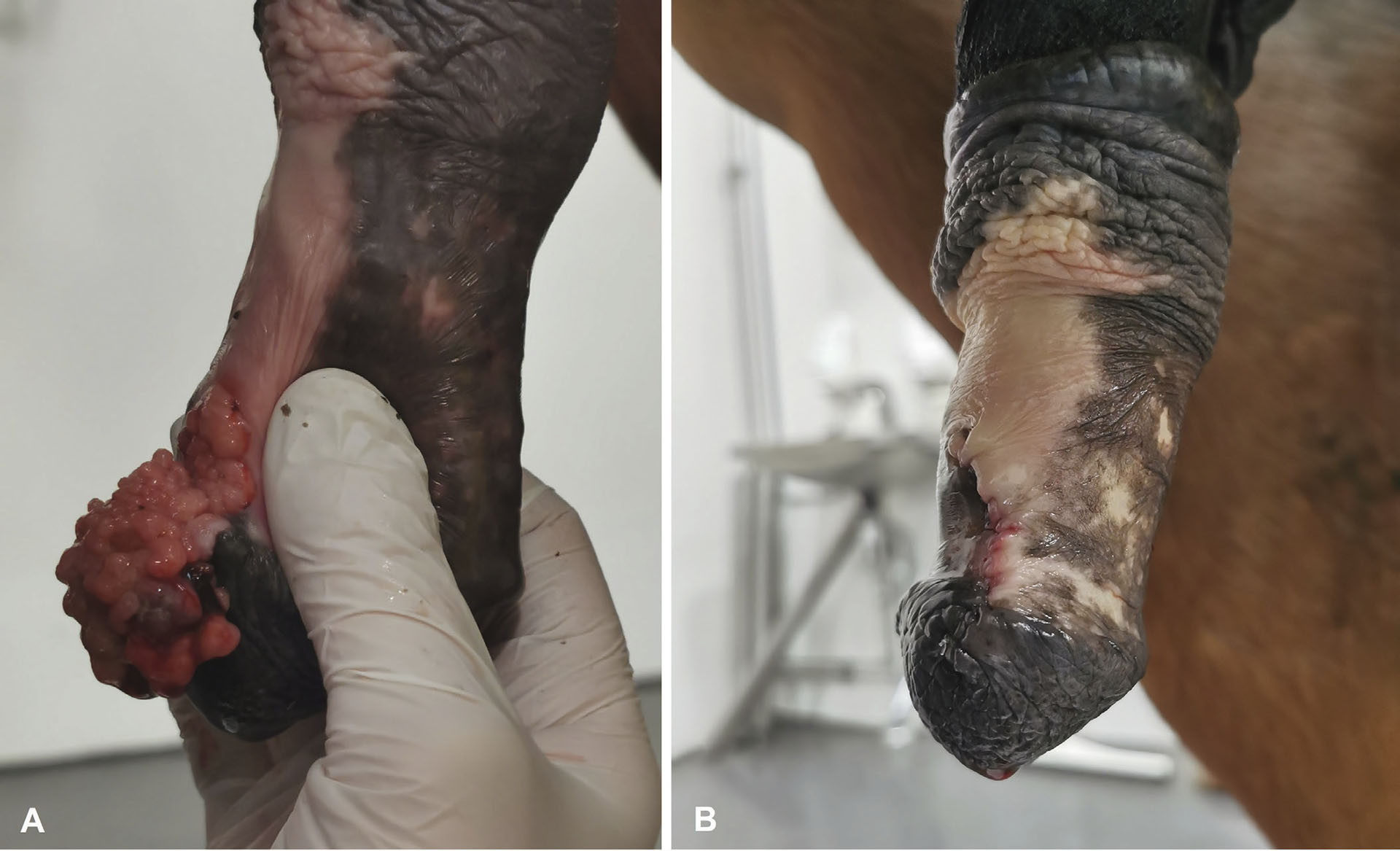
Figur 3.
A. 18 år gammel Connemara vallak, med en stilket, multilobulær, knudrete og ulcerert lesjon utgått fra hud distalt på penisskaftet, i overgangen til caput penis. Hesten hadde den siste tiden ikke skaftet ut ved urinering.
B. Svulsten viste ingen dypere affeksjon til tunica albuginea eller svamplegemet, og ble fjernet ved lokal kirurgisk eksisjon. Histologi bekreftet plateepitelkarsinom med frie reseksjonsmarginer. Hesten har ikke vist residiv ved 6 måneders oppfølging.
Begge foto: Cathrine Fjordbakk
Plateepitelkarsinomer er den vanligste okulære og periokulære svulsten hos hest og kan oppstå på alle øyeoverflater samt øyelokk. Lesjonene har et relativt karakteristisk utseende, gjenkjent som rosa eller røde protruderende masser. UV-stråling, upigmentert hud, rød farge og genetisk predisposisjon er kjente risikofaktorer (16), men en hvilken som helst form for kronisk inflammasjon kan også fremme neoplastisk transformasjon. I motsetning til genitale plateepitelkarsinomer som oftest opptrer hos eldre individ, sees okulære/periokulære svulster ofte hos unge, voksne hester (16).
UV-stråling induserer kovalente kryssbindinger mellom pyrimidiner i DNA. Dersom slike bindinger ikke repareres oppstår feil i DNA replikasjonen som kan føre til mutasjoner, genetisk ustabilitet og etter hvert tumorutvikling. Flere hesteraser, slik som haflinger, belgisk trekkhest, belgisk varmblod, holsteiner, connemara og Rocky Mountain Horse har en spesifikk genmutasjon (damagespecific DNA binding protein 2- DDB2) essensielt for reparasjon av DNA etter UV-skade (4). Mutasjonen er direkte assosiert med okulære plateepitelkarsinomer og genetisk disponerte hester utvikler som regel neoplasi i ung alder (23). Disse individene rammes oftere av både residiv og nye tumorer siden mutasjonen medfører akkumulering av UV-skadet DNA gjennom hestens liv. Hester med en kjent genetisk predisposisjon bør dermed overvåkes nøye og lesjoner behandles aggressivt så fort de oppstår. Bruk av fluemasker med UV-filter er sterkt indisert og kan redusere forekomsten av neoplasien (24). UV-beskyttelse bør også gis til alle hester med upigmentert periokulær hud og til hester diagnostisert med okulære/periokulære plateepitelkarsinomer.
En bør også vurdere risiko ved avl av genetisk disponerte hester. I de overnevnte rasene er frekvensen av DDB2-mutasjonen i størrelsesorden 0,20 - 0,25. En kommersielt tilgjengelig gentest kan være et godt verktøy i avlsarbeidet (25). Siden mutasjonen nedarves som et autosomalt recessivt gen, bør hester med én eller to muterte alleler kun pares med hester som ikke er bærere av mutasjonen (23).
Kliniske funn og diagnostikk
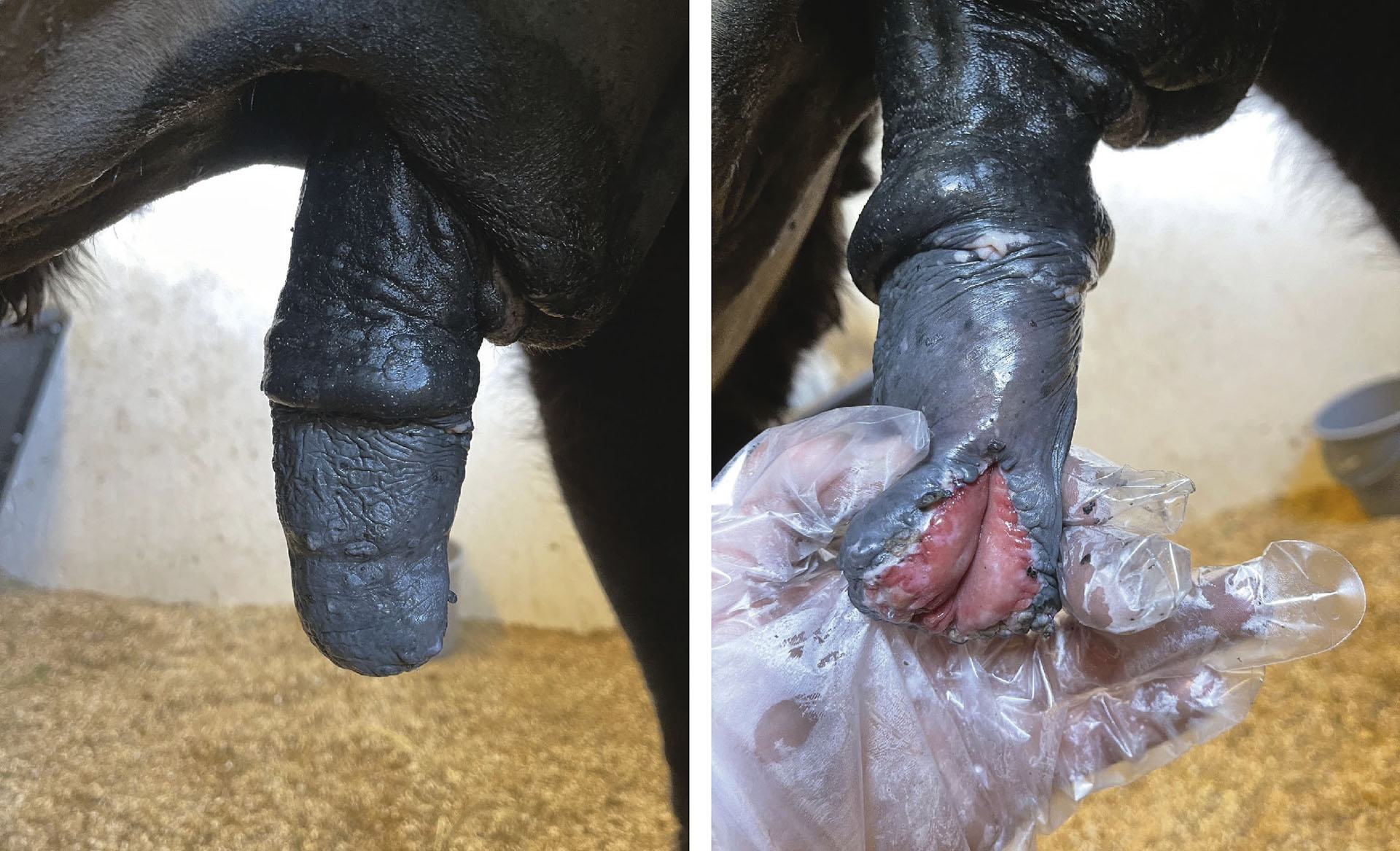
Figur 4. Bilder tatt tre uker etter en partiell fallektomi (William’s prosedyre) utført på en 19 år gammel frieser, vallak, grunnet en lesjon på caput penis, nær urethrale fossa, med tentativ diagnose plateepitelkarsinom. Histologi bekreftet diagnosen, samt frie reseksjonsmarginer.
A. Resulterende lengde ved full utskafting etter amputasjon.
B. Den nye urethrostomien har avhelet. Det er lite komplikasjoner forbundet med denne type penisamputasjon.
Begge foto: Cathrine Fjordbakk
Selv om okulære og periokulære plateepitelkarsinomer kan oppstå på alle øyeoverflater samt øyelokk, er de vanligst forekommende på tredje øyelokk og i mediale canthus, på limbus og på nedre øyelokk. Lesjonene ses oftest som prominerende rosa, knudrete masser (Figur 5) med varierende grad av ulcerasjon, nekrose og inflammasjon. Hyperemi av conjunctiva samt mild eller persistent epiphora er vanlige kliniske tegn. Svulstene er lokalt invasive med metastasepotensial først og fremst til lokale lymfeknuter og spyttkjertler. Metastaseraten er rapportert til 6 - 15,4 % (26,27). Metastaser til orbita, calvarium og thorax er imidlertid også rapportert (28). Siden metastaser er observert fra et halvt til 3 år etter behandling, og uten tegn til residiv av den opprinnelige tumoren, må eieren nøye instrueres i overvåkning for tegn til residiv i det affiserte øyet og dets adnexa, men også varsle ved tegn til sinusitt, hevelser langs ductus nasolacrimalis, samt hevelser i parotisregionen og retrofaryngealt (29).
Plateepitelkarsinom bør altså mistenkes ved funn av enhver rosa eller rødlig protruderende masse i øyeregionen. For konjunktivale eller korneale lesjoner kan farging med Rose-Bengal styrke den kliniske mistanken og identifisere makroskopisk avgrensninger av lesjonen (30). Diagnosen bekreftes med histologi. Differensialdiagnoser er andre neoplasier, konjunktivitt og lokale granulomer eller andre inflammasjonsprosesser. Graderingen som angitt for genitale plateepitelkarsinomer i Tabell 1 kan også brukes for okulære/periokulære lesjoner (30).
Behandlinger og prognoser
I en litteraturgjennomgang om behandling av okulære og periokulære plateepitelkarsinomer publisert i 2014 var det for få studier av god kvalitet til sikkert å kunne angi beste behandling (31). Litteraturgjennomgangen identifiserte imidlertid best suksessrate ved multimodale behandlinger diktert av lesjonenes lokalisasjon og utbredelse (31). Lesjoner på limbus behandles best med kirurgi kombinert enten med laserablasjon, topikal kjemoterapi eller strålebehandling. Lesjoner på øyelokkene behandles med kirurgi kombinert enten med stråleterapi, intralesjonal kjemoterapi eller fotodynamisk terapi mens lesjoner på tredje øyelokk kan behandles med kirurgi alene dersom frie reseksjonsmarginer oppnås (31). Prognosen ansees som dårligst for lesjoner på øvre og nedre øyelokk. I en retrospektiv studie av 147 hester ble suksessraten satt i direkte sammenheng med eierens villighet til å ta hesten til jevnlige kontrollundersøkelser (27) hvilket impliserer at jo tidligere et residiv oppdages, jo lettere blir det igjen å få kontroll over tilstanden.
Rasjonalet for multimodal behandling, for eksempel kombinasjonen av kirurgisk reseksjon og intralesjonal kjemoterapi, er at okulære eller periokulære svulster vanskelig kan fjernes med adekvate marginer uten samtidig å påvirke funksjon, samt at den makroskopiske avgrensningen av svulsten ikke nødvendigvis samsvarer med mikroskopisk avgrensning. Ved bruk av kjemoterapi direkte i reseksjonsmarginene vil imidlertid gjenstående tumorceller behandles og dermed redusere risikoen for residiv. Rapporterte residivrater ved multimodal behandling er likevel i størrelsesorden 25-67 %, som er uttrykk for denne svulsttypens aggressivitet og alvorlighetsgrad (28). Stråleterapi vil ikke bli omtalt i det følgende da det ikke er tilgjengelig i Norge.
Kirurgi
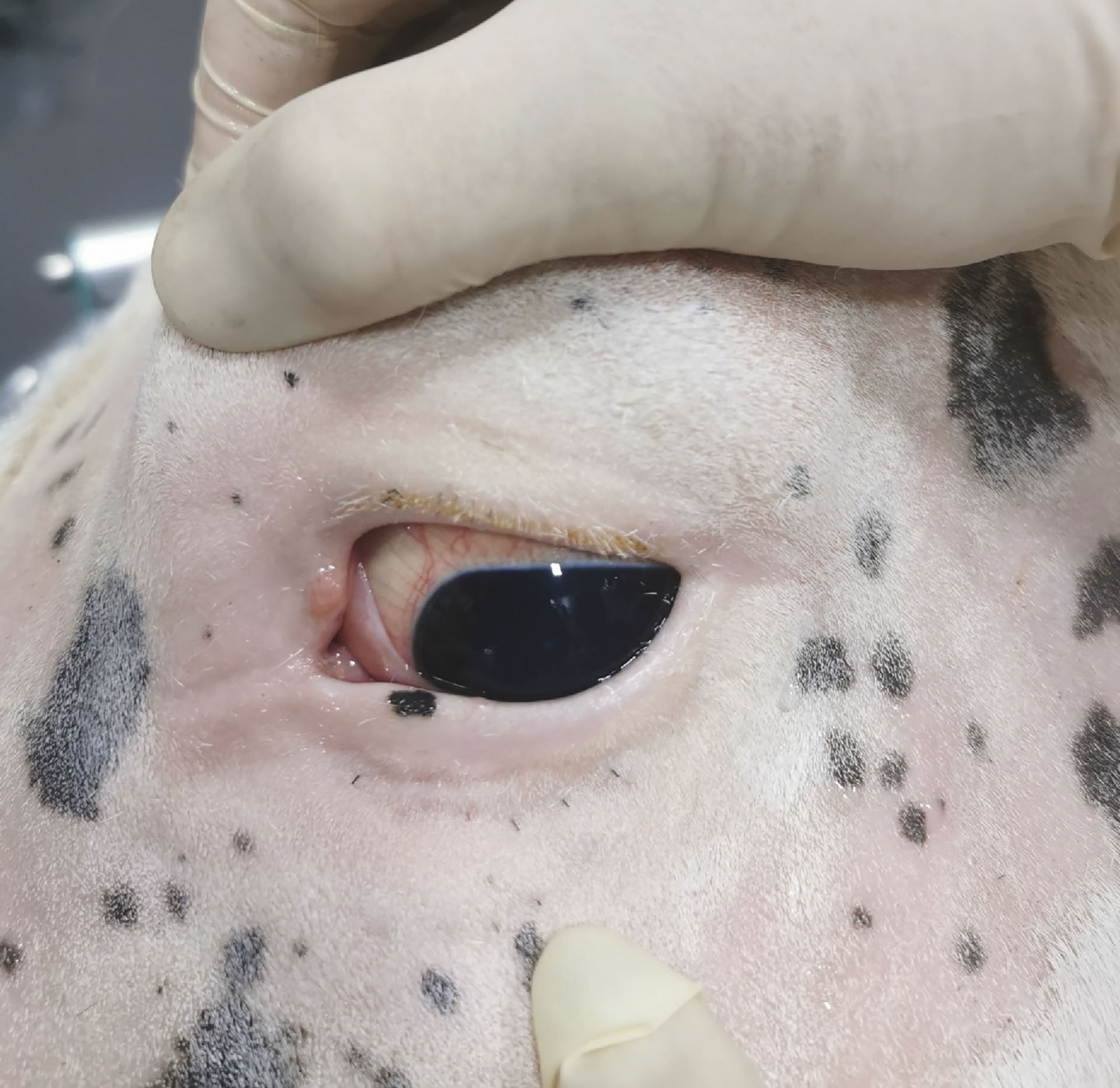
Figur 5. En prominerende, rosa knudrete lesjon sees ved øyelokksranden av øvre øyelokk, cirka 6 mm dorsalt for mediale canthus, hos en 10 år gammel Knabstruper, vallak. Hesten har også en mindre lesjon på det nedre øyelokket. Denne lesjonen sitter også i øyelokksranden og er lokalisert omtrent ved overgangen av den mediale og midtre tredjedelen. Begge lesjonene ble fjernet kirurgisk, og reseksjonsmarginene ble behandlet med intralesjonal kjemoterapi (carboplatin oljeemulsjon). Det øvre øyelokket ble rekonstruert med en glidende hudflapp.
Foto: Cathrine Fjordbakk
Som nevnt over, behandles lesjoner på cornea/sclera best med kirurgisk eksisjon (lamellar keratektomi) i kombinasjon med en annen modalitet (31). Residivraten for kirurgi alene er rapportert til 44,1 % for okulære lesjoner (32). For limbuslesjoner er det ofte mulig å oppnå frie reseksjonsmarginer rundt tumoren, men ikke i dypet, slik at tumorsengen alltid skal betraktes som neoplastisk også etter det kirurgiske inngrepet. Topikal bruk av cytostatika, slik som Mitomycin C og 5-FU, er begge brukt i kombinasjon med kirurgisk eksisjon av denne type lesjoner (33,34). På grunn av potensiale for alvorlige komplikasjoner er det imidlertid anbefalt å avvente topikal Mitomycin-C administrasjon til operasjonsfeltet har reepitelialisert (35).
Kirurgisk eksisjon av lesjoner på øyelokkene kombineres med intralesjonal kjemoterapi eller fotodynamisk behandling. Ved større lesjoner, og spesielt for lesjoner på øvre øyelokk, må rekonstruksjonsteknikker benyttes for å bevare øyelokksfunksjonen. Dersom rekonstruksjon av øyelokket ikke lykkes oppstår komplikasjoner som redusert tårefilm og eksponeringskeratitt som igjen medfører vesentlig risiko for at hesten vil miste øyet på sikt. Siden adekvate kirurgiske marginer er nær sagt umulig i dette området er bruk av tilleggsbehandling dermed avgjørende for et godt resultat. Lesjoner på det tredje øyelokket behandles best ved total eksisjon som kan være kurativt dersom svulsten er begrenset til denne strukturen. I uttalte tilfeller kan enukleasjon eller eventrasjon være nødvendig for å oppnå fullstendig reseksjon av alt svulstvev.
Kjemoterapi
Intralesjonal injeksjon med platinoler kan være effektivt for små lesjoner eller for større lesjoner kombinert med kirurgi. Cellegiftbehandlingen bør gjøres samtidig med operasjonen dersom aggressiviteten av tumoren er ukjent (36). Som beskrevet i Del 1 i denne artikkelserien, bør legemiddelet blandes med en steril olje slik at det oppnås en lokal depoteffekt. Leseren henvises til Del 1 for inngående beskrivelse av denne behandlingsformen.
Topikal behandling
Fordelen med topikal behandling av okulære lesjoner er åpenbar siden legemiddelet distribueres til hele øyets overflate og kan nå også subkliniske lesjoner og lesjoner på andre lokalisasjoner enn hovedtumoren. Mitomycin C er et antibiotikum med kjemoterapeutisk effekt isolert fra Streptomyces caespitosus. Stoffet har blitt brukt til topikal behandling av okulære plateepitelkarsinomer hos menneske i snart 30 år uten rapporterte alvorlige bivirkninger (37). Hos hest har det vært rapportert god respons ved bruk av Mitomycin C alene for behandling av konjunktivale plateepitelkarsinomer; 90 % av hestene viste ikke tegn til residiv 11 måneder etter behandlingen (38). Imidlertid har andre vist bedre effekt av topikal Mitomycin C når dette ble kombinert med kirurgisk reseksjon av svulsten (33). Et mye brukt behandlingsregime er 0,2 ml av en 0,04 % løsning administrert topikalt hver 6. time i én uke, deretter én ukes pause, gjentatt til remisjon (33).
5-FU har også blitt brukt til topikal behandling kombinert med kirurgisk reseksjon av en limbusbasert lesjon og ga remisjon uten tegn til residiv etter ett år (34). Topikal administrering av 5-FU fremkaller imidlertid hoderisting og tegn til ubehag. Uavhengig av hvilket kjemoterapeutikum som velges bør legemiddelet administreres via et subpalpebralt lavagesystem for å minimere søl og sikre riktig administrasjon. Nødvendig verneutstyr skal bukes av alt personell involvert i behandlingen.
Fotodynamisk terapi
Kirurgisk eksisjon kombinert med fotodynamisk terapi har vist seg effektivt for behandling av okulære og periokulære plateepitelkarsinomer; 8 av 9 hester responderte og var uten residiv i en oppfølgingsperiode på 2 til 5,5 år (39). Fordelene med fotodynamisk terapi er at det er en engangsbehandling uten bruk av farlige stoffer, mens ulempen er kostnadene for fargestoffene og utstyret.
Behandlingsformen går ut på å injisere et lysfølsomt fargestoff i tumoren eller tumorsengen for deretter å utsette vevet for lys med den spesifikke bølgelengden fargestoffet absorberer. Dette fremkaller en fotokjemisk reaksjon i vevet som resulterer i nekrose og apoptose, samt vaskulær svikt og inflammasjon initiert av frie radikaler. Denne effekten er selektiv siden stoffene i all hovedsak tas opp av neoplastiske celler. I humanmedisinen administreres stoffene intravenøst mens intralesjonal injeksjon eller topikal administrasjon er de mest brukte formene for fotodynamisk terapi hos hest, hovedsakelig av praktiske og økonomiske årsaker (39). Eksempler på fotosensitive stoffer er infracyanin grønn og indocyanin grønn som begge absorberer lys med en bølgelengde i spekteret 800-830 nm. Fotoaktivering skjer ved bruk av infrarødt (ufokusert) lys levert av en 810 nm diodelaser. Behandlingen er forbundet med lokale og store, men forbigående hevelser. Etterbehandling dreier seg i hovedsak om topikal øyesalve med antibiotika samt systemisk NSAIDs.
Konklusjon
Svulster på ytre kjønnsorgan forårsakes av infeksjon med EcPV2 og oppdages gjerne hos eldre hester slik at tumorutvikling ofte er langt fremskredet når hesten først diagnostiseres. Kirurgi av mer eller mindre invasiv karakter er den vanligste behandlingen for denne typen tumor og jo senere hesten diagnostiseres jo mer invasiv blir den nødvendige behandlingen.
UV-stråling, upigmentert hud, rød farge og genetisk predisposisjon er kjente risikofaktorer for okulære plateepitelkarsinomer. Siden okulære/periokulære svulster sjelden kan fjernes med adekvate marginer, håndteres disse lesjonene best med en multimodal behandling der kirurgi kombineres med kjemoterapi eller fotodynamisk behandling. Genetisk disponerte hester er spesielt utsatt for residiv og tumorutvikling på nye lokalisasjoner. Slike hester trenger tett oppfølging av eier og hurtig diagnostikk og behandling av nye lesjoner.
Sammendrag
Plateepitelkarsinom er den tredje vanligste hudsvulsten hos hest. Denne svulsttypen har predileksjon for upigmentert hud og mukokutane overganger, spesielt i og rundt øyet og ytre kjønnsorgan. Det er distinkte forskjeller i etiologi og risikofaktorer mellom okulære og genitale plateepitelkarsinomer. Genitale plateepitelkarsinomer forårsakes av infeksjon med Equus caballus papillomavirus type 2 (EcPV2), og utvikles som regel fra forstadielesjoner som kan være papillomer, plakker eller in situ karsinomer. Svulstene er vanligst forekommende på penis og preputium hos middelaldrende til eldre vallaker. Metastaser til inguinale lymfeknuter forekommer i 13-17 %. Kirurgi er den vanligste behandlingsformen, hovedsakelig siden størrelse og utbredelse av lesjonen(e) på diagnosetidspunktet som regel vanskeliggjør mer konservativ terapi.
Okulære plateepitelkarsinomer forårsakes av UV-skader eller andre irritasjoner. En genetisk mutasjon som resulterer i et defekt reparasjonsprotein som reparerer DNA etter UV-skade disponerer for lidelsen. Lesjonene har et karakteristisk utseende, gjenkjent som rosa eller røde protruderende masser, og er vanligst forekommende på tredje øyelokk og i mediale canthus, på limbus og på nedre øyelokk hos unge, voksne hester. Svulstene er lokalt invasive med metastasepotensial først og fremst til lokale lymfeknuter og spyttkjertler, men en metastaserate på 6-15 %. Multimodal behandling anbefales, der kirurgi kombineres med intralesjonal eller topikal kjemoterapi eller fotodynamisk terapi. Residivrater ved multimodal behandling er likevel i størrelsesorden 25-67 %, som er uttrykk for denne svulsttypens aggressivitet og alvorlighetsgrad.
Summary
Squamous cell carcinoma (SCC) is the third most common equine skin neoplasia. Predilection sites are nonpigmented skin and mucocutaneous junctions, especially in and around ocular structures and external genitalia. The aetiology and risk factors are distinctly different for ocular and genital SCC. Genital lesions are caused by infection with the Equus caballus papillomavirus 2 (EcPV2) and are often preceded by precursor lesions such as papillomas, plaques, or in situ carcinomas. Lesions are most commonly found on the penis and prepuce of middleaged or elderly geldings, and metastases to inguinal lymph nodes are found in 13-17 %. Surgery is the most common treatment modality, mainly due to lesion size and extent at the time of diagnosis which often precludes more conservative treatment options.
Ocular SCCs are caused by UV-damage or chronic irritation. A genetic mutation resulting in a defective repair protein responsible for DNA repair after UV-damage is a predisposing factor for these lesions. Ocular SCCs are recognized as pink or red protruding masses, most commonly found on the nictitating membrane; medial canthus; limbus and the lower eyelid in young, adult horses. These lesions are locally invasive and metastasize mainly to regional lymph nodes and salivary glands with a rate of 6-15 %. Multimodal treatment is recommended, where surgical excision is combined with intralesional or topical chemotherapy or photodynamic therapy. Recurrence rates of 25-67 %, even after multimodal therapy, indicates however the aggressiveness and severity of this particular neoplasia.
Referanser
Van den Top JG, de Heer N, Klein WR, Ensink JM. Penile and preputial squamous cell carcinoma in the horse: a retrospective study of treatment of 77 affected horses. Equine Vet J 2008;40:533–7.
Sykora S, Brandt S. Papillomavirus infection and squamous cell carcinoma in horses. Vet J 2017;223:48–54.
Sykora S, Samek L, Schönthaler K, Palm F, Borzacchiello G, Aurich C et al. EcPV-2 is transcriptionally active in equine SCC but only rarely detectable in swabs and semen from healthy horses. Vet Microbiol 2012;158:194–8.
Chen L, Bellone RR, Wang Y, Singer-Berk M, Sugasawa K, Ford JM et al. A novel DDB2 mutation causes defective recognition of UV-induced DNA damages and prevalent equine squamous cell carcinoma. DNA Repair 2021;97:103022.
Knight CG, Munday JS, Peters J, Dunowska M. Equine penile squamous cell carcinomas are associated with the presence of equine papillomavirus type 2 DNA sequences. Vet Pathol 2011;48:1190–4.
Lange CE, Tobler K, Lehner A, Grest P, Welle MM, Schwarzwald CC et al. EcPV2 DNA in equine papillomas in situ and invasive squamous cell carcinomas supports papillomavirus etiology. Vet Pathol 2013;50:686–92.
Munday JS, Knight CG, Luff JA. Papillomaviral skin diseases of humans, dogs, cats and horses: a comparative review. Part 1: Papillomavirus biology and hyperplastic lesions. Vet J 2022;288:105897.
Pascoe RR, Knottenbelt DC. Squamous cell carcinoma. I: Manual of equine dermatology. London: Saunders, 1999:216–66.
Greenwood S, Chow-Lockerbie B, Ramsauer S, Wachoski-Dark G, Knight C, Wobeser B. Prevalence of Equus caballus papillomavirus type-2 infection and seropositivity in asymptomatic western Canadian horses. Vet Pathol 2020;57:632–41.
Alloway E, Linder K, May S, Rose T, DeLay J, Bender S et al. A subset of equine gastric squamous cell carcinomas is associated with Equus caballus papillomavirus-2 infection. Vet Pathol 2020;57:427–31.
Peters-Kennedy J, Lange CE, Ortved K. Progression of aural plaques to squamous cell carcinoma in a horse. Vet Dermatol 2020;31:397–400.
Zakia LS, Olivo G, Basso RM, Mira J, Herman M, Araujo JP et al. Imiquimod treatment for Equus caballus papillomavirus infection in equine aural plaques. Vet Dermatol 2016;27;175-e44.
Mair TS, Walmsley JP, Phillips TJ. Surgical treatment of 45 horses affected by squamous cell carcinoma of the penis and prepuce. Equine Vet J 2000;32:406 – 410.
Van den Top JG, Ensink JM, Barneveld A, van Weeren PR. Penile and preputial squamous cell carcinoma in the horse and proposal of a classification system. Equine Vet Educ 2011;23:636–48.
Van den Top JG, de Heer N, Klein WR, Ensink JM. Penile and preputial tumours in the horse: a retrospective study of 114 affected horses. Equine Vet J 2008;40:528–32.
Scott DW, Miller WHJ. Squamous cell carcinoma. I: Equine dermatology. St.Louis, Missouri: Saunders, 2003:707–12.
Munday JS, Knight CG, Luff JA. Papillomaviral skin diseases of humans, dogs, cats and horses: a comparative review. Part 2: Pre-neoplastic and neoplastic diseases. Vet J 2022;288:105898.
Chaux A, Torres J, Pfannl R, Barreto J, Rodriguez I, Velazques EF et al. Histologic grade in penile squamous cell carcinoma: visual estimation versus digital measurement of proportions of grades, adverse prognosis with any proportion of grade 3 and correlation of a Gleason-like system with nodal metastasis. Am J Surg Pathol 2009;33:1042–8.
Théon AP. Intralesional and topical chemotherapy and immunotherapy. Vet Clin North Am Equine Pract 1998;14:659–71.
Fortier L, MacHarg M. Topical use of 5-fluorouracil for treatment of squamous cell carcinoma of the external genitalia of horses: 11 cases (1988 – 1992). J Am Vet Med Assoc 1994;205:1183–5.
Schellenbacher C, Shafti-Keramat S, Huber B, Fink D, Brandt S, Kirnbauer R. Establishment of an in vitro equine papillomavirus type 2 (EcPV2) neutralization assay and a VLP-based vaccine for protection of equids against EcPV2-associated genital tumors. Virology 2015;486:284–90.
Hainisch EK, Abel-Reichwald H, Shafti-Keramat S, Pratscher B, Corteggio A, Borzacchiello G et al. Potential of a BPV1 L1 VLP vaccine to prevent BPV1- or BPV2-induced pseudo-sarcoid formation and safety and immunogenicity of EcPV2 L1 VLPs in horse. J Gen Virol 2017;98:230–41.
Singer-Berk M, Knickelbein KE, Vig S, Liu J, Bentley E, Nunnery C et al. Genetic risk for squamous cell carcinoma of the nictitating membrane parallels that of the limbus in Haflinger horses. Anim Genet 2018;49:457–60.
Scherrer NM. Treatment outcome of squamous cell carcinoma involving the eyelid in the horse: 36 cases (2002 – 2018). Proceedings of the 64th Annual Convention of the American Association of Equine Practitioners. San Francisco, California 2018:411.
Knickelbein KE, Lassaline ME, Singer-Berk M, Reilly CM, Clode AB, Famula TR et al. A missense mutation in damage-specific DNA binding protein 2 is a genetic risk factor for ocular squamous cell carcinoma in Belgian horses. Equine Vet J 2020;52: 34–40.
Schwink K. Factors influencing morbidity and outcome of equine ocular squamous cell carcinoma. Equine Vet J 1987;19:198–200.
Dugan SJ, Roberts SM, Curtis CR, Severin GA. Prognostic factors and survival of horses with ocular/adnexal squamous cell carcinoma: 147 cases (1978 – 1988). J Am Vet Med Assoc 1991;198:298–303.
Giuliano EA. Equine ocular adnexal and nasolacrimal disease. I: Gilger BC, ed. Equine ophthalmology. 2nd ed. Philadelphia: Elsevier, 2011:133–80.
Elce YA, Wilkie DA, Santschi EM, Green E. Metastasis or delayed local extension of ocular squamous cell carcinoma in four horses. Equine Vet Educ 2011;23:496–9.
Knottenbelt DC, Croft JS. Cutaneous squamous cell carcinoma (SCC): ‘What’s the problem?’ Equine Vet Educ 2019;31:635–46.
Surjan Y, Donaldson D, Ostwald P, Milross C, Warren-Forward H. A review of current treatment options in the treatment of ocular and/or periocular squamous cell carcinoma in horses: is there a definitive ‘best’ practice? J Equine Vet Sci 2014;34:1037–50.
Mosunic CB, Moore PA, Carmichael KP, Chandler MJ, Vidyashankar A, Zhao Y et al. Effects of treatment with and without adjuvant radiation therapy on recurrence of ocular and adnexal squamous cell carcinoma in horses: 157 cases (1985 – 2002). J Am Vet Med Assoc 2004;225:1733–8.
Malalana F, Knottenbelt DC, McKane S. Mitomycin C, with or without surgery, for the treatment of ocular squamous cell carcinoma in horses. Vet Rec 2010;167:373–6.
Offer KS, Marchesi F, Sutton DGM. Topical 5-fluorouracil as an adjunct treatment in equine corneolimbal squamous cell carcinoma. Equine Vet Educ 2022;34:e363–8.
Clode AB, Miller C, McMullen RJ, Gilger BC. A retrospective comparison of surgical removal and subsequent CO2 laser ablation versus topical administration of mitomycin C as therapy for equine corneolimbal squamous cell carcinoma. Vet Ophthalmol 2012;15:254–62.
Théon AP, Pascoe JR, Galuppo LD, Fisher PE, Griffey SM, Madigan JE. Comparison of perioperative versus postoperative intratumoral administration of cisplatin for treatment of cutaneous sarcoids and squamous cell carcinomas in horses. J Am Vet Med Assoc 1999;215:1655–60.
Khong JJ, Muecke J. Complications of mitomycin C therapy in 100 eyes with ocular surface neoplasia. Br J Ophthalmol 2006;90:819–22.
Rayner SG, van Zyl N. The use of mitomycin C as an adjunctive treatment for equine ocular squamous cell carcinoma. Aust Vet J 2006;84:43–6.
Giuliano EA, MacDonald I, McCaw DL, Dougherty TJ, Klauss G, Ota J et al. Photodynamic therapy for the treatment of periocular squamous cell carcinoma in horses: a pilot study. Vet Ophthalmol 2008;11(Suppl 1):27–34.