Besetningstester for Fasciola hepatica kan bidra til bedre kartlegging av fasciolose i norske storfebesetninger
Infeksjoner med den store leverikten, Fasciola hepatica, hos storfebesetninger i kystnære strøk på Vestlandet får økende oppmerksomhet. Selv om klinisk sykdom er sjelden, kan høye infeksjonsnivåer føre til produksjonstap i besetningen. Tilgang til anvendelig og nøyaktig diagnostikk er viktig for å få en god kontroll av parasitten. Vi har validert to ulike diagnostiske metoder; en ELISA-test for tankmelk og bruk av utvidet sykdomsregistrering (USR) av store leverikter fra slakterier. Resultatene viser at begge testene har høy diagnostisk nøyaktighet, og dermed egner seg for å vurdere infeksjonsnivået i norske storfebesetninger.
Institutt for produksjonsdyrmedisin,
Veterinærhøgskolen NMBU
Institutt for produksjonsdyrmedisin,
Veterinærhøgskolen NMBU
Institutt for produksjonsdyrmedisin,
Veterinærhøgskolen NMBU
Innledning
I Norge er det i kystområdene og lavlandet på Vestlandet og Sørvestlandet at F. hepatica har de beste forutsetningene for å fullføre sin livssyklus i løpet av en sesong. Dette kan medføre et høyt smittepress i denne regionen. Økende temperatur og mye nedbør kan utvide parasittens utbredelsesområde i fremtiden. Klimaendringer er også forbundet med høyere forekomst av infeksjoner, i tillegg til en mer intensiv klinisk sykdom (1). Samtidig er resistens mot anthelmintika påvist i F. hepatica i andre land (2). Dette understreker betydningen av korrekt bruk av parasittmidler og økt bruk av ikke-medikamentelle tiltak for å redusere eksponering for smitte.
Fasciolose opptrer som regel kronisk og subklinisk, og kan forårsake produksjonstap i form av redusert melkeytelse og tilvekst, vekttap og nedsatt fruktbarhet (3), i tillegg til kassasjon av lever ved slakt. Det er derfor gunstig å kunne teste besetninger for å vurdere om det bør gjøres tiltak for å redusere infeksjonsnivået. Avføringsprøver av et utvalg dyr fra besetningen har vært en standard metode for å kontrollere forekomst, men dette blir sjelden utført. Kostnadene det innebærer for bonden, i tillegg til at det kan oppleves arbeidskrevende, kan være medvirkende årsaker til dette. I tillegg har denne metoden lav sensitivitet, både på individnivå dersom man kun tester én prøve tatt på ett tidspunkt, og på besetningsnivå dersom få dyr er inkludert i prøveuttaket (4). På slakteriene registreres funn av forandringer forenelige med infeksjon med den store leverikten. Dette inkluderes i såkalt utvidet sykdomsregistrering (USR) på slakteriene. I forbindelse med hvert enkelt slakteoppgjør blir produsentene informert om registreringer av store leverikter for de innsendte dyrene.
I prosjektet «Bærekraftig kontroll av beiteparasitter hos storfe i Norge» ved NMBU Veterinærhøgskolen har et overordnet mål vært å frembringe kunnskap som kan bidra til en mer bærekraftig kontroll av beiteparasitter hos norske storfe. Prosjektet er finansiert med midler fra Fondet for forskningsavgift på landbruksprodukter (FFL) og Forskningsmidler over jordbruksavtalen (JA) og bidrag fra TINE, Animalia og NABAS (Norwegian Antibodies). Evaluering av diagnostiske metoder for å påvise og kvantifisere forekomst av parasitter har vært et sentralt delmål, da diagnostikk er avgjørende for en mer målrettet bruk av anthelmintika. I ett av studiene i prosjektet har vi undersøkt muligheter for å diagnostisere infeksjon med F. hepatica på besetningsnivå (5). Vi har validert to ulike diagnostiske metoder; en ELISA-test på tankmelk og bruk av USR-data på store leverikter fra slakterier. Funnene viser at begge tester har høy diagnostisk sensitivitet (DSe) og spesifisitet (DSp), og derfor kan være nyttige for å vurdere infeksjonsnivået i norske storfebesetninger.
Evaluering av to besetningstester
Vi analyserte en ELISA-test på tankmelk og bruk av aggregerte USR-data for store leverikter fra besetninger i et område som er et kjent risikoområde for eksponering for F. hepatica.Tankmelk fra 437 besetninger i Rogaland og Vestland ble samlet inn ved årsskiftet 2020-2021. Disse ble testet for antistoffer mot F. hepatica med SVANOVIR® F. hepatica-Ab ELISA test ved TINE Mastittlaboratoriet i Molde. Dette er en semi-kvantitativ ELISA test, hvor prøvesvaret blir oppgitt som en Optical Density Ratio (ODR). ODR-verdien øker med høyere eksponering for store leverikter. Fra de samme besetningene ble USR-data fra 2019-2021 samlet inn. Fordi norske besetninger er små, og det følgelig slaktes relativt få dyr hvert år, ble registreringer fra tre år anvendt i analysen. Kun hunndyr ble inkludert i studien, ettersom okser ikke er utsatt for samme smitterisiko da de som hovedregel ikke har tilgang til beite. For å bruke USR-data som en besetningstest, ble dataene aggregert på besetningsnivå; det ble for treårsperioden beregnet hvor stor andel av det totale antallet slaktede kyr og kviger som ble registrert med funn av infeksjon med store leverikter. I analysen testet vi hvor nøyaktige de to testene var ved ulike grenseverdier for andel positive dyr ved slakt. For tankmelk-testen, brukte vi testprodusentens angitte grenseverdi for positiv test, men vi evaluerte i tillegg hvilken grenseverdi som gir størst DSe og DSp for norske melkebesetninger.
Hverken tankmelk-testen eller slakteriregistreringer kan brukes som en gullstandard-test for F. hepatica infeksjon i en besetning. Vi brukte derfor en Bayesiansk latent klasse analyse for å estimere den diagnostiske nøyaktigheten til testene (7). Det er i analysen ikke nødvendig å kjenne besetningens sanne infeksjonsstatus. Som en del av analysen ble studiepopulasjonen delt inn i to ulike underpopulasjoner med en antatt forskjell i prevalens; «Kystpopulasjonen» var kystnære kommuner med antatt høyere prevalens, mens resten av besetningene ble definert som «Innlandspopulasjonen». Resultatet av analysen er estimater for DSe og DSp for begge testene samt prevalens i hver av underpopulasjonene. I studien fikk vi høyest estimert nøyaktighet for testene ved å identifisere besetninger der i overkant av 10 % av kyr sendt til slakt hadde registrering for den store leverikten. Ved å bruke denne grenseverdien, ble den diagnostiske nøyaktigheten for tankmelk-ELISA estimert til 90,4 % (median), med et 95 % Posterior Credible Interval (PCI) på 84,0-96,2 for DSe og 95,3 % (90,6-100 % PCI) for DSp. Estimert DSe og DSp for USR-testen var henholdsvis 87,5 % (81,4-93,1 % PCI) og 91,0 % (85,2-96,5 % PCI). Disse resultatene tilsier at både en tankmelk-test og aggregerte USR-data kan brukes som besetningsverktøy for å monitorere infeksjon med store leverikter. Ved å bruke en grenseverdi på 10 % positive dyr ved slakt, estimerte vi også forekomsten på besetningsnivå. Det var stor forskjell i estimert sann prevalens i det undersøkte området på Sør-Vestlandet; «Kystpopulasjonen» hadde en prevalens på 78 %, mens den i «Innlandspopulasjonen» var 21 %.
F. hepatica: livssyklus og kliniske tegn på sykdom
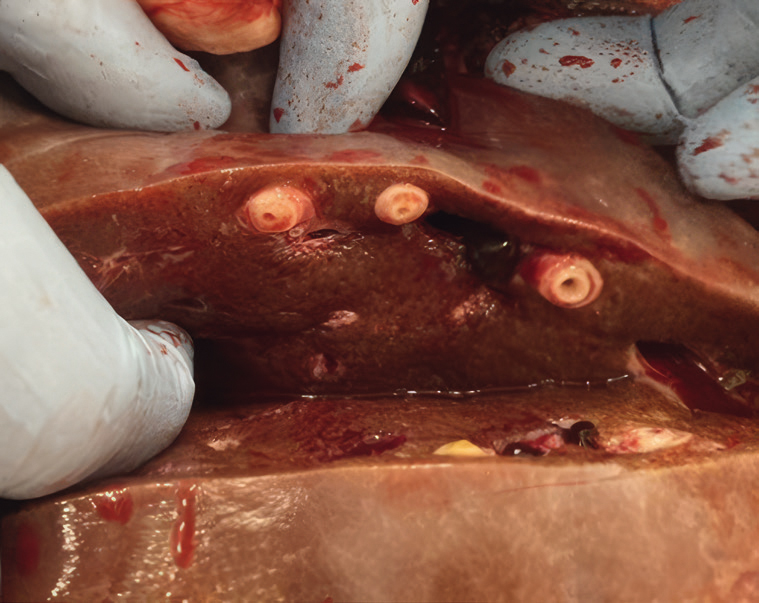
Bilde 1: Snitt av lever påvirket av den store leverikten.
Foto: Tonje Opsal
Den store leverikten har en vid utbredelse og mange endeverter, som drøvtyggere, hest, ville hjortedyr og mennesker. Iktene er avhengige av en damsnegl for å fullføre sin livssyklus. Denne sneglen lever i stillestående vanndammer, grøfter, dype hjulspor og liknende. Da både sneglen og andre utviklingssteg i parasitten trenger relativt varme og fuktige omgivelser for å fullføre utviklingen til de smitteførende «metacercariaene», finnes parasitten typisk i avgrensede områder. Etter at endevertene har blitt smittet, vil iktelarvene penetrere tarmen før de vandrer til leveren. Iktelarvene suger blod og skader levervevet mens de borer seg gjennom leveren til gallegangene. Dette resulterer i tap av blod og proteiner samt redusert leverfunksjon. De voksne iktene lever og reproduserer i gallegangene. Prepatensperioden er opptil 12 uker, og utskillelsen av egg via avføring er ujevn grunnet den varierende tømmingen av galleblæren. De kraftigste kliniske tegnene er beskrevet på sau, men geit kan også få alvorlig sykdom. Storfe er mer motstandsdyktige mot parasitten, blant annet på grunn av utvikling av immunitet med produksjon av antistoffer (6). Kliniske tegn forekommer på noen individer vinterstid, og inkluderer nedsatt appetitt, vekttap og redusert melkeytelse.
Prediktive verdier er viktige i evaluering av test resultater
Ved å beregne de prediktive verdiene får vi estimater som angir hvor «pålitelige» testresultatene er når de brukes i en besetning fra en populasjon der prevalensen er kjent. De prediktive verdiene er avhengige av DSe og DSp samt prevalensen i de ulike populasjonene. I en populasjon der prevalensen er høy, er det høy sannsynlighet for at et positivt testresultat er korrekt. Derimot vil sannsynligheten for at en negativ test er falsk negativ være høyere i disse populasjonene enn i en populasjon med lav prevalens. I vår studie, der «Kystpopulasjonen» hadde en prevalens av F. hepatica infeksjon på 78 %, var de positive prediktive verdiene for tankmelk-test og USR-test henholdsvis 98,6 % og 97,2 %. Dette tilsier at i besetninger i for eksempel kystkommunen Rennesøy, vil kun 1,4 % av positive tankmelk-tester og 2,8 % av positive USR-tester være falske positive. I en populasjon på Voss, som tilhører «Innlandspopulasjonen», vil derimot sannsynligheten for falske positive tester være høyere, og kan forekomme i 16 % av positive tankmelk-tester og 27 % av positive USR-tester. Derimot er det lav sannsynlighet for at negative testresultater er falske negative i Innlandspopulasjonen. Kjennskap til de prediktive verdiene har stor klinisk relevans når man evaluerer testresultatene i en gitt besetning.
Muligheter for diagnostikk i dag
En tilgjengelig tankmelk-test for F. hepatica i Norge er SVANOVIR® F. hepatica-Ab ELISA test, som utføres på bestilling ved TINE Mastittlaboratoriet Molde. I vår studie ble tankmelk-prøver samlet ved årsskiftet. Nivået av antistoffer mot F. hepatica er høyest rundt dette tidspunktet, og dermed mest representativt for å vurdere eksponering for parasitten i siste beitesesong. Ved vurdering av resultatet av tankmelk-testen må det tas hensyn til faktorer som kan påvirke prøveresultatet i besetningen, for eksempel eventuell gjennomført behandling med anthelmintika. Dette er fordi det vil ta noe tid før antistoffnivået går ned etter administrasjon av parasittmiddel. Tankmelken vil derfor ha et høyt nivå av antistoffer selv om iktene er blitt drept med behandling.
Per i dag finnes det ingen oversikter som gir produsenter og veterinærer en samlet fremstilling av USR-data for store leverikter over tid for hver enkelt storfebesetning. Selv om USR-data tilgjengeliggjøres for produsentene etter hver innsending av dyr til slakt, ville en samlet oversikt gjort det lettere for bønder og veterinærer å følge med på infeksjonsnivået i besetningen. Bruk av USR-data forutsetter også at besetningen har sendt inn et tilstrekkelig antall dyr til slakt for å få et godt bilde av eksponeringen for F. hepatica. I vår studie ble besetninger som leverte mindre enn 10 hunndyr til slakt i løpet av 3-års-perioden ekskludert. Dersom besetningen har sendt få hunndyr til slakt, er det trolig bedre å bruke en tankmelk-test.
Vår studie viser at både en ELISA-test på tankmelk og bruk av USR-data kan være nyttige for å vurdere infeksjonsnivået med store leverikter i en storfebesetning. Videre i prosjektet skal sammenhengen mellom infeksjonsnivå og tilvekst og melkeytelse undersøkes. Ved at veterinærer har god kunnskap om diagnostiske metoder, og kan bruke dette for en mer målrettet behandling av infeksjon, kan man også redusere risikoen for utvikling av anthelmintikaresistens hos F. hepatica i Norge.
Denne artikkelen er basert på en artikkel publisert i Preventive Veterinary Medicine:
Tonje Opsal, Matthew J Denwood, Lisbeth Hektoen, Lucy J Robertson, Ingrid Toftaker, Estimation of diagnostic sensitivity and specificity of abattoir registrations and bulk tank milk ELISA as herd-level tests for Fasciola hepatica using Bayesian latent class modelling, Preventive Veterinary Medicine, Volume 228, 2024, 106213, ISSN 0167-5877, https://doi.org/10.1016/j.prevetmed.2024.106213.
(https://www.sciencedirect.com/science/article/pii/S0167587724000990)
Referanser
Morgan ER, Charlier J, Hendrickx G, Biggeri A, Catalan D, von Samson-Himmelstjerna G et al. Global change and helminth infections in grazing ruminants in Europe: impacts, trends and sustainable solutions. Agriculture 2013;3:484-502.
Rose Vineer H, Morgan ER, Hertzberg H, Bartley DJ, Bosco A, Charlier J et al. Increasing importance of anthelmintic resistance in European livestock: creation and meta-analysis of an open database. Parasite 2020;27:69.
Charlier J, van der Voort M, Kenyon F, Skuce P, Vercruysse J. Chasing helminths and their economic impact on farmed ruminants. Trends Parasitol 2014;30:361-7.
Rapsch C, Schweizer G, Grimm F, Kohler L, Bauer C, Deplazes P et al. Estimating the true prevalence of Fasciola hepatica in cattle slaughtered in Switzerland in the absence of an absolute diagnostic test. Int J Parasitol 2006;36:1153-8.
Opsal T, Denwood MJ, Hektoen L, Robertson LJ, Toftaker I. Estimation of diagnostic sensitivity and specificity of abattoir registrations and bulk tank milk ELISA as herd-level tests for Fasciola hepatica using Bayesian latent class modelling. Prev Vet Med 2024;228:106213.
Sangster NC, Martinez-Moreno A, Pérez J. Pathology, pathophysiology and clinical aspects. I: Dalton JP, ed. Fasciolosis. 2nd ed. Wallingford: CABI Publishing, 2021:145-79.
Cheung A, Dufour S, Jones G, Kostoulas P, Stevenson MA, Singanallur NB et al. Bayesian latent class analysis when the reference test is imperfect. Rev Sci Tech 2021;40:271-86.