Diagnostiske injeksjoner i halthetsdiagnostikken hos hest
Artikkelen beskriver diagnostiske injeksjoner som benyttes i halthetsdiagnostikken hos hest. Alle ledd og de mest brukte bursa- og perineuralanestesiene fra og med carpus og bakkne og distalt for disse er omtalt. Begrensninger og komplikasjoner ved diagnostiske injeksjoner er diskutert.
Veterinær Biri Hesteklinikk
Innledning
Halthet indikerer primært strukturelle eller funksjonelle problemer i ekstremiteter eller rygg. Bevegelsesapparatet er et svært komplisert samarbeid mellom nervesystemet, knokler, muskler, sener og ligamenter. Det er derfor viktig at klinikeren kan skille mellom halthet forårsaket av smerte og funksjonelle haltheter somfor eksempel ved nevrologiske tilstander. Diagnostiske injeksjoner har en sentral rolle i halthetsdiagnostikken hos hest for å bekrefte hvor smerten kommer fra. Den første registrerte bruken av et lokalanestetikum i halthetsdiagnostikken var i Pennsylvania, USA, i 1885, hvor det ble brukt kokain til perineuralanestesi distalt i ekstremitetene (1). På grunn av bivirkninger som vevstoksisitet og fare for avhengighet ble kokain etter hvert erstattet av prokain. Prokain hadde imidlertid ingen effekt intraartikulært (2). I de påfølgende årene forsøkte man å utvikle andre lokalbedøvende farmaka, men alle hadde de ulike uønskede effekter. Prokain ble derfor brukt helt frem til 1940-årene da det ble erstattet av lidokain. Dette var et middel som kunne brukes både til perineural- og leddanestesi uten for mange uønskede effekter (3).
Artikkelen er en litteraturstudie av de mest brukte ledd-, bursa- og perineuralanestesiene og legger vekt på diagnostiske injeksjoner fra og med carpus og femorotibialledd og distalt for disse. Anestesimetodene er også velegnet i akutt hestepraksis.
Lokalanestetika
Virkningsmekanisme
Nervefibre (aksoner) i de perifere nervene blir klassifisert ut fra størrelse og myelinisering, og har spesialiserte funksjoner. De perifere nervene kan bestå av enkeltaksoner eller flere aksoner i samme nervetråd, og kan være både myeliniserte og ikke-myeliniserte. I myeliniserte nerver danner Schwannske celler flere lag myelin rundt hvert akson. Myelinet fører til redusert indre motstand i aksonet og redusert tap av Na+-ioner ut av aksonet. Dette gjør at nerveimpulsen når lengre før den dør ut. Aksoner som ikke er dekket av en myelinskjede har ionekanaler langs hele aksonet for en god nok distribusjon av aksjonspotensialet. Aksoner som er dekket av myelin har kun ionekanaler ved de ranvierske knuter, det vil si i området mellom myelinskjedene (4).
Nervesignaler blir sendt som resultat av aksjonspotensialer, som er en rask endring av den elektriske gradienten over cellemembranen. Hvert aksjonspotensial begynner med et hvilepotensial som er negativt (5). Dette endres raskt til et positivt membranpotensial, som igjen går tilbake til et negativt potensial når depolariseringen er over, det vil si når nerveimpulsen er sendt.
Ved depolariseringen skjer en rask innstrømming av Na+-ioner fra ekstracellulærvæsken gjennom selektive natriumkanaler i cellemembranen. Mot slutten av aksjonspotensialet vil Na+-kanalene lukke seg samtidig som kaliumkanaler i cellemembranen åpner seg og K+-ioner strømmer ut av cellene, og repolariserer cellene mot hvilepotensialet. Lokalanestetika virker på depolariseringen ved at virkestoffet binder seg til lipoproteiner og Na+-kanaler i cellemembranen. Dette medfører at kanalene ikke åpner seg like raskt, eller ikke i det hele tatt, og hindrer depolariseringen (6).
Lokalanestesi kan i utgangspunktet blokkere alle typer nerver (4). Det vil si at både sensoriske nerver, som vi i utgangspunktet ønsker å bedøve, og motoriske nerver, som vi i utgangspunktet ikke ønsker å bedøve, vil kunne blokkeres. Det som skiller nervenes mottakelighet for lokalanestetika, ligger i nervens størrelse og myeliniseringsgrad (4). I store perifere nervebunter ligger de motoriske nervene mer perifert i nervebunten enn de sensoriske, og vil derfor eksponeres for lokalanestesi først. Dermed påvirkes den motoriske funksjonen før den sensoriske. Distalt i ekstremitetene er det imidlertid lite muskulatur, og tidlig desensibilisering av motoriske nervefibre vil ikke være noe problem her.
I praksis vil bortfall av nervefunksjon som følge av perineuralanestesi skje i følgende rekkefølge: smerte, varme, berøring, dyp berøring og til slutt den motoriske funksjonen (4). De sensoriske nerveender i ledd finnes i synovialmembranen og i subchondralt vev. Diffusjon av anestesimiddel litt inn i synovialmembranen er derfor viktig for at ønsket effekt skal oppnås.
Valg av lokalanestetika
Valget av anestesimiddel avhenger av hvor potent middelet er, tid før virkningen inntreffer, varighet av anestesien og lokalirriterende bivirkninger. Dette er egenskaper som avhenger av dose, injeksjonssted, med eller uten tilsatt vasokonstriktor og pH i lokalanestesimiddelet (7).
Lidokain HCl var lenge det mest brukte legemiddelet til lednings- og intraartikulær analgesi. Det har vist seg at lidokain har en vevsirriterende effekt som i enkelte tilfeller kan medføre inflammasjonsreaksjoner og halthet ved bruk i de distale ledd i ekstremitetene (8). Ved perineural administrasjon har lidokain en virketid på 30-45 minutter (9). Etter at mepivakain HCl kom på markedet har bruken av lidokain gått sterkt tilbake. Mepivakain virker raskere og skaper mindre vevsreaksjon enn lidokain (3). Mepivakain har en virketid på cirka 55 minutter når det blir injisert i midtre carpus (10), perineuralt har det en virketid på 90-120 minutter (9). I enkelte tilfeller kan det virke opp til 3 timer, noe som gjør preparatet velegnet og det mest brukte til mer tidkrevende halthetsundersøkelser. Analgesi ved bruk av mepivakain inntreffer raskt ved perineural eller intraartikulær administrasjon. Den første evalueringen etter perineural infiltrasjon bør derfor skje allerede etter 3-5 minutter på grunn av diffusjon distalt langs nervene og blodkarene i ekstremitetene (11). Anatomisk kunnskap i området vi ønsker anestesert og medikamentets egenskaper er avgjørende for en riktig tolkning av effekten av injeksjonene.
Enkelte klinikere har observert at det kan ta opptil 10 minutter før det oppnås effekt av en perineural analgesi. Dette blir forklart med at anestesimiddelet har blitt deponert utenfor fascien som ligger rundt nervene (11). Ved manglende effekt vil det derfor være hensiktsmessig å vente 15-20 minutter før neste steg i undersøkelsen blir tatt, slik at det ikke råder tvil om hvilken av anestesiene som har fungert. Evaluering av hudfølsomhet i området gjeldende nerve innerverer, vil gi en indikasjon på om anestesien har effekt før hesten blir mønstret.
Utførelse av diagnostiske injeksjoner
Før det blir gitt diagnostiske injeksjoner bør hesten være bedømt til å være så halt at man er sikker på at man kan observere at haltheten er redusert ved en eventuell positiv respons på anestesien. Hesten vil ikke alltid bli uhalt selv om anestesien dekker det skadete området, og det må derfor i de enkelte tilfeller vurderes respons i forhold til det kliniske bildet. Ved perineural anestesi som injiseres subkutant vaskes injeksjonsstedet med klorhexidinsprit 5mg/mL, eventuelt først med en 50/50 blanding av antiseptisk såpe og vann dersom området er sterkt forurenset. Ved risiko for penetrasjon av synoviale strukturer som seneskjeder, ledd eller bursa, er det nødvendig å klargjøre huden som ved en leddinjeksjon. Konsekvensen av en subkutan infeksjon er vanligvis liten, mens utfallet av en infeksjon i en nærliggende synovial struktur kan være kritisk. Før injeksjon i synoviale strukturer er klipping og rengjøring med 50/50 blanding av antiseptisk såpe og vann helt nødvendig for å fjerne fett og smuss. Kontakttid for såpen bør være minimum 3 minutter før området skrubbes i sirkulære bevegelser fra rent (innstikksted) mot skittent med klorhexidinsprit 5mg/mL. Kontakttid for klorhexidinsprit på huden bør være minimum 2 minutter. Like før injeksjon skal området punktstrykes lett med klorhexidinsprit (12). Medikamentet som benyttes skal ved sterilt uttak hentes fra en uåpnet flaske.
Valg mellom intraartikulær og regional anestesi
Ved halthetsdiagnostikk vil leddanestesi ofte være førstevalg der et ledd antas å være involvert. På grunn av individuelle variasjoner når det gjelder beliggenhet og distribusjon av de sensoriske nervene hos hest, vil regional anestesi medføre variasjoner i utbredelsen av desensibiliseringen. Det er vanlig å sjekke hudreaksjonen for følsomhet med en butt gjenstand, men dette forteller oss likevel bare at huden er bedøvet. Det vil derfor råde noe usikkerhet om hvorvidt leddet eller den ønskede strukturen er bedøvet, eller om anestesien bare gjelder huden. En reduksjon i halthet indikerer uansett behov for ytterligere diagnostikk i området som har blitt bedøvet. Hester aksepterer ofte leddanestesi bedre enn regional anestesi da sistnevnte ofte kan bety flere injeksjoner.
Intraartikulær anestesi
Hovledd
Hovleddet injiseres på belastet bein. Motsatt bein løftes slik at hesten tar full støtte på beinet som skal anesteseres. En 0,8*40 mm kanyle settes inn vertikalt og litt medialt i den dorsale delen av leddkapselen til hovleddet, like proksimalt for kronranden, 0,5-1,5 cm lateralt for midtlinjen (Figur 1). 4-6 mL anestesimiddel injiseres. Det vil vanligvis komme leddvæske spontant, men en god indikasjon på at kanylen er plassert riktig er også at injeksjonen går lett og medikamentet kommer i retur når sprøyten blir tatt av kanylen.
Når hovleddet bedøves, bedøves også hovsenebeinsbursaen (13), hovsenebeinet (14), tåregionen av sålen (15) og hos de fleste hester deler av den dype bøyesena inne i hoven (16). Når større mengder anestesimiddel (~10 mL) blir deponert i hovleddet vil også ballepartiet bli bedøvet som ved en kodenerveanestesi (17). En mulig forklaring på hvorfor alle disse strukturene involveres, kan være at de subsynoviale nervene som innerverer hovsenebeinet og kollateralligamentene til hovsenebeinet, samt palmardigitalnervene som ligger nær den palmare utposningen av hovleddet, desensibiliseres som følge av diffusjon (13, 17). Det vil derfor være nyttig å foreta første evaluering allerede etter 2-3 minutter.

Figur 1. Injeksjon av hovledd. Foto: Oddvar Enerstvedt.
Kronledd
Kronleddet er lettest tilgjengelig på den dorsale overflate av falangen på belastet bein. Leddspalten palperes ved å identifisere eminensen for innfestingen av det laterale kollateralligamentet for kronleddet, distolateralt på kronbeinet. Kanylen (0,8*40 mm) skal peke medialt inn under strekkesena cirka 1,5 cm distalt for eminensen for innfestingen av kollateralligamentet (Figur 2). Leddkapselen ligger cirka 1,5 cm under hudoverflaten. 5-10 mL anestesimiddel injiseres.

Figur 2. Injeksjon av kronledd. Foto: Oddvar Enerstvedt.
Kodeledd
Kodeleddet er lettest tilgjengelig i den proksimale/laterale utposningen av kodens leddkapsel. Denne begrenses av griffelbeinet proksimalt, den dype bøyesena palmart/plantart, pipa kranialt og det laterale proksimale kollaterale sesamoidligamentet distalt. Utposningen gjøres lettere tilgjengelig på løftet bein med lett fleksjon av kodeleddet. Ved å legge et lett trykk med tommelfingeren like distalt for hodet av griffelbeinet vil leddkapselen lettere visualiseres. Kanylen (0,8*40 mm) bør peke litt distalt (Figur 3). Leddkapselen ligger mellom 0,5-1,3 cm under huden, og leddvæske er lett tilgjengelig for aspirasjon. 5-12 mL anestesimiddel injiseres.
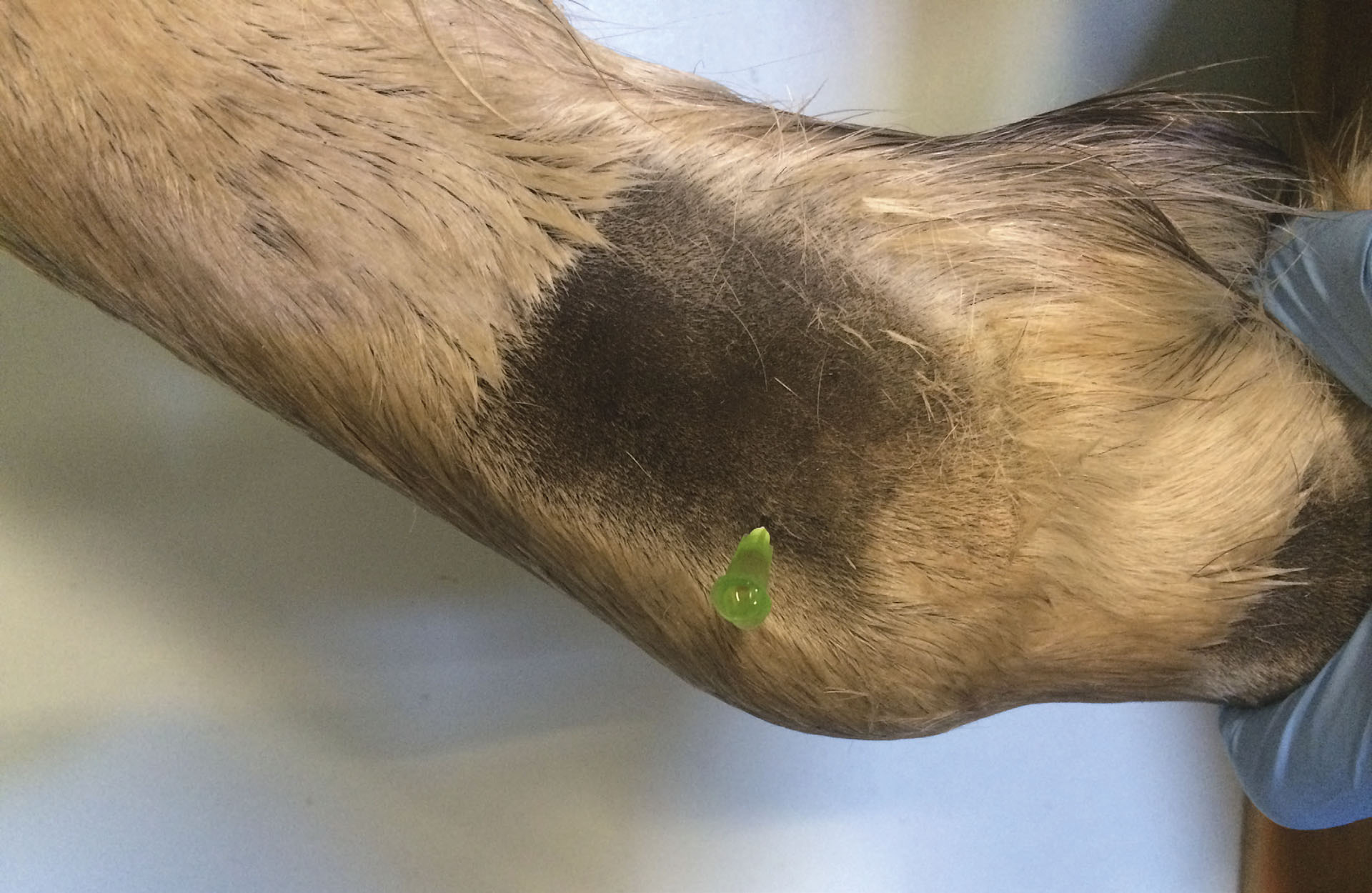
Figur 3. Injeksjon i kodeledd. Sett fra lateralsiden. Foto: Oddvar Enerstvedt.
Carpus
Midtre karpalledd kommuniserer ikke med proksimale karpalledd, derfor må dette bedøves separat. Midtre karpalledd kommuniserer med distale karpalledd, noe det må tas hensyn til ved positiv respons på leddanestesi av midtre karpalledd. Passiv diffusjon av anestesimiddelet til proksimale innfesting av gaffelbåndet og karpaltunellen skjer etter kort tid da disse strukturene ligger nær hverandre anatomisk (19, 20). Dette må tas med i vurderingen av respons. Injeksjon skjer med løftet bein og flektert ledd (Figur 4).
Proksimale karpalledd lokaliseres ved palpasjon av distale del av radius og proksimale del av radiokarpalbeinet lateralt for sena til M. exstensor carpi radialis. Kanylen (0,8*40 mm) settes 90 grader på huden der leddspalten er lokalisert. Leddkapselen ligger om lag 1,3 cm under huden. Midtre karpalledd lokaliseres ved palpasjon av distale del av radiokarpalbeinet og proksimale del av tredje karpalbein (C3) lateralt for sena til M. exstensor carpi radialis. Kanylen settes 90 grader på hudoverflaten der leddspalten er lokalisert. Leddkapselen ligger om lag 1,3 cm under huden. 5 mL anestesimiddel injiseres for hver avdeling.

Figur 4. Injeksjon av proksimale og midtre carpalledd på løftet og flektert bein sett forfra. Foto: Oddvar Enerstvedt.
Distale glideledd i hasen (tarsometa- tarsalleddet)
Artrocentese av distale glideledd i has blir foretatt over hodet av laterale griffelbein, på den plantarolaterale overflaten av hasen (Figur 5). Denne delen av griffelbeinet lateralt for den overfladiske bøyesena kan palperes. Kanylen (0,8*40 mm) skal ha retning dorsomedialt og litt distalt, leddvæske vil enkelte ganger komme spontant. Injeksjonen kan utføres både på belastet og løftet bein. Injeksjonen skal gå lett, men om det begynner å gå tungt etter noen milliliter, vil økt trykk kunne medføre akkumulasjon av anestesimiddel subkutant (21). Det er viktig å være oppmerksom på at passiv diffusjon av anestesimiddel kan desensibilisere N. metatarsale dorsalis og plantaris, og dermed desensibiliere proximale innfesting av gaffelbåndet 3-5 mL anestesimiddel injiseres.

Figur 5. Injeksjon av distale glideledd (tarsometatarsalleddet) i hasen. Injeksjonen skjer på den plantarolaterale overflaten av hasen. Foto: Oddvar Enerstvedt.
Midtre glideledd i hasen (intertarsalleddet)
Artrocentesen skjer på den distomediale overflaten av haseleddet (Figur 6). Injeksjonen utføres på belastet bein midt mellom den plantare og den dorsale overflaten av distale tarsus. Ved å ta utgangspunkt i distale talus på medialsiden, er det mulig å kjenne en mindre prominerende eminens på Os tarsi centrale like distalt og plantart. Injeksjonsstedet ligger 1,3 cm distalt for denne eminensen og leddkapselen ligger 1,5-2,5 cm under huden. Injeksjonen skal gå lett og uten dannelse av subkutant ødem. Det vil ved riktig plassering av kanylen (0,8*40 mm) være mulig å aspirere noe av medikamentet etter injeksjon. 3-5 mL anestesimiddel injiseres.’
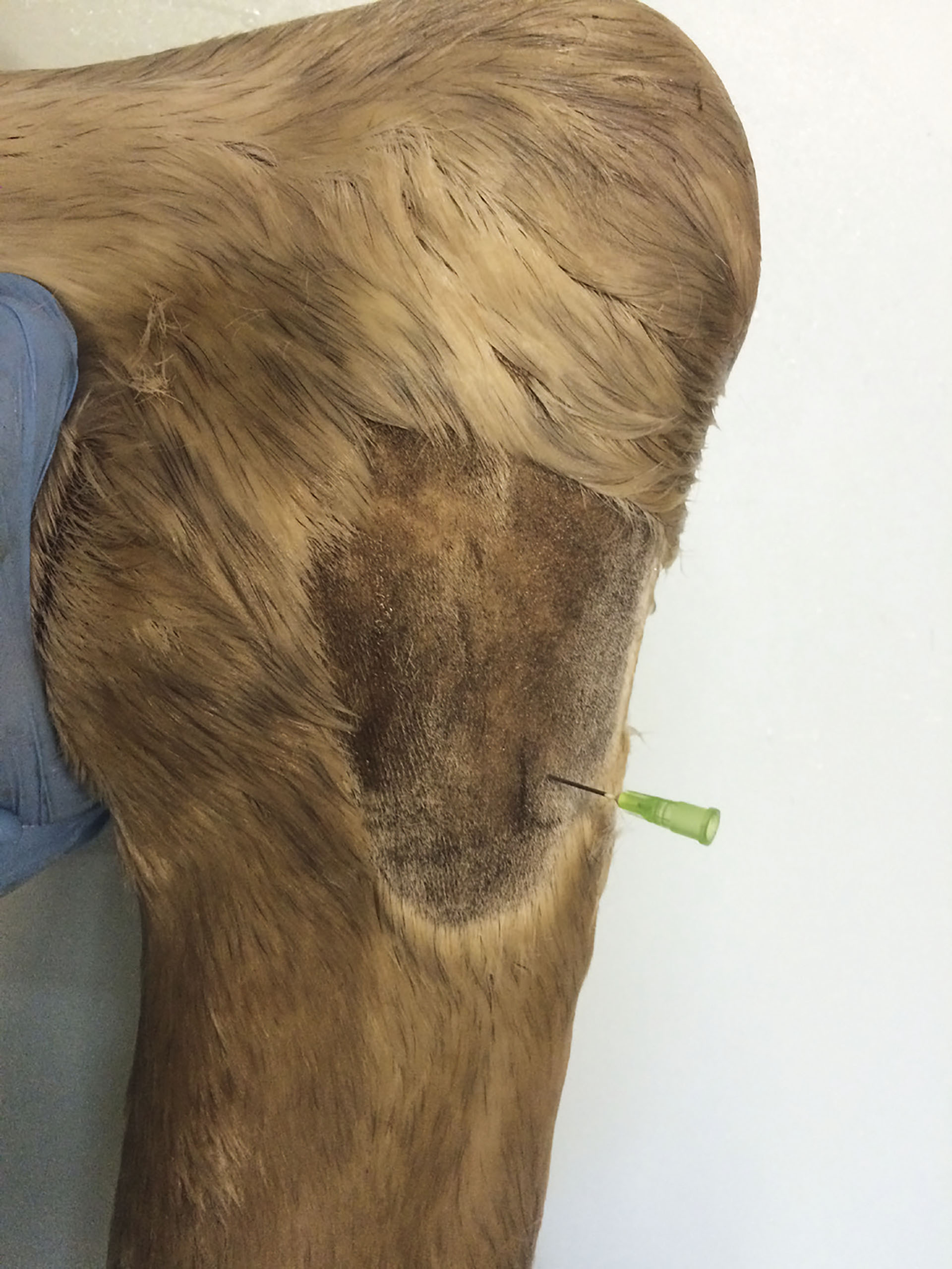
Figur 6. Injeksjon av midtre glideledd (intertarsalleddet) i hasen. Injeksjonen skjer på den distomediale overflaten av hasen. Foto: Oddvar Enerstvedt.
Tibiotarsalledd
Tibiotarsalledd er av de enkleste å injisere. Det er kort avstand inn til leddkapsel (cirka 1,3 cm). Leddet kan injiseres på begge sider av Vena saphena ved den distale delen av den mediale malleolen av tibia. Kanylen (0,8*40 mm) bør ha en laterokaudal retning. 10-20 mL anestesimiddel injiseres.
Bakkne
Bakkneet består av tre avdelinger: det laterale og mediale femorotibialleddet og femoropatellarleddet. Sistnevnte er den største av de tre avdelingene og kommuniserer med det mediale femorotibialleddet hos 65 % av hestene, men kommuniserer sjeldent med den laterale avdelingen (22). Undersøkelser med injeksjon av lateks og kontrast viser diffusjon av lokalanestesi mellom de ulike avdelingene i bakkneet (23). Anestesi av en bestemt avdeling vil derfor også kunne medføre anestesi av de to andre avdelingene.
Injeksjon utføres på belastet bein. Kanylen (1,2*40 mm, kan være nødvendig med 1,3*75 mm for femoropatellarleddet) settes 45 grader oppover i fordypningen mellom mediale og midtre patellarligament, 2 cm distalt for apeks av patella. Før kanylen er på plass må den forsere en relativt tykk fettpute som kan skape problemer. Det er derfor viktig at kanylen er lang nok på store hester.
Den laterale avdelingen av femorotibialleddet er lettest tilgjengelig like kaudalt for M. extensor digitalis longus som ligger kaudalt for det laterale patellarligamentet og kranialt for det laterale kollateralligamentet, like over den proksimale kanten av tibia. Avstanden inn til leddkapsel er cirka 2,5 cm. Injeksjonen skjer på belastet bein, og kanylen settes i medial retning 90° på huden. Leddvæske kan i enkelte tilfeller aspireres. Den mediale avdelingen av femorotibialleddet injiseres mellom mediale kollateralligament og mediale patellarligament like over proksimale del av tibia. Avstanden inn til leddkapsel er omtrent 2 cm. Injeksjon skjer på belastet bein, og kanylen settes 90° på huden i lateral retning. Leddvæske kan i enkelte tilfeller aspireres. 10-20 mL anestesimiddel injiseres.
Anestesi av bursaer og seneskjeder
Hovsenebeinsbursa
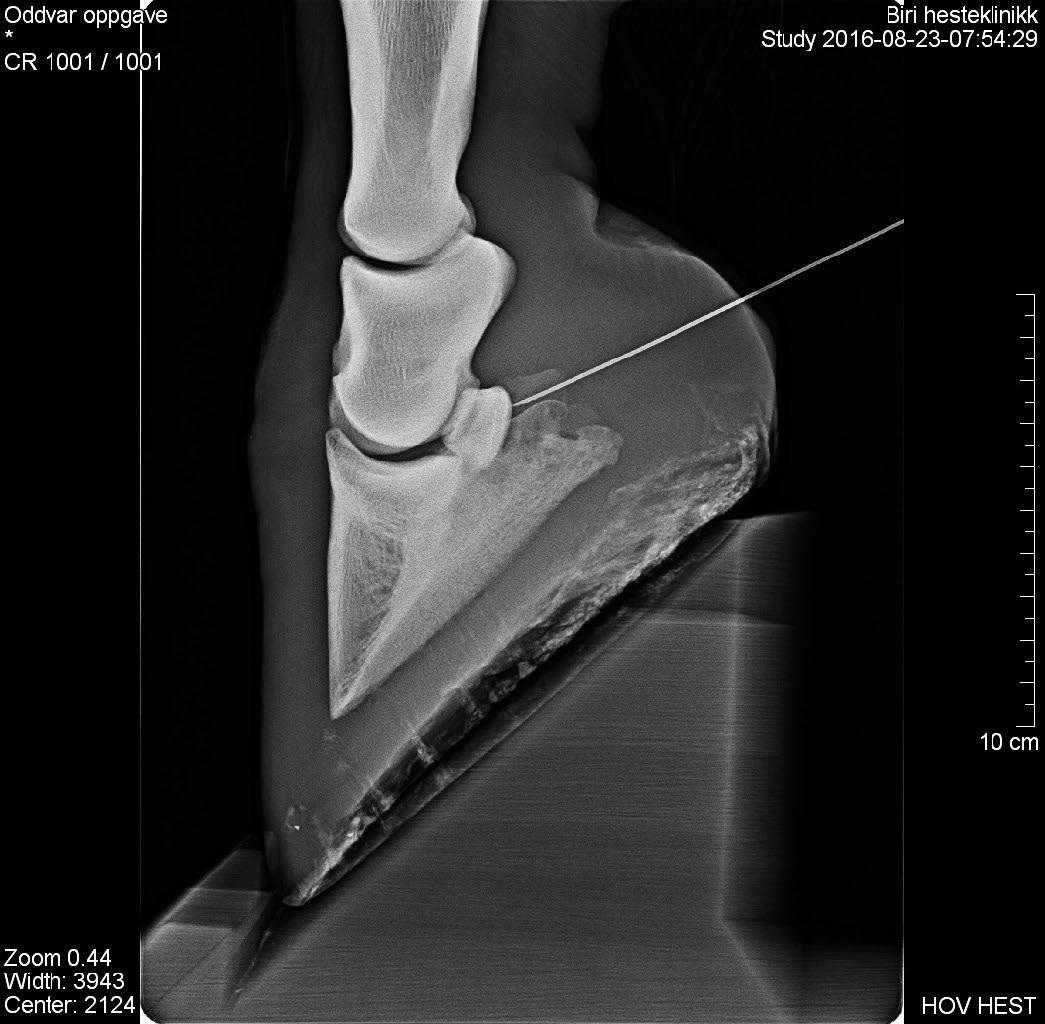
Før injeksjonen utføres er det nødvendig å markere hovsenebeinet med en tusj/tapebit lateralt på hoven 1 cm distalt for kronranden, midt mellom den mest dorsale og den mest palmare/plantare del av kronranden. Hovsenebeinsbursaen nås ved å sette en spinalkanyle (cirka 90 mm) like proksimalt for kronranden midt mellom ballene i ballepartiet, med retning det markerte punktet på lateralsiden (Figur 7). Hoven plasseres på en hovstøtte slik at koden flekteres lett. Når kanylen har nådd bein, vil røntgen eller ultralyd være nyttig for å bekrefte at den ligger på plass (Figur 8). Ved injeksjon skal det være liten motstand. Det er sjelden at aspirasjon gir synovial væske.
Det er også beskrevet en teknikk hvor injeksjonen blir utført fra den laterale overflaten av beinet, like proksimalt for kanten til kollateralbrusken. Kanylen har retning over den dorsoabaksiale overflaten til den dype bøyesena tilnærmet 45° i forhold til horisontalplanet, til den når den proksimolaterale delen av hovsenebeinet. Målet med denne metoden er å unngå penetrasjon av den dype bøyesena (24). En positiv respons på anestesien indikerer at haltheten sitter i hovsenebeinsområdet (14), såleområdet i tåa (24) eller i de distale deler av den dype bøyesena (25, 26). Anestesi av hovsenebeinsbursaen desensibiliserer ikke hovleddet i særlig grad i motsetning til desensibilisering av hovsenebeinsområdet ved hovleddsanestesi (25, 27). 2-4 mL anestesimiddel injiseres.

Figur 7. Injeksjon av hovsenebeinsbursaen. Foto: Oddvar Enerstvedt.
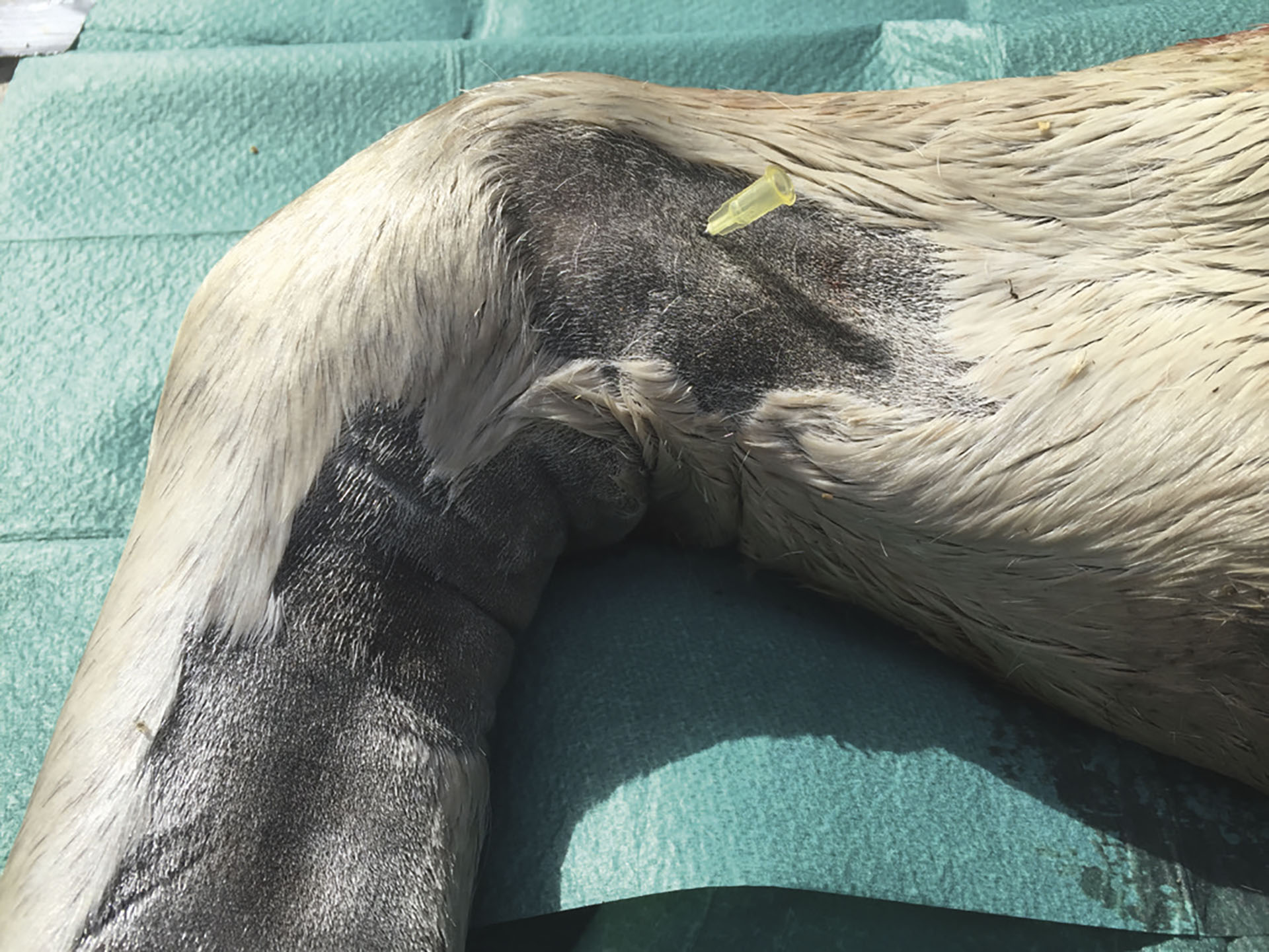
Figur 8. Røntgen av injeksjonen i figur 8 for å bekrefte at kanylen er inne i hovsenebeinsbursaen. Foto: Oddvar Enerstvedt.
Bøyesenenes distale seneskjede
Det finnes flere tilgjengelige utposninger på den distale seneskjede når den er distendert. En hard og øm fylning er tegn på patologi. Ved lett fleksjon av kodeleddet palperes proksimale avgrensning av annularligamentet. Injeksjonen skjer om lag 2,5 cm proksimalt for proksimale avgrensning av laterale kodesenebeinet. Kanylen (0,9*40 mm) settes mellom den overfladiske bøyesena og den laterale greina av gaffelbåndet (Figur 9).
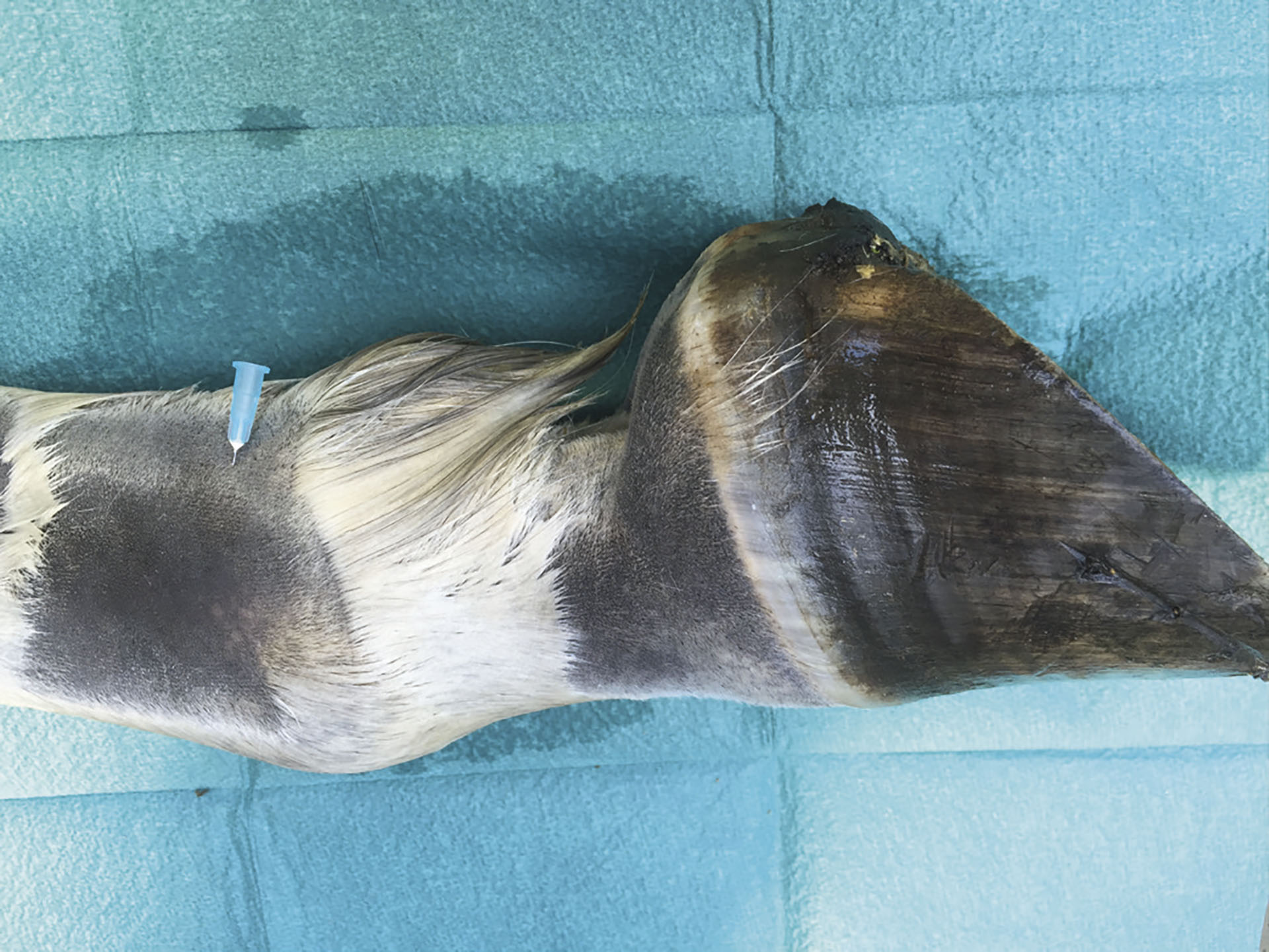
Figur 9. Injeksjon av bøyesenens distale seneskjede sett fra lateralsiden. Foto: Oddvar Enerstvedt.
Smerter fra tå og helregion, hovledd og hovsenebeinsområde påvirkes vesentlig av anestesi av den distale seneskjede (28). Anestesi av den distale seneskjeden bedøver derfor også den overfladiske og dype bøyesene, de rette og skrå distale sesamoidligamentene, annularligamentet ved kodeleddet og den dype bøyesena inne i hoven. 8-10 mL anestesimiddel injiseres.
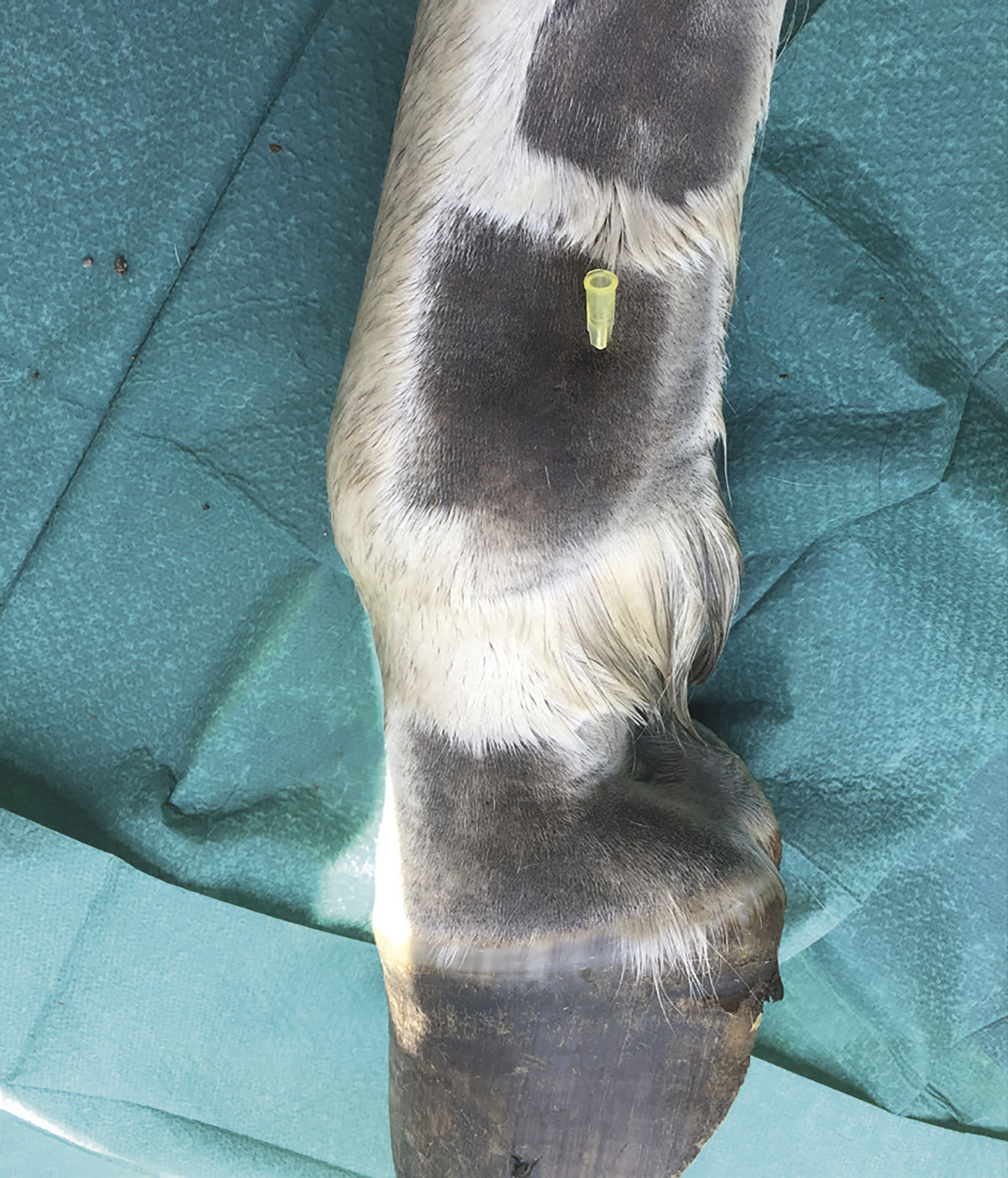
Carpaltunell
Carpaltunellen nås proksimalt for carpus. Anestesien utføres på løftet og flektert bein, og kanylen (0,9*40 mm) settes i en vinkel på cirka 60° i mellomrommet mellom senene til M. ulnaris lateralis og M. extensordigitalis lateralis om lag 1,5 cm distalt for den distale fysen til radius. Denne palperes lettest palmart på distale radius like kranialt for den dype bøyesena (Figur 10).
Figur 10. Injeksjon av carpaltunellen sett fra lateralsiden. Foto: Oddvar Enerstvedt.
En positiv respons på anestesi av karpaltunellen bør alltid tolkes i lys av kliniske tegn som intermitterende halthet, distensjon av karpaltunellen, ofte positiv fleksjonstest av carpus, og andre diagnostiske funn (røntgen, ultralyd). Grunnen til dette er karpaltunellens beliggenhet i forhold til N. palmaris lateralis og medialis og til leddavdelingene i carpus (29). 10-15 mL anestesimiddel injiseres.
Den proksimale seneskjeden til hasens dype bøyesene
Denne seneskjeden strekker seg fra cirka 5 cm proksimalt for den laterale malleolen av tibia til øvre 1/3 av metatarsus og beskytter sena over sustenaculum tali på calcaneus. Det kraftige tarsale retinakelet begrenser utposningen på seneskjeden medialt, mens calcaneus begrenser den lateralt. Proksimal distensjon av seneskjeden vil ses lateralt og medialt i fordypningen mellom sena til calcaneus og kaudale tibia. Det er ikke beskrevet noen landemerker for injeksjonsstedet. Det vil derfor være naturlig å injisere kanylen (0,9*40 mm) i den mest distenderte delen av seneskjeden. 5-10 mL anestesimiddel injiseres.
Perineuralanestesi
Perineuralanestesi er et nyttig hjelpemiddel i halthetsdiagnostikken og i akutte situasjoner for å anestesere områder ved behandling av sårskader eller lignende.
Kodenerveanestesi
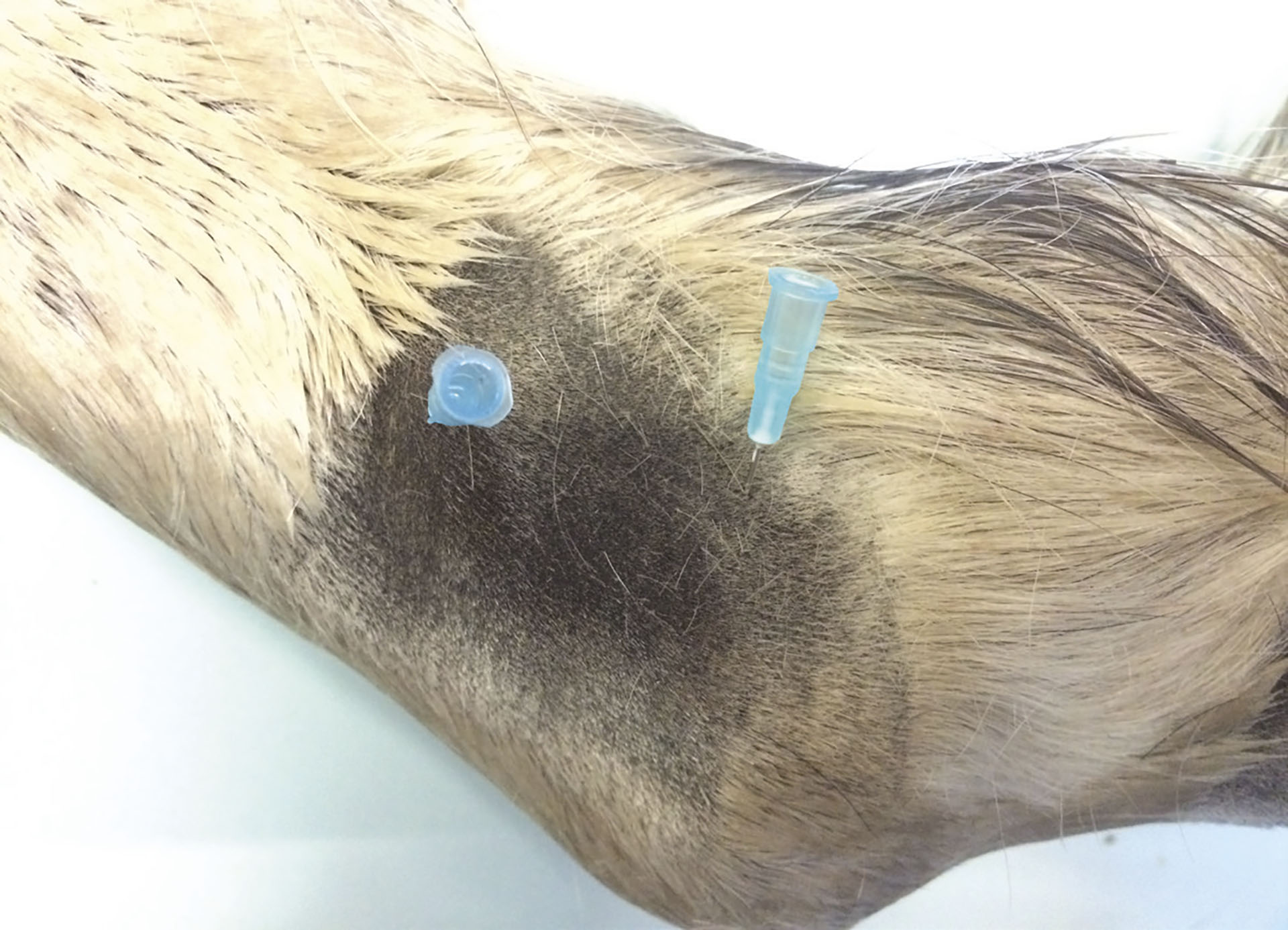
Ved kodenerveanestesi palperes N. digitalis palmaris/plantaris lateralis og medialis like proksimalt for annularligamentet på hver side av kodeleddet (Figur 11). Nerven ligger tett sammen med arterie og vene (vene-arterie-nerve i dorso-palmar/plantar retning).
Figur 11. Kodenerveanestesi: N. palmaris/plantaris lateralis og medialis anesteseres like proksimalt for annularligamentet. Foto: Oddvar Enerstvedt.
Huden løftes lett slik at anestesimiddelet kan deponeres subkutant. Kanylen (0,6*25 mm) føres inn på tvers av nerven, og lokalanestetikum deponeres samtidig som den trekkes sakte tilbake for å unngå deponering intravasalt.
Kodenerveanestesi benyttes for å lokalisere smerte fra og med kodeleddet og distalt. Da N. metacarpale/metatarsale medialis og lateralis innerverer deler av kodeleddet dorsalt, vil ikke kodeleddet kunne anesteseres i sin helhet ved denne metoden (30). 2-5 mL anestesimiddel injiseres for hver palmar-/plantarnerve.
Lav palmar/plantar firepunktsblokk
N. metacarpale/metatarsale lateralis og medialis anesteseres på nivå med den distale delen av laterale og mediale griffelbein. Kanylen (0,8*40 mm) føres inn til knokkel, der anestetikumet deponeres.
På grunn av fare for penetrasjon av den distale seneskjeden, anesteseres N. palmaris/plantaris medialis og lateralis noe mer proksimalt. Disse nervene ligger medialt og lateralt i gropen mellom gaffelbåndet og den dype bøyesena. Nervene anesteseres på løftet bein. Ved lett fleksjon av koden føres kanylen mellom gaffelbåndet og den dype bøyesena, slik at spissen kan palperes gjennom huden på motsatt side. Her deponeres lokalanestetikum, før kanylen trekkes tilbake til lateralsiden hvor ytterligere lokalanestetikum deponeres før den fjernes.
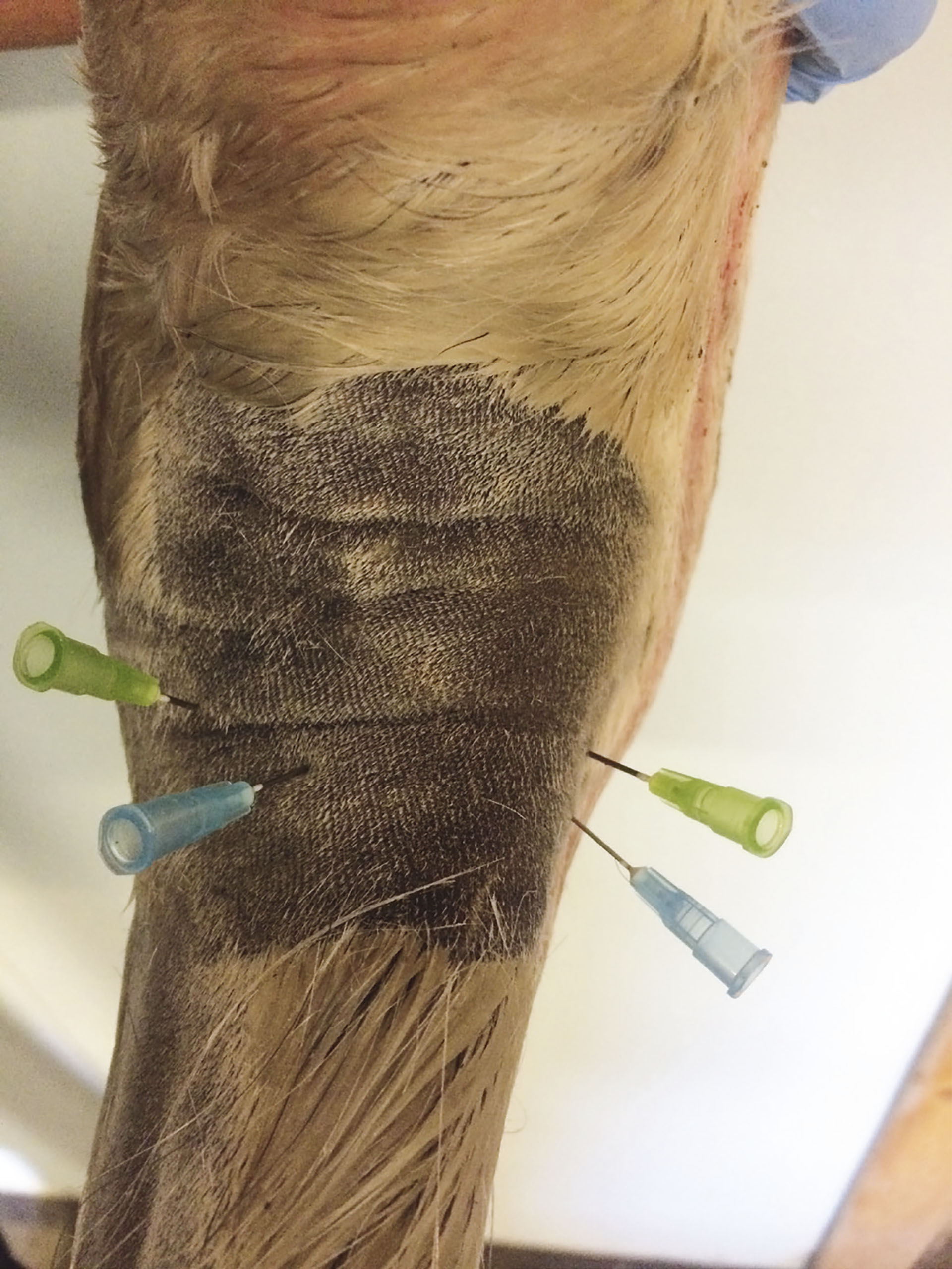
Lav palmar/plantar firepunktsblokk brukes til å lokalisere smerte/halthet fra og med kodeleddet og ned (Figur 12). Den overfladiske og dype bøyesena vil også være bedøvet fra injeksjonsstedet og distalt (30). 2-5 mL anestesimiddel injiseres for hver palmar-/plantarnerve, 1 mL for hver palmar metakarpalnerve/plantar metatarsalnerve.
Figur 12. Lav palmar/plantar firepunktsblokk. N. palmaris/plantaris lateralis og medialis anesteseres mellom gaffelbåndet og den dype bøyesena, grønn kanyle. N.metacarpale/metatarsale lateralis og medialis anesteseres ved den distale delen av laterale og mediale griffelbein, blå kanyle. Foto: Oddvar Enerstvedt.
Høy palmar firepunktsblokk
Ved en høy palmar firepunktsblokk bedøves N. palmaris lateralis og medialis og N. metacarpale lateralis og medialis like distalt for karpometakarpalleddet (Figur 13). Palmarnervene ligger i nedsenkningen mellom den dype bøyesena og gaffelbåndet. Injeksjonen utføres på belastet bein. Kanylen (0,8*40 mm) føres kraniolateralt og kraniomedialt gjennom den tykke fascien og palmart for vene og arterie, mot den laterale og mediale overflaten av den dype bøyesena. 2-5 mL lokalanestesimiddel deponeres nær overflaten av den dype bøyesena. Om det tidligere er lagt en lav palmar blokade, vil N. palmaris lateralis og medialis i tillegg bedøve bøyesenene.
Figur 13. Høy palmar firepunktsblokk. Carpus sett bakfra. N. metacarpale medialis og lateralis bedøves like distalt for carpometacarpalleddet. Illustrert med grønne kanyler. N. palmaris/plantaris lateralis og medialis bedøves i nedsenkningen mellom den dype bøyesena og gaffelbåndet. Illustrert med blå kanyler. Foto: Oddvar Enerstvedt.
N. metacarpale lateralis og medialis bedøves like distalt for karpometakarpalleddet på løftet bein. Nervene ligger mellom den palmare overflaten av pipa og den aksiale overflaten av laterale og mediale griffelbein. Disse innerverer det laterale og mediale interosseusligamentet samt gaffelbåndsutspringet (31, 32). Infiltrasjon av nervene utføres på løftet bein der 2-5 mL lokalanestesimiddel deponeres mellom pipa, gaffelbåndsutspringet og griffelbeina.
Høy palmar firepunkts nerveblokk blir ofte benyttet som det neste steget i en halthetsutredning der lav palmar firepunktsblokk ikke har fjernet smerten. Når huden er desensibilisert på den palmare overflaten under carpus, indikerer dette at prosedyren er korrekt utført.
Høy plantar sekspunktsblokk
Perineuralanestesi av N. plantaris medialis og lateralis, N. plantaris profundus lateralis og medialis og N. plantaris dorsalis lateralis og medialis like distalt for distale glideledd (tarsometatarsalleddet) gir en total analgesi i metatarsalområdet (Figur 14).
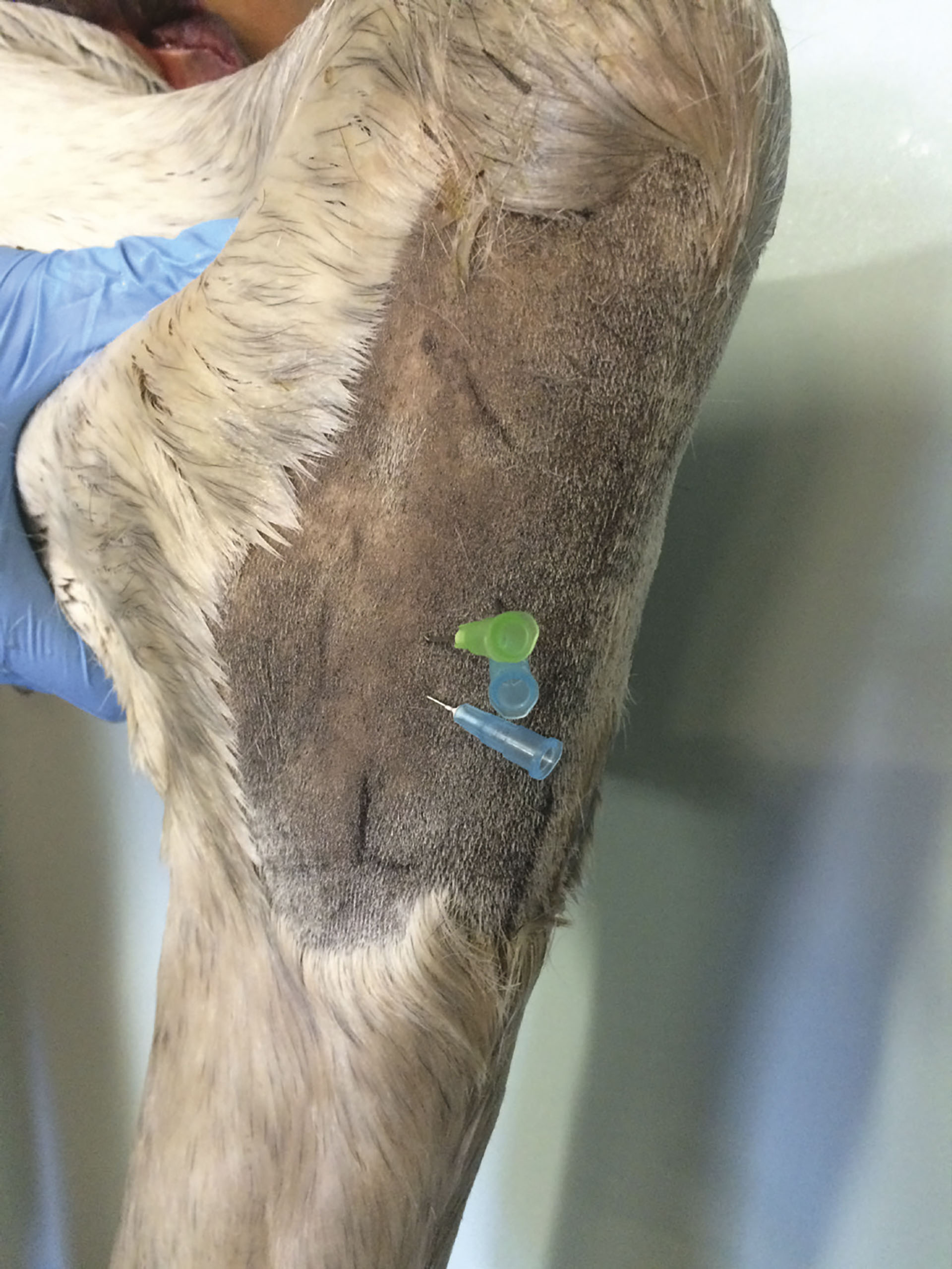
Figur 14. Høy sekspunktsblokk sett fra hasens lateralside. N. plantaris profundus lateralis og medialis bedøves like distalt for distale glideledd. Nerven ligger mellom laterale og mediale griffelbein inn mot pipa, grønn kanyle. N. plantaris medialis og lateralis ligger på den dorsale overflate av den dype bøyesena, illustrert med blå kanyle like distalt for grønn kanyle. N. plantaris dorsalis lateralis og medialis ligger subkutant på lateral- og medialsiden av pipa. Illustrert med den mest distale blå kanylen. Foto: Oddvar Enerstvedt.
N. plantaris lateralis profundus lateralis og medialis anesteseres ved at kanylen (0,8*40 mm) settes inn cirka 1 cm distalt for distale glideledd, like medialt (aksialt) for laterale og mediale griffelbein, til spissen når inn til pipa. 2-5 ml lokalanestetikum deponeres i dette området. Injeksjonen utføres lettest på løftet bein.
N. plantaris medialis og lateralis ligger like ved den dorsale overflaten av den dype bøyesena. Den anesteseres ved at kanylen (0,6*25 mm) føres gjennom den tykke fascien som dekker det plantare aspektet av tarsometatarsalområdet. Subkutan deponering av 2-3 ml lokalanestesi dorsomedialt og dorsolateralt på pipa vil anestesere N. plantaris dorsalis lateralis og medialis (Kanyle 0,6*25 mm).
Diskusjon
Halthetsundersøkelse
Ved smerte vil kroppen unngå å belaste et skadet område. Det er derfor viktig å foreta en nøye vurdering hvorvidt mangel på smerte vil kunne føre til ytterligere forverring av en skade. Der symptomene er av en slik art at det kan være mistanke om fraktur eller omfattende ledd-, sene- eller ligamentskader er reduksjon av smertefølelse kontraindisert. I slike tilfeller er det optimalt å immobilisere skadet område (ved fraktur med spesialskinne) for å hindre at hesten tar full støtte på beinet, før hesten transporteres forsiktig til klinikk for videre undersøkelse. Vurdering av eutanasi på stedet vil selvsagt være et moment ved alvorlige skader, og beror på en dyrevelferdsmessig vurdering.
Ofte er det vanskelig kun ved klinisk undersøkelse å lokalisere hvor smerten kommer fra. I slike tilfeller kan diagnostiske injeksjoner med et lokalanestetikum være nyttig. Hos sportshester som presenteres med haltheter sannsynligvis relatert til ledd eller andre synoviale strukturer, kan leddanestesi være et indisert diagnostisk hjelpemiddel. En effektiv leddanestesi indikerer at intrasynovial behandling med et antiinflammatorisk middel vil være indisert. Enkelte veterinærer velger å behandle intraartikulært samtidig som anestesien blir utført, og unngår dermed en artrocentese nummer to med forøket blødningsrisiko. Selv om denne praksisen er relativt vanlig finnes det lite eller ingen informasjon om hvordan anestesimidler og antiinflammatoriske midler påvirker hverandre (29).
Ved perineuralanestesi er en systematisk tilnærming viktig, ved å starte distalt og undersøke små definerte regioner i proksimal retning. Etter at perineuralanestesien har sluttet å virke, kan både intrasynovial anestesi og infiltrasjonsanestesi (punktblokade) benyttes videre i findiagnostikken. I hvilken rekkefølge man velger å benytte de diagnostiske metodene, kommer an på funn man har etter den kliniske undersøkelsen og en eventuell fleksjonstest.
Vurdering av halthet ved å observere hestens bevegelsesmønster vil alltid være subjektiv. Erfaring og inngående anatomisk kunnskap danner basis for en korrekt diagnose. Alle typer diagnostiske injeksjoner etterfølger en nøye undersøkelse som også kaninnbefatte mønstring med bøyeprøver, longering, eller se hest under rytter eller i løpsfartpå travbane. Når anestesien har begynt å virke må hesten mønstres på nytt for å vurdere effekten av anestesien. Det har i de senere år kommet flere metoder for objektiv halthetsvurdering på markedet. De fleste er basert på sensorer som festes til hesten og registrerer abnormaliteter i hestens bevegelsesmønster. Dette er et hjelpemiddel som sammen med diagnostiske injeksjoner kan vise seg nyttig i kasus der den tradisjonelle halthetsdiagnostikk alene ikke fører til et tilfredsstillende resultat.
Komplikasjoner
Diagnostiske injeksjoner er mye brukt i halthetsdiagnostikk hos hest, men det er viktig å ha gode rutiner for å unngå komplikasjoner. De vanligste komplikasjonene ved arthrocentese er septisk artritt, reaktiv synovitt, hemartrose eller at kanylen brekker.
Septisk artritt
Septisk artritt er sjelden forekommende etter leddanestesi da det ikke deponeres medikamenter som i vesentlig grad nedsetter den naturlige synoviale forsvarsmekanismen. Skulle det likevel introduseres bakterier i en slik mengde at leddet ikke klarer å forhindre kolonisering, vil det utvikle seg en kraftig inflammasjonsreaksjon etter noen dager. Pasienten får da varierende grad av de klassiske inflammasjonssymptomene: varme, fylning i ledd, feber og halthet. Ved mistanke om septisk artritt tas prøve av leddvæsken for mikrobiologisk dyrkning, cytologisk undersøkelse og proteinanalyse. En tåkete og uklar leddvæske vil styrke mistanken. Undersøkelse av leddvæsken fra et septisk ledd viser en økning i antallet leukocytter (>5,0*109/L) med et nøytrofilt bilde og totalprotein >25 g/L (33).
Behandling på tidlig stadium vil være avgjørende for et godt resultat. Skylling av leddet enten stående eller ved artroskopi med store mengder sterilt fysiologisk saltvann for å fjerne bakterier, inflammasjonsprodukter og devitalisert vev er like viktig som antibiotikabehandling. Systemisk bredspektret antibiotikabehandling bør startes umiddelbart, og justeres etter svar fra dyrkningsprøve. Det henvises til Terapianbefalingene om bruk av antibakterielle midler til hest (34) for nærmere beskrivelse av diagnostikk og behandling ved septisk artritt.
Reaktiv synovitt
Reaktiv synovitt («joint flare») er en aseptisk inflammasjonsreaksjon på et preparat injisert intraartikulært (35). Reaksjonen viser seg vanligvis få timer etter injeksjon og kan vare opptil 4-6 uker (36). Det kan være vanskelig å skille reaktiv synovitt fra en septisk artritt da symptomene er relativt like både i klinisk og cytologisk (35). Hemartrose er blødning i ledd enten som følge av artrocentese eller traume. Tilstanden gir akutt halthet og moderat hevelse i leddet. Ubehandlet kan dette føre til synovitt og osteoarthrose (37). Diagnose og behandling vil være aspirasjon av så mye blod som mulig fra leddet.
Komplikasjoner ved perineuralanestesi
Komplikasjoner ved perineuralanestesi er sjelden og sees enten som lokal reaksjon på anestesimiddelet eller infeksjon som følge av kontaminasjon. Det kan være vanskelig å fastsette hvilken av de to årsakene reaksjonen kommer av. I tvilstilfeller vil det derfor være naturlig å behandle disse tilfellene som en bakteriell infeksjon.
Brukket kanyle
Det er sjelden kanylen knekker ved injeksjon i ledd. Det er likevel viktig å ta visse forhåndsregler, og den aller viktigste er å få hesten til å stå stille når den injiseres. Sedasjon med kortvarig durasjon kan benyttes, men ved leddanestesi vil det i de fleste tilfeller være nok med en brems på mule eller øre. Fleksible engangskanyler som bøyer seg og ikke knekker så lett bør brukes. Der hvor avstanden inn til leddkapsel er lang kan en spinalkanyle benytte. Disse har en tendens til å bøye seg uten å knekke. Har kanylen først bøyd seg, bør den trekkes forsiktig ut i samme retning som den er bøyd slik at den kommer ut hel.
Sammendrag
De fleste patologiske tilstander i hestekroppen kan føre til halthet, men majoriteten av problemene vil komme fra beinet selv. Diagnostiske ledd- og perineuralanestesier benyttes for å lokalisere eller bekrefte smerte i ekstremitetene. Det har vist seg at spesifisiteten av de nevnte anestesiene ikke er like høy som tidligere antatt, på grunn av problemet med rask diffusjon til omkringliggende strukturer og vev. Stadig utvikling av nye, og forbedring av allerede eksisterende diagnostiske hjelpemidler har ført til bedre forståelse av informasjonen vi får ved bruk av de ulike diagnostiske anestesiteknikkene.
Denne artikkelen gjennomgår konkret utførelse av de vanligste anestesiteknikkene i halthetsutredning av hest. Alle ledd samt de mest aktuelle seneskjeder, bursaer og nerver fra og med carpus og bakkne og distalt for disse er inkludert, til bruk for studenter og praktikere med et innslag av hest i sin praksis.
Summary
DIAGNOSTIC INJECTIONS IN EVALUATION OF LAMENESS IN THE HORSE
Even if pathological processes in other organs than the organs related to locomotion may cause lameness, the vast majority of problems originate from the extremity itself. Both diagnostic joint blocks and perineural blocks are used to locate the pain. A constant development of new and improvement of existing diagnostic tools has led to better understanding of the information obtained using the various diagnostic techniques. This paper is a review of common anesthetic techniques used when locating lameness in the horse. All joints, including the carpus and the stifle joint, as well as the most relevant tendon sheaths, bursae and nerves located distal to these joints are comprised. Further, complications and limitations of diagnostic injections are discussed.
Etterskrift
Jeg ønsker å takke Carl Fredrik Ihler for svært god veiledning og oppfølging under arbeidet med denne publikasjonen. Carl Fredrik gikk bort så alt for tidlig høsten 2021 etter noe tids sykdom. Han lot meg begynne ved Biri Hesteklinikk høsten 2003 og lot meg overta klinikken våren 2019. I min studietid og i arbeidslivet har han vært en engasjert og velvillig mentor det alltid har vært lett å kontakte for støtte og gode råd. Han har vært helt sentral i planlegging av så vel som skriveprosessen med denne artikkelen.
Referanser
Steffey EP, Booth NH. Local anesthetics. I: Adams RH, ed. Veterinary pharmacology and therapeutics. 7th ed. Ames, Iowa: Iowa State University Press, 1995:358-71.
Stashak TS. Examination for lameness. I: Adams` lameness in horses. 5th ed. Philadelphia: Lippincott Williams & Wilkins, 2002:113-83.
Specht TE, Nixon AJ, Moyer DJ. Equine synovia after an intra-articular injection of lidocaine or mepivacaine. Vet Surg 1988;17:42.
Khursheed RM, Eugene PS. Local anesthetics. I: Adams RH, ed. Veterinary pharmacology and therapeutics. 8th ed. Ames, Iowa: Iowa State University Press, 2001:343-59.
Guyton AC, Hall JE. Textbook of medical physiology. 9th ed. Philadelphia: WB Saunders, 1996.
Catterall W, Mackie K. Local anesthetics. I: Hardman JG, Limbird PB, Molinoff PB, Ruddon RW, Gilman AG, eds. Goodman and Gilman`s the pharmacological basis of therapeutics. 9th ed. New York: McGraw-Hill, 1996:331-47.
Wong K, Strichartz GR, Raymond SA. On the mechanisms of potentation of local anesthetics by bicarbonate buffer: drug structure-activity studies on isolated peripheral nerve. Anesth Analg 1993;76:131-43.
Whitton CR, Hodgson DR, Rose RJ. Musculoskeletal system I: Rose RJ, Hodgson DR, eds. Manual of equine practice. Sydney: WB Saunders, 1993:95-119.
Wyn-Jones G. Equine lameness. Oxford: Blackwell Scientific Publications, 1988: 1-22.
Andreen DS, Trumble TN, Caron JP, Decamp CE, Hauptman J, Stick JA. Onset and duration of intra-articular mepivacaine in the horse. Proceedings of 40th Annual Convention of the American Association of Equine Practitioners 1994;151.
Nagy A, Bodo G, Dyson SJ, Szabo F, Barr ARS. Diffusion of contrast medium after perineural injection of the palmar nerves: an in vivo and in vitro study. Equine Vet J 2009;41,379-83.
NMBU. Institutt for sports- og familiedyrmedisin. Seksjon for hestesjukdommer. Hygieneinstruks. Oslo 2013.
Pleasant RS, Moll HD, Ley WB, Lessard P, Warnick LD. Intra-articular anesthesia of the distal interphalangeal joint alleviates lameness associated with the navicular bursa in horses. Vet Surg 1997;26:137-40.
Dyson SJ, Kidd L. A comparison of responses to analgesia of the navicular bursa and intra-articular analgesia of the distal interphalangeal joint in 59 horses. Equine Vet J 1993;25:93-8.
Schumacher J, Steiger R, Schumacher J, DeGraves F, Schramme M, Smith R et al. Effects of analgesia of the distal interphalangeal joint or palmar digital nerves on lameness caused by solar pain in horses. Vet Surg 2000;29:54-8.
Dyson SJ, Murray RC, Schramme M, Branch M. Lameness in 46 horses associated with deep digital flexor tendonitis in the digit: diagnosis confirmed with magnetic resonance imaging. Equine Vet J 2003;35:681-90.
Schumacher J, Schumacher J, DeGraves F, Steiger R, Schramme M, Coker M. A comparison of the effects of two volumes of local analgesic solution in the distal interphalangeal joint of horses with lameness caused by solar toe or solar heel pain. Equine Vet J 2001;33:265-8.
Bowker RM, Rockershouser SJ, Vex KB, Sonea IM, Caron JP, Kotyk R. Immunocytochemical and dye distribution studies of nerves potentially desensitized by injections into the distal interphalangeal joint or the navicular bursa of horses. J Am Vet Med Assoc 1993;203:1708-14.
Ford TS, Ross MW, Orsini PG. A comparison of methods for proximal palmar metacarpal analgesia in horses. Vet Surg 1989;18:146-50.
Moyer W, Ford TS, Ross MW. Proximal suspensory desmitis. Proceedings of the 34th Annual Convention of the American Association of Equine Practitioners 1988:409-12.
Kraus-Hansen AE, Jann HW, Kerr DV, Fackelmann GE. Arthrographic analysis of communication between the tarsometatarsal and distal intertarsal joints of the horse. Vet Surg 1992;21:139-44.
Reeves MJ, Trotter GW, Kainer RA. Anatomical and functional communications between the synovial sacs of the equine stifle joint. Equine Vet J 1991;23:215-8.
Gough MR, Munroe GA, Mayhew IG. Diffusion of mepivacaine between adjacent synovial structures in the horse. Part 2: tarsus and stifle. Equine Vet J 2002;34:85-92.
Daniel AJ, Goodrich LR, Barrett MF, Werpy NM, Morley PS, McIlwraith CW. An optimised injection technique for the navicular bursa that avoids the deep digital flexor tendon. Equine Vet J 2016;48:159-64.
Dyson SJ. The puzzle of distal interphalangeal joint pain. Equine Vet Educ 1998;10:119-25.
Schramme MC, Dyson S, Murry R, Branch M. Soft tissue pathology in horses with navicular syndrome – MRI Results. Proceedings of the 1st World Orthopaedic Veterinary Congress. München 2002: 177.
Schumacher J, Schumacher J, Gillette R, DeGraves F, Schramme F, Smith M et al. The effects of local anaesthetic solution in the navicular bursa of horses with lameness caused by distal interphalangeal joint pain. Equine Vet J 2003;35:502-5.
Harper J, Schumacher J, DeGraves F, Schramme M, Schumacher J. Effects of analgesia of the digital flexor tendon sheath on pain originating in the sole, distal interphalangeal joint or navicular bursa of horses. Equine Vet J 2007;39: 535-9.
Nixon AJ. Carpal canal syndrome. I: White NA, Moore JN, eds. Current practice of equine surgery. Philadelphia: Lippincott Williams & Wilkins, 1990:461-4.
Barr ARS, Musculoskeletal diseases. I: Taylor FGR, Hillyer MH, eds. Diagnostic techniques in equine medicine. London: WB Saunders, 1997:231-70.
Derksen EJ. Diagnostic local anesthesia of the equine front limb. Equine Pract 1980;2(1):41-7.
Sack WO. Nerve distribution in the metacarpus and front digit of the horse. J Am Vet Med Assoc 1975;167:298-305.
Steel C, Pannirselvam RR, Anderson GA. Risk of septic arthritis after intra-articular medication: a study of 16,624 injections in thoroughbred racehorses. Aust Vet J 2013;91:268-73.
Statens legemiddelverk. Terapi- anbefaling: Bruk av antibakterielle midler til hest. Oslo 2019. https://legemiddelverket. no/veterinermedisin/terapianbefalinger/ bruk-av-antibakterielle-midler-til-hest (14.2.2022).
Singer ER. Clinical challenges of persistent articular sepsis. Equine Vet Educ 2008;20:353-6.
Oke S. Joint injections: pros and cons. The Horse 2008. http://thehorse.com/articles/22037/joint-injections-pros- and-cons
Judy CE, Galuppo LD. Evaluation of iatrogenic hemarthrosis of the metacarpophalangeal joint as a method of induction of temporary reversible lameness in horses. Am J Vet Res 2005;66:1084-9.
For ytterligere illustrasjoner og lesning om emnet anbefales:
Moyer W, Schumacher J, Schumacher J. Equine joint injection and regional anesthesia. 5th ed. Chadds Ford, Pennsylvania: Academic Veterinary Solutions, 2011.