Behandlingsalternativer for ureterale obstruksjoner hos katt
– Ett kasus behandlet med subkutan ureteral bypass (SUBTM) bilateralt med 6 måneders intervall
Ureterale obstruksjoner hos katt er en utfordrende og krevende tilstand. Den optimale behandlingsmetoden debatteres innen veterinærmedisinen. I 2009 ble det utarbeidet en ny kirurgisk prosedyre, subkutan ureteral bypass (SUBTM) for behandling av ureterale obstruksjoner hos katt. Denne operasjonsmetoden har vist seg å ha en bedre prognose på lang sikt enn de andre kirurgiske behandlingsformene, og anvendes i både Europa og USA (1).
Kasuistikken presenterer anvendelsen av SUBTM på en katt med obstruksjon i først venstre ureter og deretter høyre ureter 6 måneder senere. Artikkelen diskuterer mulige komplikasjoner forbundet med anvendelse av SUBTM, samt indikasjoner, risiko, prognose og den postoperative oppfølgingen inkludert skylling av SUBTM-kateteret.
Veterinær, Fredrikstad Dyrehospital
Denne artikkelen er skrevet som et ledd i forfatterens spesialisering i smådyrsykdommer – hund og katt.
Introduksjon
Etiologi
Nefrolitter hos katt er som regel uproblematiske så lenge de ikke migrerer og leder til obstruksjon av nyrepelvis eller ureter, residiverende pyelonefritter eller skader på nyreparenkymet som medfører kronisk nyresvikt (2, 3). Den vanligste indikasjonen for behandling av øvre urolitter hos katt er ureteral obstruksjon (2-4). Ureterolitter av typen kalsiumoksalat opptrer i 98 % av tilfellene, og er den vanligste årsaken til ureteral obstruksjon hos katt (2,5-7). Kalsiumoksalat ureterolitter kan ikke løses opp medisinsk, slik at de enten må passere spontant eller fjernes kirurgisk (2, 3). Andre årsaker til ureteral obstruksjon er strikturer, infeksjoner, blodkoagler, fibroser, iatrogen ligering ved kastrasjon eller neoplasi (7). I 20-25 % av tilfellene er det rapportert bilateral obstruksjon (2). Den underliggende årsaken til at nefrolitter dannes er ikke klarlagt, men det er observert en sterk korrelasjon mellom kronisk nyresykdom og dannelsen av kalsiumoksalat nefrolitter. Enkelte raser som persere, Himalaya katt og hellig birma har en økt prevalens for dannelsen av kalsiumoksalat nefrolitter, noe som indikerer en genetisk predisposisjon (7).
Patofysiologi
Ved obstruksjon av ureter vil trykket i nyrepelvis øke. Dette medfører dilatasjon av nyrepelvis og ureter med påfølgende akutt nyresvikt og permanente nyreskader dersom obstruksjonen ikke dekomprimeres innen kort tid. Trykkøkningen vil medføre et fall i den renale blodgjennomstrømningen med 60 % i løpet av de første 24 timene og 80 % i løpet av de første 2 ukene (2, 7, 8). Den glomerulære filtrasjonsraten (GFR) vil også falle og kompensatoriske mekanismer settes i gang for å opprettholde blodstrømmen til nyren. Dersom den kontralaterale nyren har normal funksjon, vil denne kompensere ved å hypertrofiere og opprettholde normal GFR. Jo lengre obstruksjonen vedvarer uten intervensjon, desto mer permanent nyreskade oppstår. Partielle obstruksjoner har en langsommere progresjon og resulterer i mindre alvorlige nyreskader. Både partiell og fullstendig obstruksjon krever en rask intervensjon for å hindre ytterligere skade på nyreparenkymet og bevare nyrens restkapasitet (2). Over 80-90 % av obstruksjonene er angitt å være partielle på katt basert på antegrad ureteropyelografi (3, 9).
Kliniske tegn
Katter med ureteral obstruksjon viser ofte vage, uspesifikke, intermitterende kliniske tegn som nedstemthet og anoreksi (38-85 %), oppkast (15-48 %), vekttap (15-58 %), polyuri/polydipsi (18-25 %) og abdominale smerter (8 %) (7). Kliniske tegn fra nedre urinveier som dysuri, stranguri, hematuri og pollakuri kan også forekomme (7). Det er angitt at 33 % også har bakteriell cystitt (2). Unilateral ureteral obstruksjon hos katter kan være uten kliniske tegn dersom den kontralaterale nyren er velfungerende og de ikke lider av andre komorbiditeter (7). Når katter først diagnostiseres er de som regel kritisk syke med varierende grad av akutt nyresvikt og elektrolyttforstyrrelser (7).
Diagnostikk
Diagnostisk utredning inkluderer blodanalyser, urinanalyser og bildediagnostikk i form av røntgen, ultralyd og i noen tilfeller CT. Katter er i 68 % av tilfellene angitt å være anemiske ved presentasjonen, som regel assosiert med en underliggende kronisk nyresykdom (7). Azotemi er registrert i 95 % av tilfellene, etterfulgt av elektrolyttforstyrrelser som hyperfosfatemi, hyperkalemi, hypokalsemi eller hyperkalsemi (7, 8). Urinanalyse kan avdekke isostenuri, hematuri, pyuri, krystalluri og bakteriuri. Røntgen vil kunne avdekke røntgentette urolitter, enten i nyrepelvis, i ureter eller i begge områder. Urolitter mindre enn 2 mm vil som regel ikke kunne ses på røntgen (7). I enkelte tilfeller må det utføres en antegrad pyelografi eller retrograd ureteropyelografi for å kunne avdekke en obstruksjon (7, 8).
Renomegali, irregulær nyreform eller en stor og en liten nyre kan også ses på røntgen. Røntgendiagnostikk alene har en sensitivitet på 81 % for å avdekke ureterolitter, mens den øker til 90 % i kombinasjon med ultralyd (7, 8). Ultralyd vil gi en mer detaljert evaluering, og er essensielt for å identifisere antallet og lokalisasjon av ureterolitter, hydronefrose, hydroureter, samt forandringer i nyreparenkymet, pyelonefritter eller retroperitoneale effusjoner (7). Som regel vurderes dilatasjon av nyrepelvis over 3,5 mm i diameter som unormalt. Dette kan også ses ved andre lidelser som pyelonefritt og kronisk nyresvikt (CKD). En dilatasjon på over 13 mm brukes som en «cut-off»-verdi for å skille de obstruktive fra de ikke-obstruktive årsakene til hydronefrose. Ved partielle obstruksjoner derimot kan nyrepelvis være under 2 mm i diameter (10).
Medisinsk behandling
Medisinsk behandling går primært ut på å korrigere azotemi, dehydrering, elektrolyttforstyrrelser, smerter og eventuelle infeksjoner. Det andre målet er å få urolittene til å passere ved å øke diuresen med væskebehandling og bruke ureterale muskelrelakserende medikamenter og alfa-1 antagonister (3, 7, 8). Mannitolinfusjon kan benyttes for å øke den osmotiske diuresen i håp om å «dytte» urolittene igjennom. Bruken av mannitol er kontraindisert ved anuri og skal heller ikke anvendes på katter med underliggende hjertesykdom (7). Prazosin (0,25 mg/katt BID) og tamsulosin (0,004-0,006 mg/kg BID) er alfa-1 antagonister som relakserer den glatte muskulaturen i ureter, hvor tamsulosin har vist seg å ha bedre effekt på hund (8). Amitryptylin (0,5-2 mg/kg SID) relakserer den glatte muskulaturen via kaliumstyrte kanaler og har vist seg å ha effekt på uretrale obstruksjoner hos hannkatter samt relaksering av uretersegmenter hos menneske og gris (8, 11). Urinveisinfeksjoner og pyelonefritter behandles med antibiotika dersom dyrkningssvar med resistensbestemmelse begrunner dette. Utfallet av medisinsk behandling alene er imidlertid sjeldent vellykket. I 17 % av tilfellene i en studie var det dokumentert passasje av urolittene og kun 13 % hadde signifikant forbedring av azotemien (12). Dersom en obstruksjon, spesielt en fullstendig obstruksjon, ikke løses innen 48-72 timer eller de kliniske tegnene forverres, anbefales kirurgisk intervensjon (3).
Tradisjonell kirurgisk behandling
De tradisjonelle kirurgiske behandlingsformene som har blitt anvendt inkluderer ureterotomi, ureteroneo-cystostomi og ureteronefrektomi (12-14). Siden diameteren på ureter hos katt bare er 0,4 mm, er denne form for kirurgi teknisk krevende (13).
Ureterotomi er mikrokirurgi der det benyttes operasjonsmikroskop for å kunne fjerne urolitten(e) via incisjon i ureter (12, 13). Ureteroneocystotomi kan utføres dersom urolitten er lokalisert i den distale 2/3 del av ureter hvor den delen av ureter som inneholder urolitten dissekeres vekk og den resterende stumpen implanteres i blæreveggen. For å unngå tensjon ved anastomosen må nyren flyttes kaudalt (renal descensus) og blæren mer kranialt (cystopeksi) (12). Ved ureteronefrektomi fjernes hele nyren sammen med ureter, men dette er kun egnet for ikke-azotemiske katter med normal GFR i den kontralaterale nyren. Hos katt har disse kirurgiske metodene vist seg å gi post-operative komplikasjoner i 30 % av tilfellene, blant annet urinlekkasje, uremisk peritonitt og stenoser. Dødelighetsraten har ligget mellom 18 % og 30 %, avhengig av anvendt metode (12). Ureteronefrektomi er forbundet med lavest komplikasjonsrate, men er likevel forbundet med dårlig prognose da kattene oftest presenteres med azotemi, samt at 85 % av kattene har nefrolitter i den kontralaterale nyren ved behandlingstidspunktet. Det er også rapportert at i 40 % av tilfellene oppsto det nye obstruksjoner i den kontralaterale nyren (12).
Siden de tradisjonelle operasjons-metodene har vært forbundet med dårlig prognose har det blitt utviklet nyere behandlingsmetoder som stenting og subkutan ureteral bypass (SUBTM). I motsetning til de tradisjonelle metodene hvor obstruksjonen fjernes så forbigås obstruksjonen med de nye metodene.
Stenting
Stenting tillater en passiv ureteral dilatasjon som gir lettere passasje av ureterolittene. Fordelen er at stenten kan fjernes eller byttes ut dersom den skaper irritasjon eller infeksjon. De fleste kattene krever laparotomi for plassering av stenten som kan utføres antegrad med direkte punktering av nyrepelvis med en nefrotomi nål eller ved retrograd cystotomi. Intraoperativ fluoroskopi er essensielt for riktig plassering i ureter og nyrepelvis. I noen tilfeller må det utføres en ureterotomi for å få stenten forbi obstruksjonen (8, 13, 14). Ifølge en studie hadde stenting en suksessrate på 95 % med lav komplikasjonsrate (9). Intraoperative komplikasjoner forbundet med denne metoden inkluderer ruptur av ureter, stentmigrering og behov for ureterotomi. De vanligste postoperative komplikasjonene er urinlekkasje med uroabdomen og migrering eller irritasjon av stenten. Langtidskomplikasjoner inkluderer re-obstruksjon, stentmigrering, uretritt, infeksjon, irritasjon og dannelsen av belegg på stenten (13-15). I en undersøkelse måtte stenten byttes ut i 27 % av tilfellene, enten på grunn av re-obstruksjon, migrering eller vedvarende infeksjon eller inflammasjon (15).
Subkutan ureteral bypass (SUBTM)
Den nyeste metoden som er utviklet er subkutan ureteral bypass (SUBTM). SUBTM gjør at urinen går utenom ureter, gjennom et kateter. Kateteret er fiksert i nyrepelvis og koblet til urinblæren via en shunting SwirlPortTM (mansjettport) som er under huden. Dette tillater både spyling av systemet og prøveuttak av urin. En viktig fordel med SUBTM er holdbarheten (1, 2, 8, 13). «Locking-loop» systemet hindrer migrering av instrumentet i tillegg til at denne ikke danner et belegg i motsetning til en stent (8). Mansjettporten i huden tillater også jevnlig prøveuttak av urin og skylling av systemet slik at risikoen for mineralisering og biofilmdannelse reduseres. Komplikasjoner som kan forekomme er lekkasje, knekk på kateteret, tetting av kateteret med blodkoagler, urinveisinfeksjoner og mineralisering (1, 8, 13, 16-18).
Kasuistikk
Signalement og anamnese
En 10 år gammel sterilisert hunnkatt som veide 3,5 kg ble presentert på vakt etter at den hadde blitt akutt dårlig med nedstemthet, smerter og anoreksi. Sykdomshistorikk omfattet residiverende, bilaterale pyelonefritter. Det var også kjent fra tidligere at den hadde bilaterale nefrolitter.
Klinisk undersøkelse
Kattens allmenntilstand var redusert, men den var alert med rektal temperatur 40,2 ˚C. Ved auskultasjon av hjertet var det en jevn rytme på 180 slag per minutt uten bilyd. Slimhinnene var lyserosa, lett klebrige med en kapillærfylningstid på < 2 sekunder. Hudturgor var lett nedsatt. Bukpalpasjon over nyrene ga tydelig ømhet. Urinblæra kunne ikke palperes.
Problemliste og diagnostisk plan
Problemlisten etter anamnestiske opplysninger og klinisk undersøkelse omfattet feber, smerter over nyreregionen og pollakisuri. Basert på resultatene av den kliniske undersøkelsen ble planen videre å ta blodprøver til hematologiske og biokjemiske analyser inkludert SDMA, urinprøve til dyrkning og ultralyd og røntgen av buken.
Resultater
Hematologiske analyser ble utført med ProCyte Dx® Haematology Analyser (IDEXX Laboratories, Westbrook, MA, USA) viste markert nøytrofili (33,8 109/L), moderat lymfocyttose (10,4 109/L) og mild monocyttose (0,9 109/L). Biokjemiske serumanalyser ble utført med Catalyst Dx® Chemistry Analyser (IDEXX Laboratories, Westbrook, MA, USA) og viste økt urea (17,3 mmol/L, RI: 5,7-12,8 mmol/L) og økt kreatinin (251 µmol/L, RI :71-212 µmol/L) som signifikante avvik. Urinprøven ble tatt fra spontan urin og mikroskopisk analyse av sediment viste rikelig forekomst av stavbakterier og degenererte nøytrofile granulocytter med intracellulære bakterier.
Ultralydundersøkelsen viste en dilatasjon på 4,5 mm av venstre nyrepelvis (Figur 1). Proksimale venstre ureter var buktet og hadde en dilatasjon på 1,7 mm (Figur 2). Ved ultralydundersøkelse ble det observert 4 urolitter i venstre ureter. Røntgen avdekket nefrolitter i både høyre og venstre nyrepelvis.
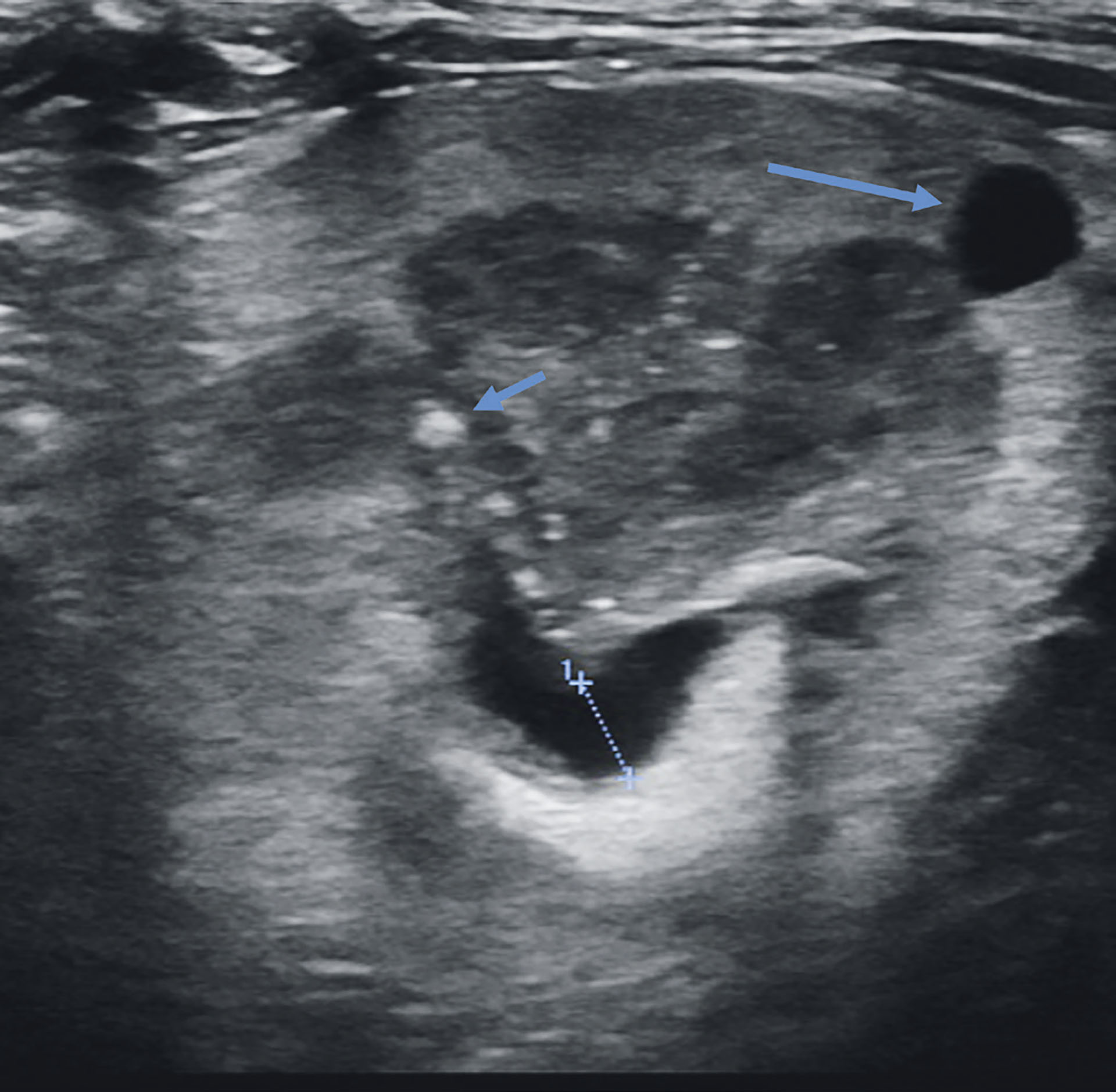
Figur 1: Lengdesnitt av venstre nyre. Dilatasjonen i nyrepelvis ble målt til 4,5 mm. Det ses en cyste i nyrecortex (stor pil), samt en nefrolitt (liten pil).
Foto: Andrea Schamaun og Marte Jervan
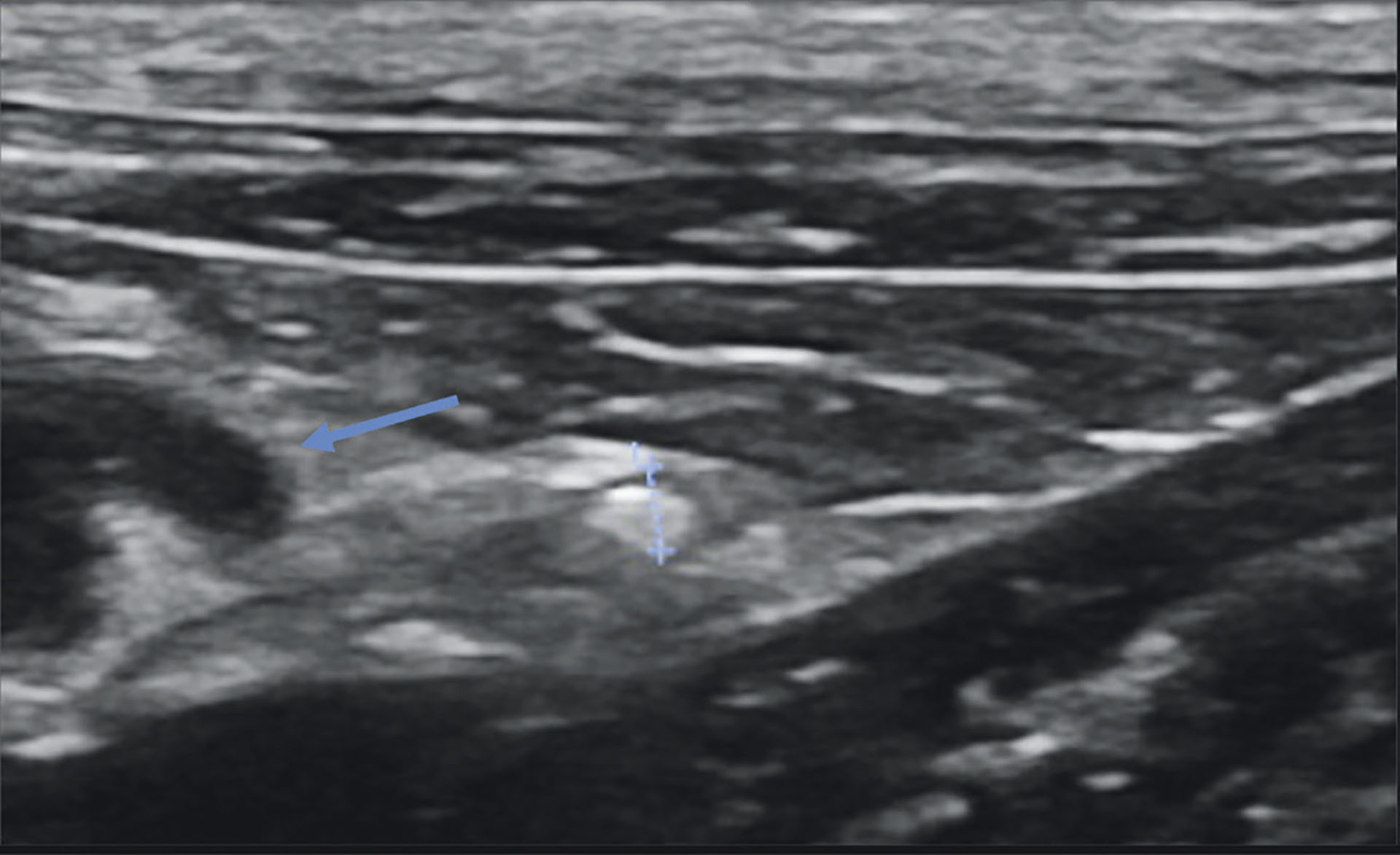
Figur 2: Dilatasjon av proksimale venstre ureter målt til 1,7 mm (pil) med ureterolitt ca. 2cm kaudalt.
Foto: Andrea Schamaun og Marte Jervan
Diagnose
Basert på anamnese, kliniske og diagnostiske undersøkelser ble diagnosen partiell ureterobstruksjon i venstre ureter med mild hydronefrose og mulig pyelonefritt.
Medisinsk behandling
Medisinsk behandling besto av intravenøs væske med krystalloider (Ringer-acetat), ampicillin (30 mg/kg iv), maropitant (1 mg/kg sc), samt amytriptylin (1 mg/kg po). I tillegg ble det gitt trimetoprim-sulfa med redusert dosering (10 mg/kg iv) på grunn av nyrepåkjenningen. Når hydreringstilstanden var normal ble det gitt fentanyl (1-5 µg/kg/t) og meloxicam (0,2 mg/kg). Inflammatorisk leukogram og nyreverdier forbedret seg, men det var ingen tegn til passasje av ureterolittene. Da medisinsk behandling ikke var vellykket ble det bestemt å utføre venstresidig subkutan ureteral bypass (SUBTM).
Kirurgisk behandling
Et nefrostomikateter ble plassert ved bruk av en modifisert Seldinger-teknikk under fluoroskopiveiledning. Et 19 G venekateter ble brukt for å punktere nyrepelvis fra den kaudale polen i nyren. En T-port med 3-veis kran ble koblet til en 3 mL sprøyte med 50/50 løsning av omnipaque og natriumklorid. Et antegrad pyelogram ble utført for å synligjøre nyrepelvis. En J-formet guidewire ble ført inn i venekateteret og coilet inn i nyrepelvis. Venekateteret ble så tatt ut, mens guidewiren ble holdt på plass. Et 6,5 F nefrostomikateter med kanyle og suturer ble ført over guidewiren inn i nyrepelvis hele veien rundt slik at det dannet en coil, samtidig som kanylen ble trukket forsiktig ut. En svart radiomarkør ble brukt som en veiledning for å sikre at den satt riktig. En DacronTM mansjett på nefrostomikateteret ble forsiktig ført inntil nyren og ble limt fast med spesiallim på nyrecortex.
Et cystostomikateter ble plassert med en absorberbar tobakksutur (BiosynTM 3-0) i blæreapeks. Det ble laget et lite snitt sentralt i tobakksuturen og cystostomituben med kanyle ble ført inn i blærelumen helt til DacronTM mansjetten på cystostomituben lå inntil serosa på blæreveggen. Suturen ble så fiksert og mansjetten ble sydd fast til blæreveggen med absorberbar sutur (BiosynTM 3.0). Kanylen ble trukket forsiktig ut og mansjetten ble ytterligere fiksert til blæreveggen med spesiallim.
En swirling SwirlPortTM (mansjettport) ble fiksert lateralt på bukveggen, på muskulaturen på venstre side sentralt mellom os pubis og processus xiphoideus. Det ble laget to snitt med cirka 10 cm avstand igjennom bukveggen. Katetrene ble ført igjennom snittene i bukveggen og koblet til mansjetten i hver pol. Mansjettporten ble deretter suturert fast. Buken ble lukket etter standard prosedyre
Etter operasjonen ble det tatt røntgen for å kontrollere at systemet var tett. Det ble observert lekkasje retroperitonealt (Figur 3). Katten måtte derfor reopereres dagen etter på grunn av lekkasje fra nyrepelvis. Nefrostomikateteret ble trukket litt tilbake og pelvis ble suturert med et korssting med absorberbar sutur (BiosynTM 4.0). Det ble lagt et Jackson-Pratt® bukdren, et sentralvenøst kateter og spiserørssonde. Dagen etter viste ultralydkontroll en redusert dilatasjon av nyrepelvis. Katten ble sendt hjem med spiserørssonde tre dager etter reoperasjonen.
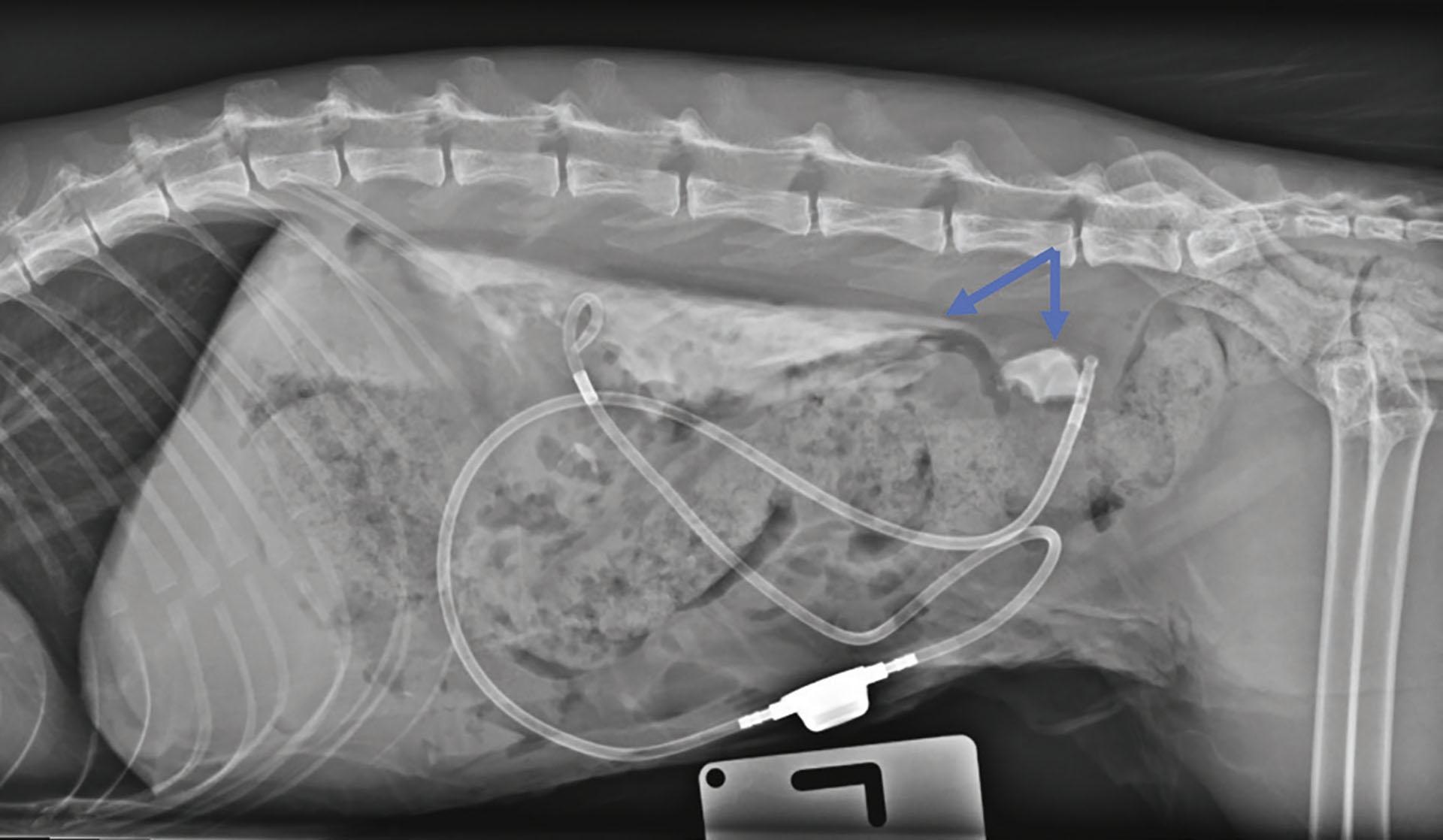
Figur 3: Røntgenkontroll etter operasjon. Her ses lekkasje retroperitonealt (piler).
Foto: Aina Myklebust
Postoperativ oppfølging
Det er indisert å skylle SUBTM-kateteret før hjemsendelse, etter 1 måned og deretter hver 3. måned. Hensikten er å løse opp eventuelle blodkoagler eller annen biologisk materie, samt hindre fremtidig biofilmdannelse og mineralisering av kateteret. Skylling utføres ved å injisere et løsningsmiddel, tetrasodium etylendiamintetraeddiksyre (T-EDTA). Prosedyren utføres aseptisk, under lett sedasjon og ultralydguidet. Skylling av SUB-kateteret ble utført 10 dager postoperativt. Området over mansjetten ble barbert og det ble foretatt kirurgisk vask av området. En Huber-nål ble ført inn i mansjetten og ble koblet til en treveis port med forlenger (Figur 4).
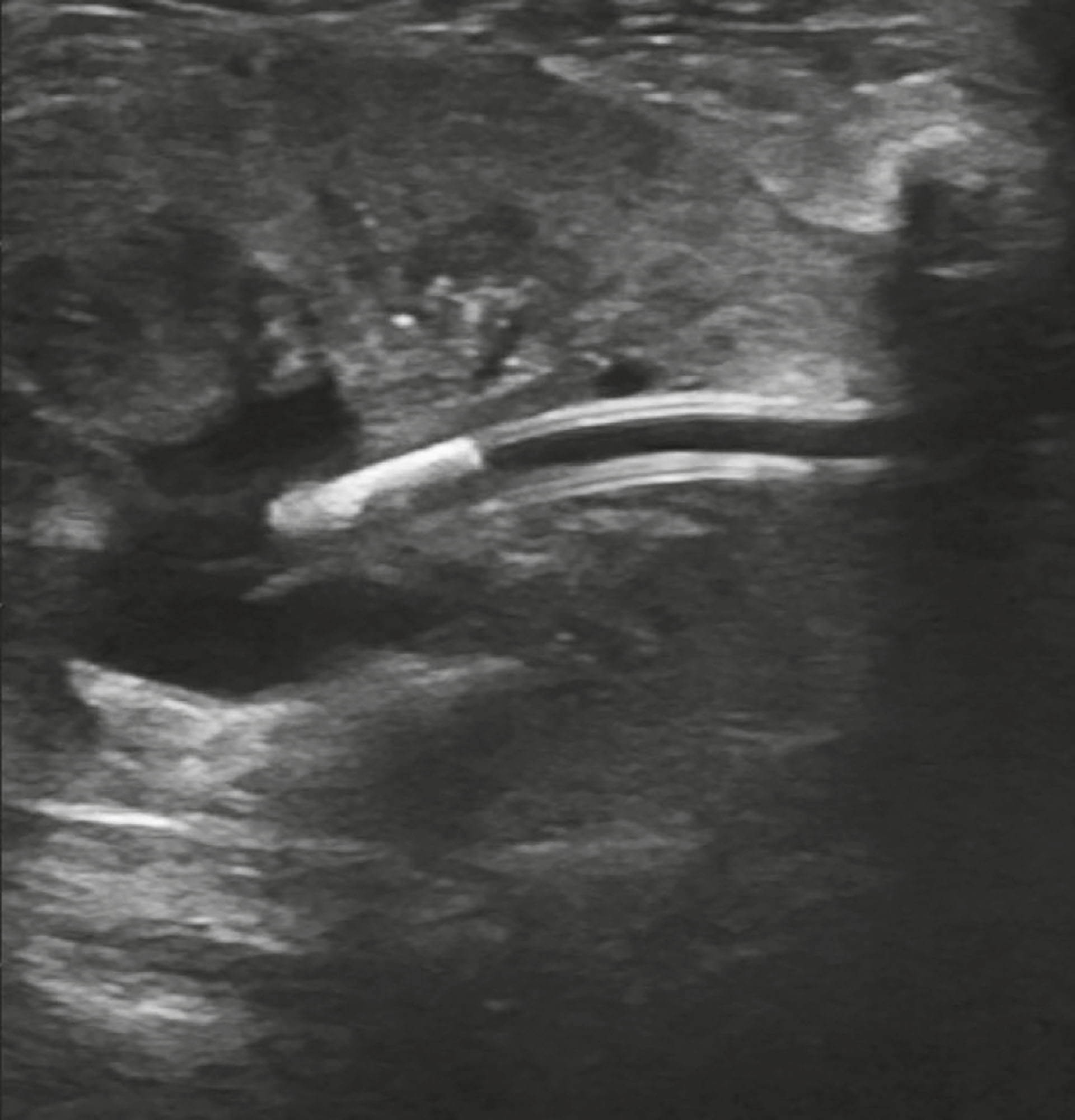
Figur 4: Nefrotomikateter i venstre nyrepelvis ett døgn etter operasjonen. Det var fortsatt mild dilatasjon av nyrepelvis.
Foto: Andrea Schamaun og Marte Jervan
En urinprøve ble tatt ut med steril prosedyre. Det ble så injisert 2,5 mL med sterilt saltvann mens nyrepelvis ble monitorert med ultralyd for å unngå overdistensjon (Figur 5). Den samme mengde saltvann ble injisert på nytt mens blæreapex ble monitorert. Det ble så injisert 2 mL T-EDTA løsning. Urinanalysen var negativ for bakterier.
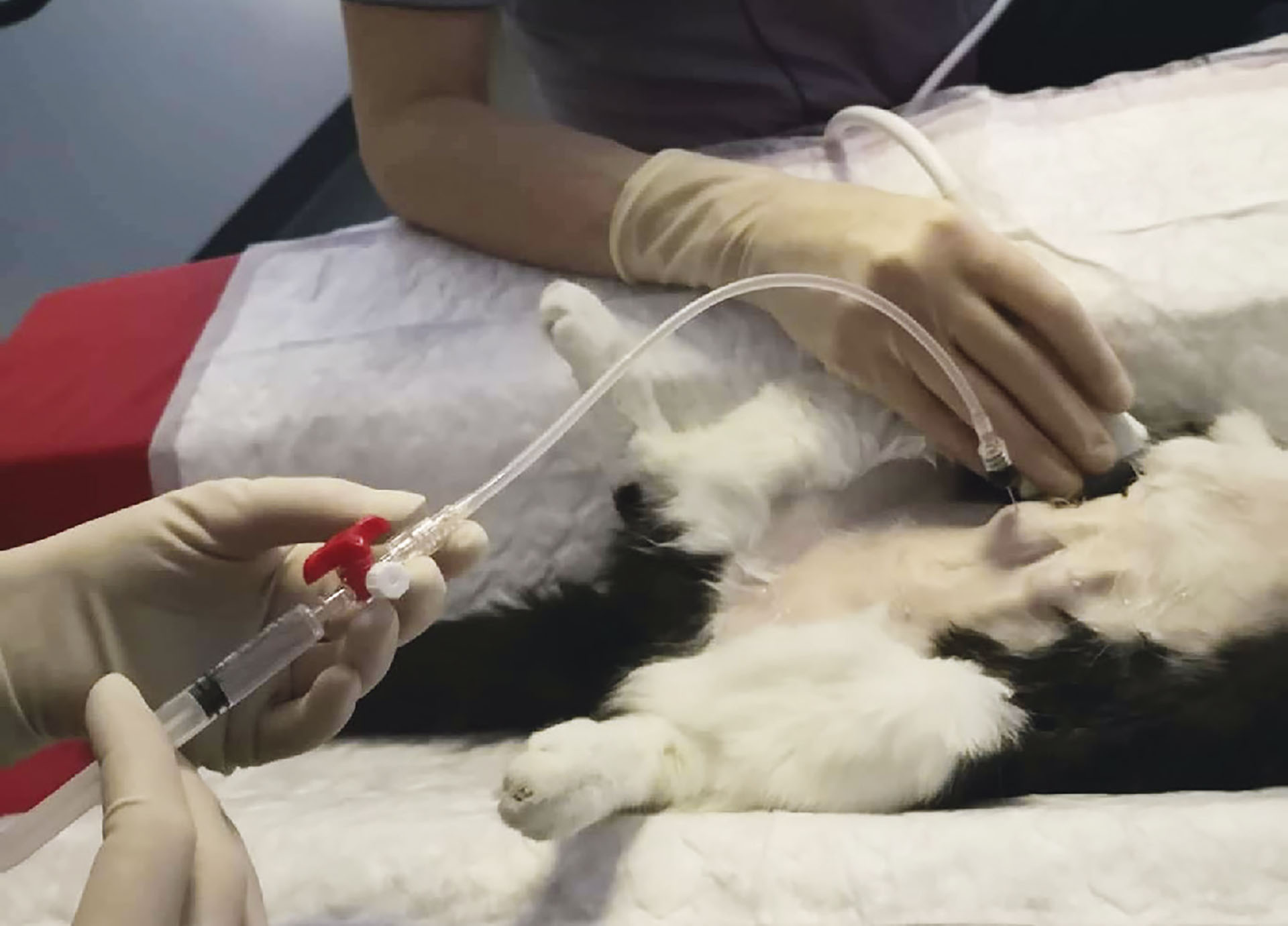
Figur 5: Skylling av SUB instrumentet med NaCl.
Foto: Aina Myklebust
Kontroll etter 1 måned
Første kontroll ble gjennomført etter 1 måned. SUBTM-kateteret var godt tolerert, matlysten hadde vært god og kattens vekt var økt. Periodisk dysuri hadde blitt behandlet med meloxicam med godt resultat. Under kontrollkonsultasjonen ble SUBTM-kateteret skylt med samme prosedyre som 10 dager postoperativt. Det ble tatt blodprøver og urinprøve. Urea- og kreatininkonsentrasjonene i serum var på samme nivå som på Dag 1 (henholdsvis 17,5 mmol/L og 250 µmol/L). SDMA var nå 20 µg/dL (Øvre referansegrense 14 µg/dL). Urindyrkningen var negativ.
Ny konsultasjon etter 6 måneder
Anamnese
Pasienten ble presentert på vakt 6 måneder etter første operasjon etter å ha vist redusert appetitt, pollakisuri og stranguri de siste 2 dagene.
Klinisk undersøkelse
Allmenntilstanden var mildt redusert. Rektaltemperaturen var 38,5 ˚C. Auskultasjon av hjertet påviste en systolisk bilyd grad 2/6 med 160 slag per minutt og jevn rytme. Slimhinnene var lyserosa til bleke og lett klebrige med normal kapillærfylningstid. Hudturgor var mildt redusert. Ved bukpalpasjon ble det påvist mild ømhet over høyre nyre.
Problemliste og diagnostisk plan
Redusert allmenntilstand, pollakisuri, stranguri og ømhet over høyre nyre ga mistanke om ny ureterobstruksjon. Planen videre var å ta blodprøver til hematologiske og biokjemiske analyser, urinprøve til dyrkning og ultralyd og røntgen av buken.
Resultater
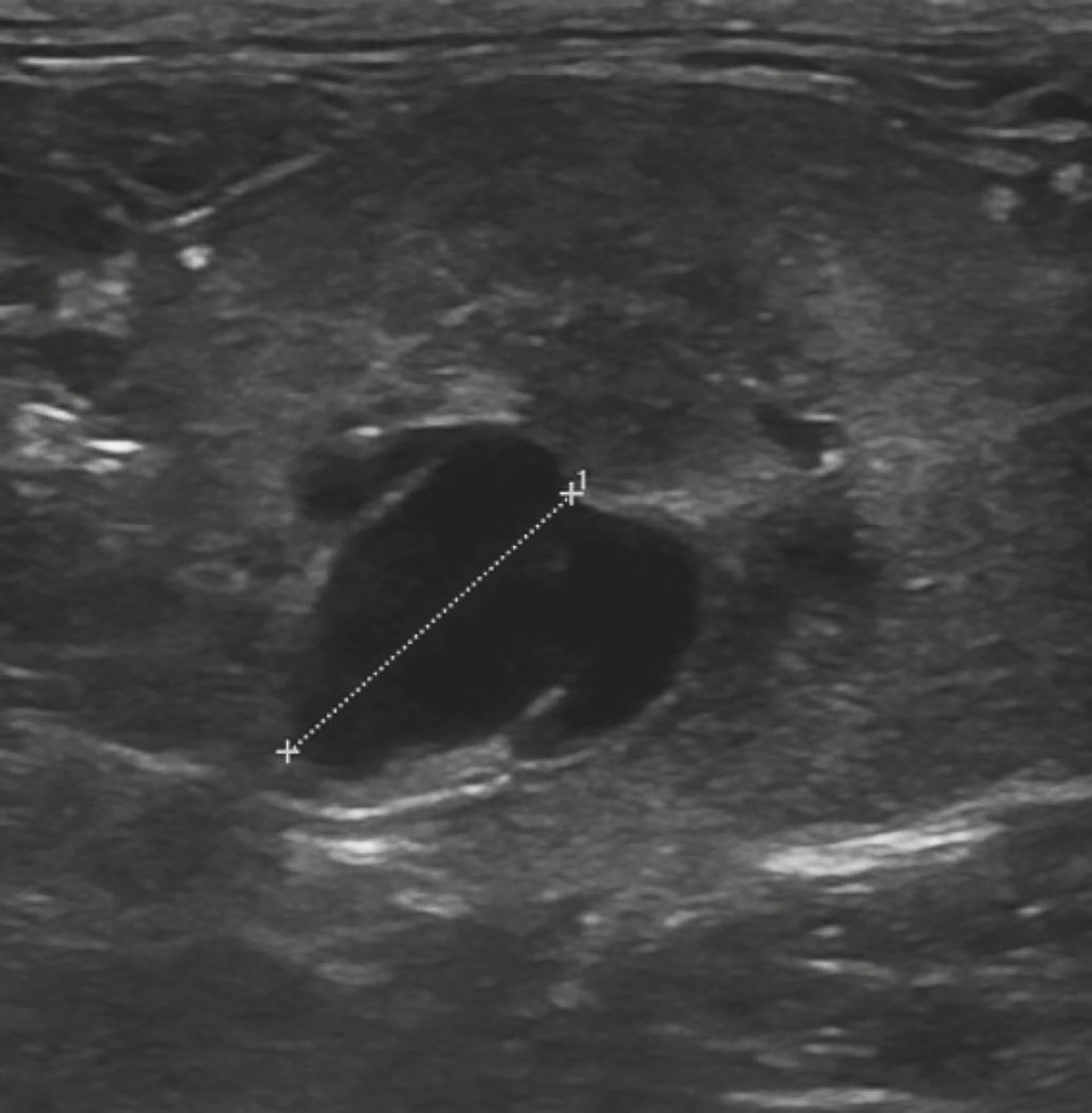
Figur 6. Tverrsnitt av høyre nyre med dilatasjon av nyrepelvis målt til 8 mm.
Foto: Øystein Klemp
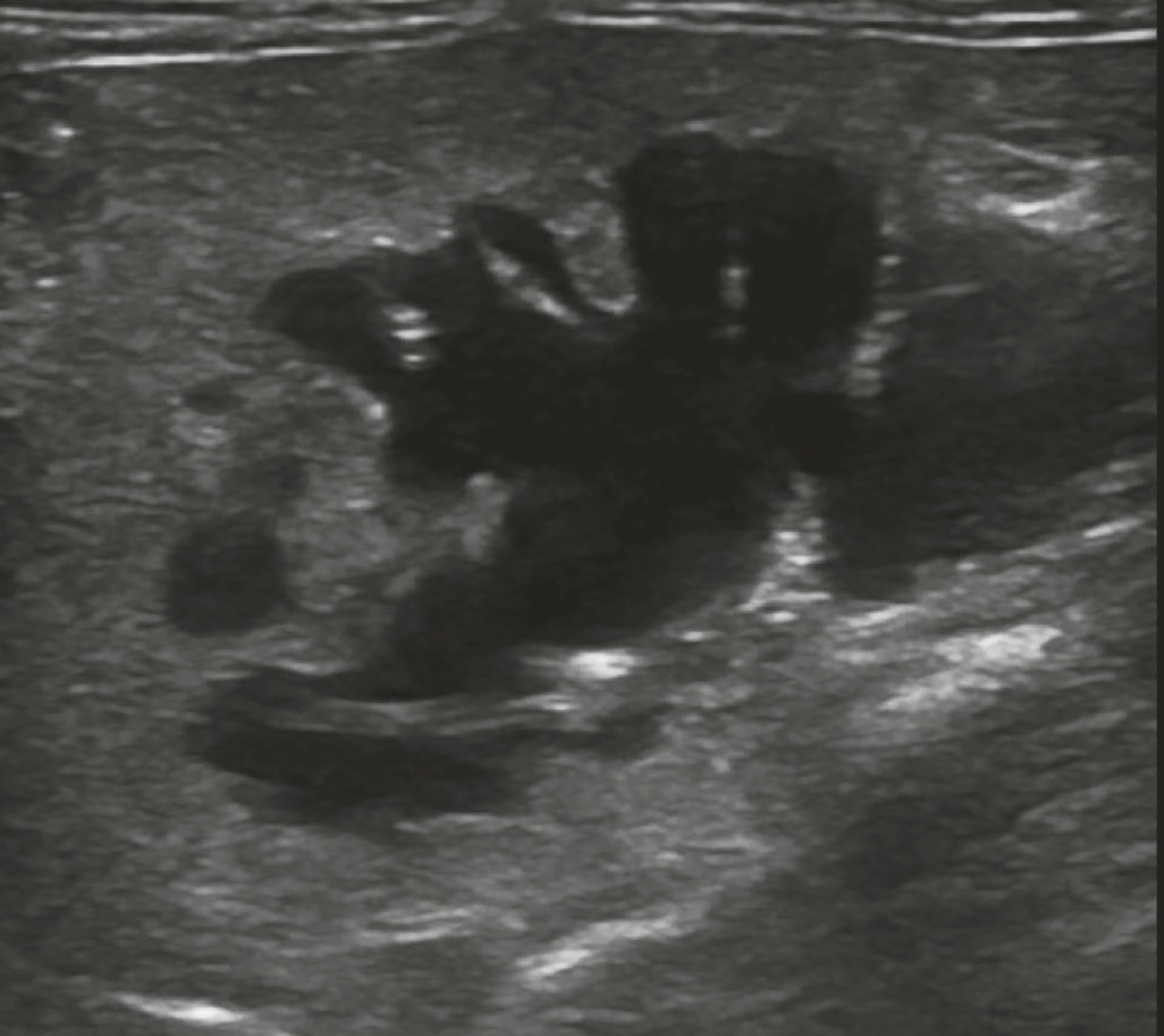
Figur 7: Lengdesnitt høyre nyre med dilatasjon av nyrepelvis.
Foto: Øystein Klemp.
Hematologiske analyser avdekket moderat anemi uten respons og mild nøytrofili med venstre forskyvning. Biokjemiske serumanalyser viste markert forhøyete konsentrasjoner av urea (39,7 mmol/L, RI: 5,7-12,8 mmol/L) og kreatinin (745 µmol/L, RI :71-212 µmol/L) og hypokalemi (3,0 mmol/L, RI: 3,5-5,5 mmol/L). Urinprøven ble tatt via cystocentese og sedimentanalyse viste rikelig forekomst av stavbakterier og degenererte nøytrofile granulocytter med intracellulære bakterier. Ultralydundersøkelsen avdekket en markert dilatasjon av nyrebekkenet (Figur 6) med en dilatasjon i tversnitt på cirka 8 mm på høyre side (Figur 7). Under oppholdet ble det påvist en ureterolitt i høyre ureter på ultralydundersøkelsen. Venstre nyre var liten med kroniske forandringer uten dilatasjon av nyrepelvis. Det var ingen synlige ureterolitter langs høyre ureter på røntgen.
Diagnose
Basert på anamnese, kliniske og diagnostiske undersøkelser ble diagnosen ureterobstruksjon i høyre ureter med hydronefrose forårsaket av ureterolitt og mulig pyelonefritt.
Medisinsk behandling
Medisinsk behandling ble gitt i 3 døgn og besto som forrige gang av intravenøs væske med krystalloider, maropitant (1 mg/kg sc), samt amytriptylin (1 mg/kg po). I stedet for ampicillin ble det nå gitt enrofloxacin (5 mg/kg iv). I tillegg ble gitt fentanyl (1-5 µg/kg/time) og meloxicam (0,2 mg/kg) når den var blitt hydrert. Hydreringsstatus forbedret seg og nyreverdiene gikk gradvis nedover mot referanseintervallene. Inflammatorisk leukogram normaliserte seg, men det var igjen ingen tegn til passasje av ureterolittene. Etter 3 døgn ble det bestemt å utføre kirurgisk behandling.
Kirurgisk behandling
Den samme kirurgiske teknikken med SUBTM som 6 måneder tidligere hadde blitt utført på venstre nyre ble nå anvendt på høyre nyre. Dilatasjonen i nyrepelvis var på cirka 6 mm på operasjonsdagen. Dette var et bedre utgangspunkt for plassering av nefrostomikateteret (Figur 8). Cystostomikateteret ble satt på høyreside av blæreveggen i apex og en DacronTM mansjett ble sydd fast til blæreveggen (Figur 9). Mansjetten ble montert på høyre side av bukveggen (Figur 10). Systemet ble kontrollert for lekkasje (Figur 11) før lukking av buken som nå inneholdt SUBTM på både venstre og høyre side (Figur 12). Det ble lagt inn sentralt venekateter og spiserørssonde etter operasjonen. Ultralydkontroll postoperativt viste en sterk forbedring av dilatasjon av høyre nyrepelvis, og det var ingen fri væske i buken (Figur 13). Katten ble sendt hjem tre døgn etter operasjonen.
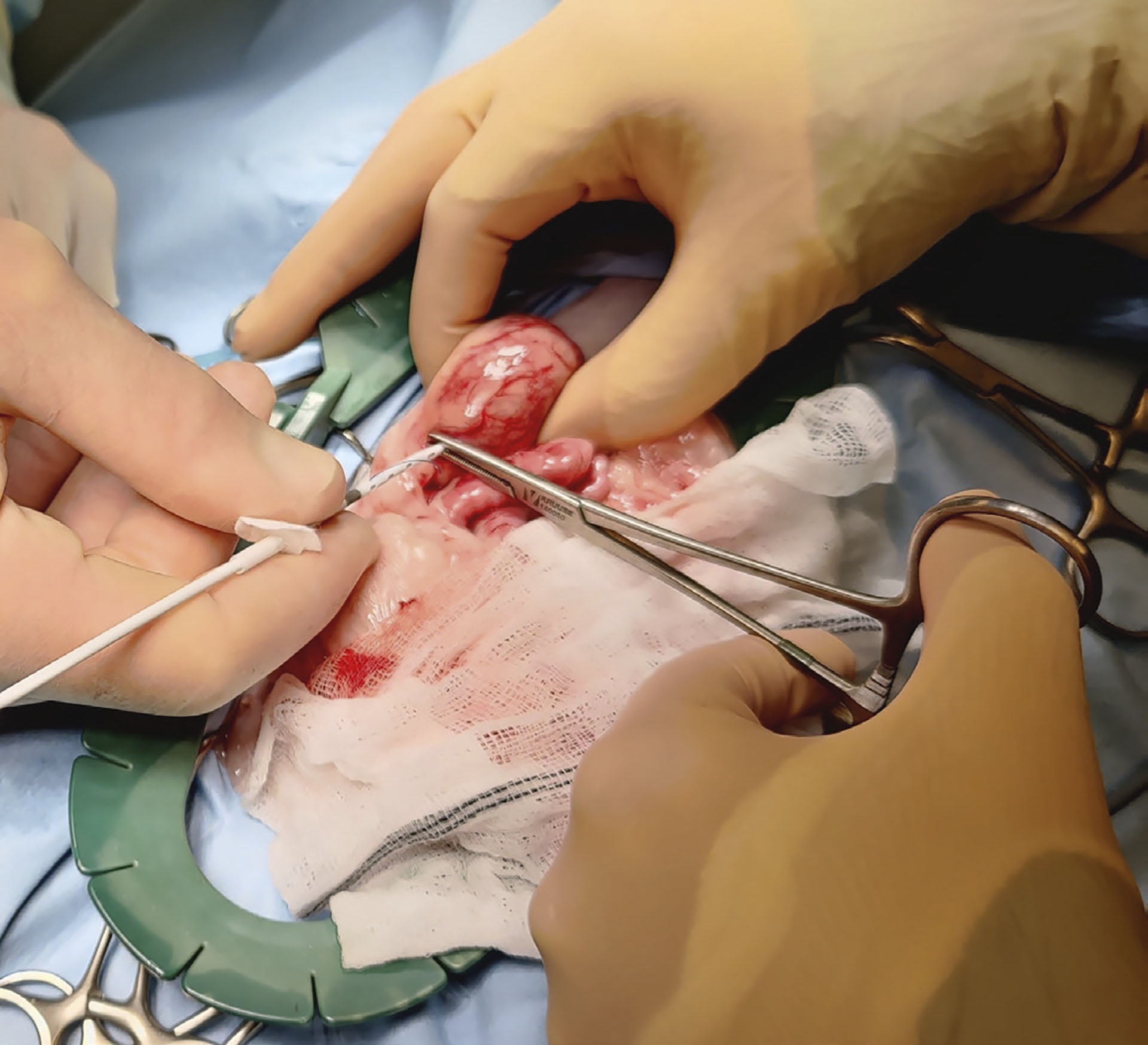
Figur 8 (over). Plassering av nefrotomikateter i høyre nyre.
Foto: Aina Myklebust
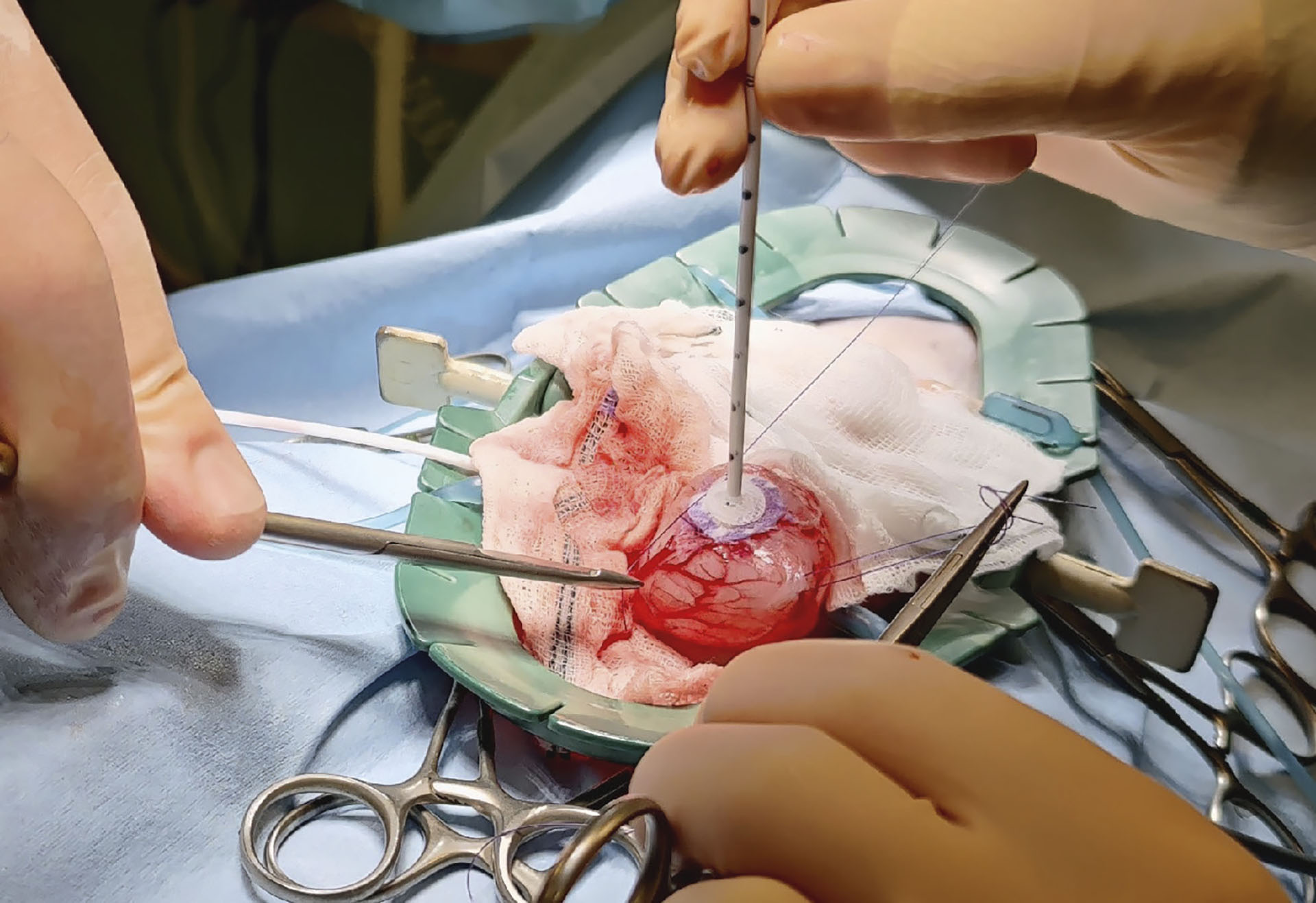
Figur 9. Plassering av cystostomikateteret. Her blir en DacronTM cuff sydd fast til blæreveggen.
Foto: Aina Myklebust
Figur 10: Montering av mansjettknappen. Her er det koblet på en Huber nål med forlenger hvor det injiseres kontrast for å kontrollere at det ikke er lekkasje i systemet.
Foto: Aina Myklebust
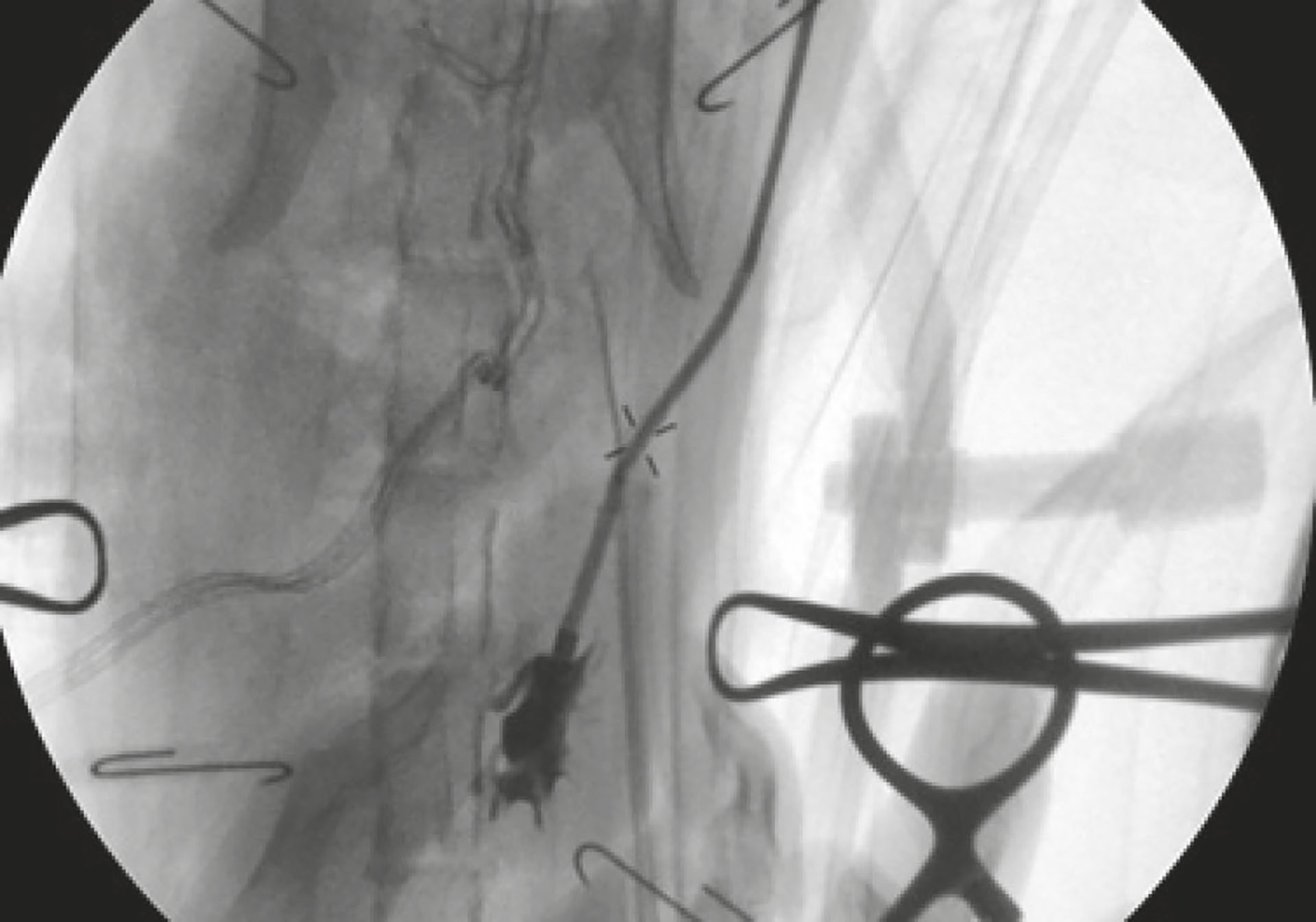
Figur 11: Kontrollbilde etter injisering av omnipaque. Nefrotomikateteret ligger riktig plassert i nyrepelvis. Det er ingen tegn til lekkasje
Foto: Aina Myklebust, Morten Nossen og Carsten Glindø
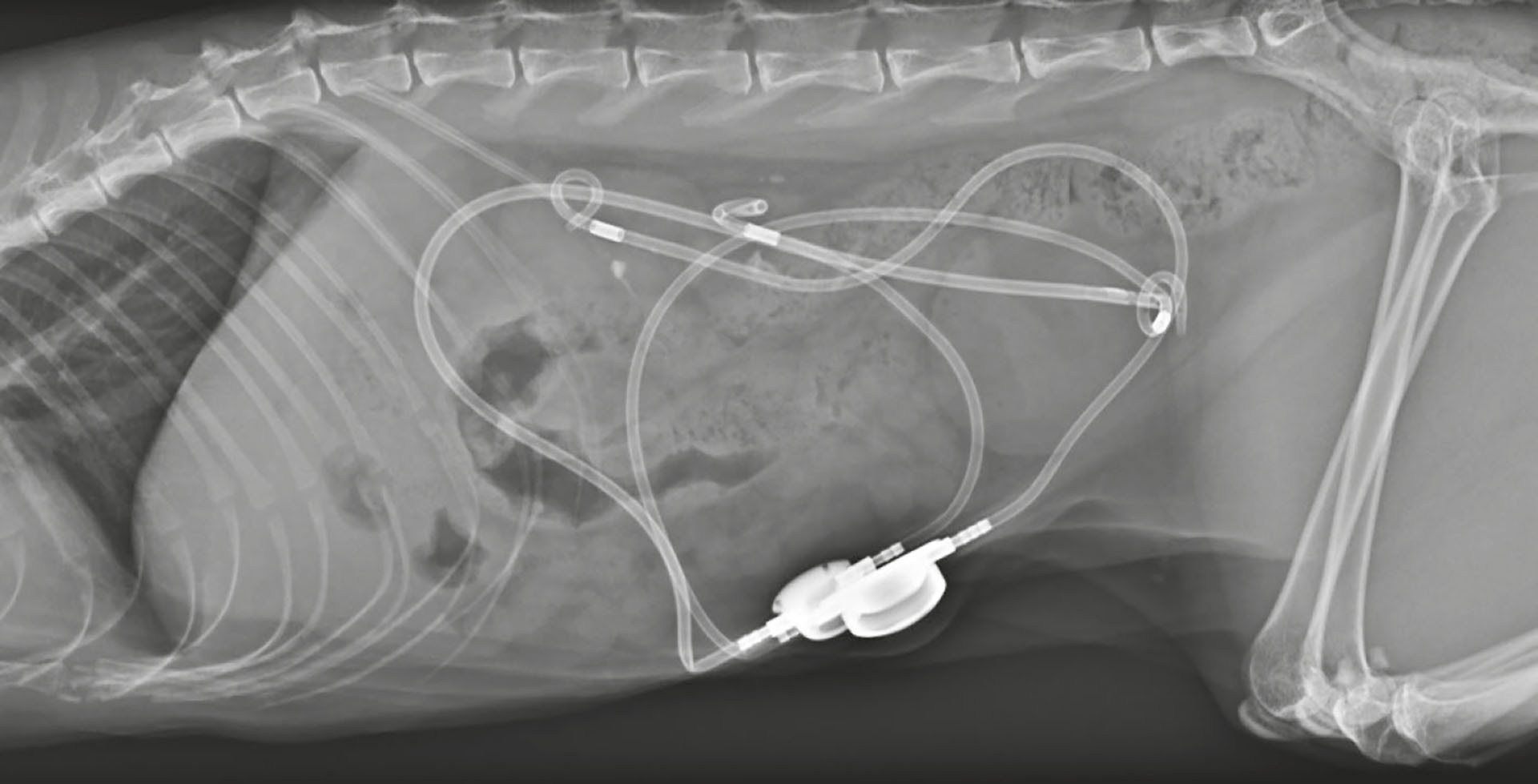
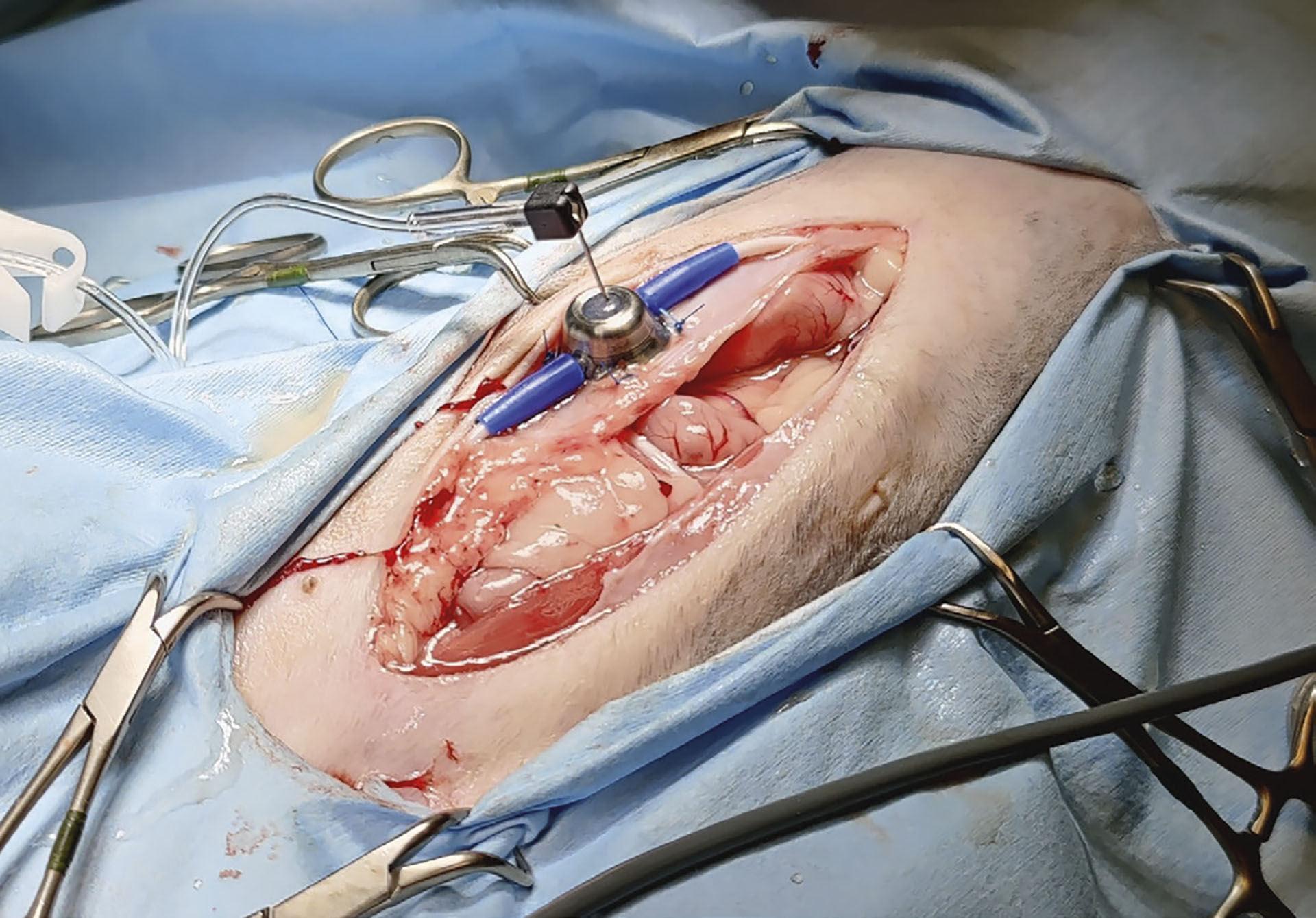
Figur 12: Røntgenbilde etter operasjonene. Her ses begge SUB-instrumentene
Foto: Andrea Schamaun
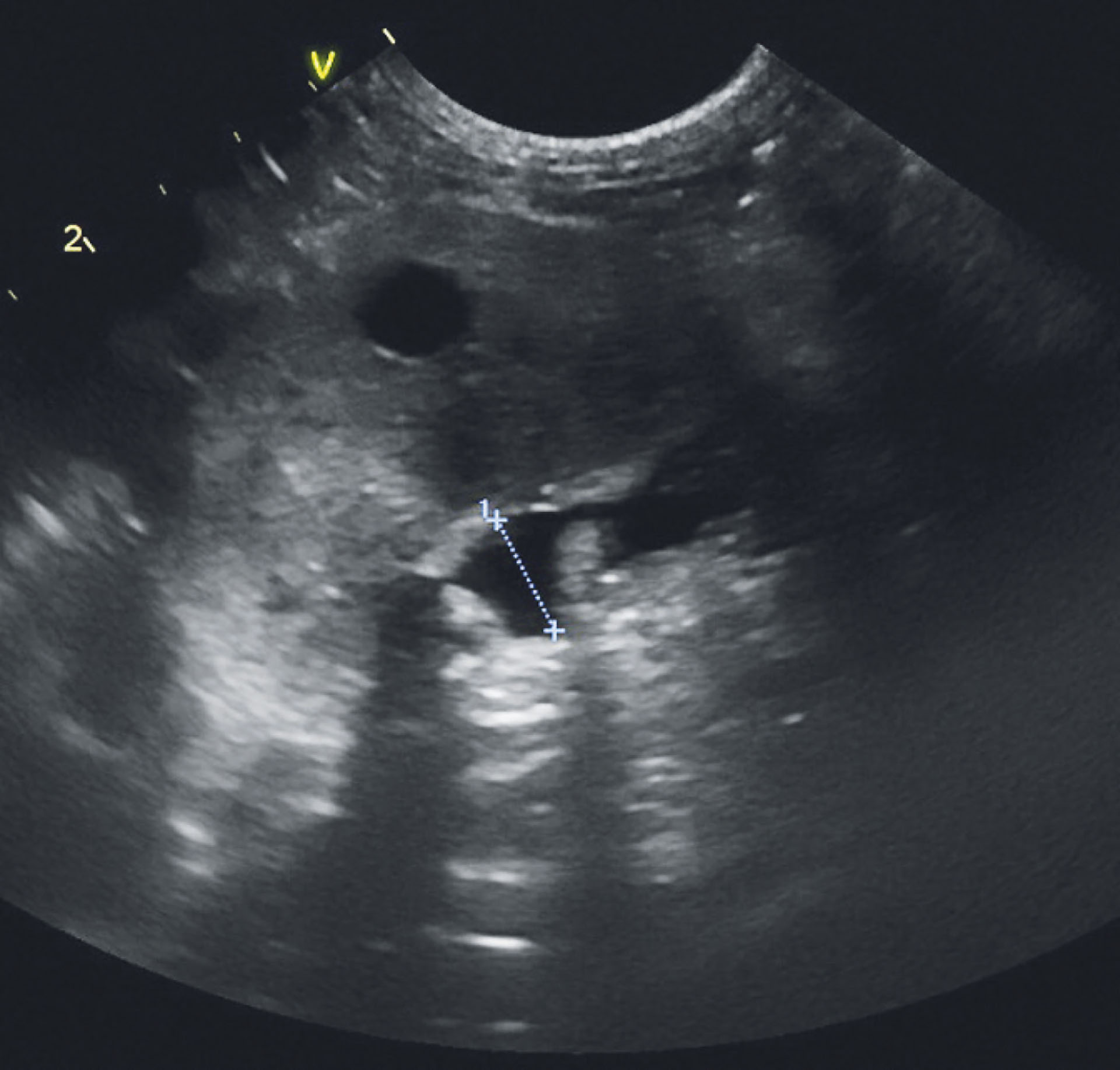
Figur 13: Ultralydkontroll dagen etter operasjonen. Dilatasjonen var betydelig mindre. Det var ingen fri væske i buken.
Foto: Andrea Schamaun og Marte Jervan
Postoperativ oppfølging
Det ble foretatt skylling av SUBTM-kateteret 1 uke etter operasjonen, etter 1 måned og deretter hver annen måned for å hindre infeksjon og biofilmdannelse. Også dette SUBTM-kateteret ble godt tolerert. Periodevis dysuri oppsto grunnet irritasjon av instrumentet i blæren, men katten responderte godt på smertelindring under disse periodene. Urinen ble analysert ved hver skylling. Det var ingen funn av bakterier ved cytospin undersøkelse, men moderat nøytrofili grunnet aseptisk inflammasjon i blæren. En enterokokkinfeksjon oppsto cirka 6 måneder etter andre operasjon, som har blitt kronisk, men uten kliniske tegn på UVI.
Diskusjon
SUBTM-metoden ble først beskrevet av Desgrandchamps i 1995 hos humane pasienter med ureterale obstruksjoner sekundært til kreft som et alternativ til palliativ behandling med permanent nefrostomikateter(13). Gitt de ulike utfordringene av ureterale obstruksjoner på katt, spesielt med tanke på størrelse av ureter, kirurgiske komplikasjoner og vanskeligheter med stentplassering, ble det humane SUBTM-utstyret tilpasset og utviklet for bruk til katt.
Det finnes ingen klare kriterier for når kirurgi bør utføres og hvilken kirurgisk metode som skal anvendes. Det finnes fortsatt ingen optimal teknikk som ikke innebærer risiko for infeksjon, lekkasje, re-obstruksjon eller blødning. Den kirurgiske metoden må derfor velges ut ifra hvert enkelt kasus og baseres på graden av obstruksjon, lokalisasjonen, antall urolitter, infeksjonsbilde og kirurgisk erfaring (13).
Anvendelse av SUBTM er spesielt indisert ved multiple ureterolitter, dersom tradisjonell kirurgi ikke har vært vellykket eller er kontraindisert eller dersom det er høy risiko for re-obstruksjon. Gjennomsnittlig antall ureterolitter rapportert i publiserte studier er 4 (1). I mange tilfeller er dermed SUB-metoden den optimale metoden. I følge «ACVIM consensus» fra 2016 er ureteral stenting eller SUBTM de anbefalte metodene på katt(3).
Operasjonen er teknisk krevende, kostbar, og komplikasjoner kan oppstå. «Gullstandaren» for plassering av nefrostomikateteret er under fluoroskopisk veiledning, men SUB metoden har også blitt anvendt blindt eller ved hjelp av ultralyd (18, 19). Det fins 2 ulike metoder å plassere SUBTM på avhengig av dilatasjonen på nyrepelvis. Dersom nyrepelvis har en dilatasjon under 5-8 mm, er det anbefalt å plassere nefrostomikateteret i ureter i stedet for å coile det i nyrepelvis (1).
Tekniske komplikasjoner
De fleste komplikasjonene skyldes tekniske feil som kan unngås med god opplæring, grundige forberedelser og lekkasjetesting under operasjonen. En studie rapporterte en komplikasjonsrate på 15 % relatert til tekniske feil (16). I en annen studie oppsto tekniske feil i 25 % hvor det krevdes re-operasjon. I sistnevnte studie ble 90 % av SUBTM instrumentet plassert blindt eller med ultralyd (18).
En komplikasjon ved anvendelse av SUBTM er lekkasje ved nefrotomi- eller cystotomiutgangen, ofte assosiert til tekniske feil (2,3-3,5 %) (1, 17). Denne komplikasjonen forekommer sjeldnere etter at en DacronTM mansjett designet til nyrekapselen og blæreveggen ble inkludert. Lekkasje forekommer nå oftere mellom portinngangen og kateteret dersom denne ikke lukkes stramt nok(1). En annen komplikasjon er blødning ved plassering av nefrotomituben (<5 %) enten ved traume av nyrepelvis under manipulering av guidewiren eller kateteret eller dersom et kar blir punktert(1). Kinking av kateteret (4,6 %-12,5 %) er en teknisk feil og skyldes at avstanden mellom de to inngangsportene igjennom bukveggen er for kort. Dette vil som oftest kreve re-operasjon (1, 18). Denne komplikasjonen har derimot blitt redusert til 0 % etter at SUBTM 3.0 modellen ble utviklet, hvor katetrene kobles sammen i buken med et Y-system og kun ett kateter kobles til mansjettporten under huden (20). Postoperativ okklusjon med blodkoagler forekommer (8 %), men denne komplikasjonen løses som regel ved å skylle kateteret med T-EDTA. I få tilfeller må kateteret byttes ut (1, 21).
Andre postoperative komplikasjoner er post-obstruktiv diurese. Katter er spesielt utsatt for dette ved ureter- og ureteral-obstruksjon. I tillegg er de også i risiko for overhydrering og utvikling av hjertesvikt. Jevnlig monitorering av væskebalanse, urinproduksjon og vekt er dermed helt avgjørende for optimal væskebehandling og prognose. Det anbefales å legge inn spiserørsonde rutinemessig for slike operasjoner i tillegg til jevnlig monitorering av elektrolytter og nyreverdier (8, 22).
Langtidskomplikasjoner
Langtidskomplikasjoner relatert til selve utstyret er mineralisering og infeksjon, men faren for dette kan reduseres ved jevnlig skylling av SUBTM med T-ETDA-løsningen (18). Okklusjon av systemet i ettertid enten på grunn av purulent debris eller urolitter kan også forekomme. Det er registrert at 24 % av katter fikk en re-obstruksjon etter anvendelse av SUBTM etter en median på 463 dager hvor 13 % krevde re-operasjon (17). Et høyt nivå av serum ionisert kalsium var sterkt assosiert med mineralisering (17). En annen studie rapporterte re-okklusjon i 33,3 % av tilfellene (18). Denne komplikasjonen vil trolig forekomme i mindre grad etter at man har startet med skylling av systemet med T-EDTA. T-EDTA har vist seg å ha chelaterende egenskaper og sørger for demineralisering av SUB™. I en studie ble T-EDTA anvendt på 8 katter med re-okklusjon hvor alle tilfellene ble løst. Kun én katt behøvde bytting av SUBTM etter at den fikk en ny re-okklusjon 356 dager etter første T-EDTA skylling (22).
Kroniske urinveisinfeksjoner (UVI) og dysuri er en vanlig langtidskomplikasjon (16, 21, 23, 24). Det er rapportert en infeksjonsrate mellom 20,8 %-31 % (16, 18), mens i andre tilfeller var det kun 8,5 % som utviklet UVI en måned etter operasjonen og 23,7 % innen første året (24). Perioperativ hypotermi og en positiv preoperativ dyrkning var faktorer som økte risikoen for residiverende UVI (24). Dersom kattene fikk antibiotika postoperativt var det mindre sannsynlig for positiv dyrkning postoperativt(23). Katter med CKD er i utgangspunktet utsatt for UVI (25, 26). Derimot er det ikke funnet en korrelasjon mellom CKD stadium og risiko for å utvikle UVI med SUBTM. Kun 1-5 % av katter med CKD uten SUBTM viste kliniske tegn på UVI. Etter SUB™-operasjon var det 25 % som dyrket positivt hvorav 93 % viste kliniske tegn forenlig med UVI og 7 % var subkliniske (23). Det er antatt at SUBTM-implantatet øker risikoen for biofilmdannelse. Et hovedproblem med dette er at biofilmbaserte infeksjoner er assosiert med høyere forekomst av resistente bakterier (23). I andre tilfeller er det kun rapportert 8 % forekomst av infeksjon ved jevnlig skylling med T-EDTA-løsningen (1, 17, 21).
Til tross for komplikasjonsraten er det flere studier som viser at SUBTM-metoden anses som et viktig alternativ for behandling av ureterale obstruksjoner hos katt. Ifølge litteraturen har SUBTM-metoden vist seg å ha en høy suksessrate over tid med god toleranse av instrumentet og holdbarhet i 94 % av tilfellene hos katt over en periode på 2 år (17). Dødelighetsraten har ligget mellom 6-15,4 % (9, 17, 19, 27) og den gjennomsnittlige overlevelsestid mellom 820-827 dager (9, 18). En studie hadde rapportert en gjennomsnittlig overlevelsestid på 949 dager (16), mens en annen studie hadde en overlevelsesrate på kun 274 dager (18). Metoden har også blitt anvendt for behandling av strikturer og iatrogen ligering (28, 29). De fleste katter viser umiddelbar postoperativ klinisk og klinisk-patologisk forbedring. Hydronefrose og hydroureter normaliseres raskt etter dekomprimering, og graden av azotemi er observert til å ha gått ned fra et gjennomsnitt for kreatininkonsentrasjonene på 734 umol/L til 215 umol/L (16). Persisterende azotemi er likevel et vanlig problem selv etter vellykket intervensjon. Majoriteten av kattene befinner seg innenfor IRIS stadium 1-2 (8). Det er også registrert en assosiasjon mellom høye kreatininkonsentrasjoner ved presentasjon og overlevelsestid. Ved kreatininkonsentrasjoner >440 µmol/L var den gjennomsnittlige overlevelsestid på 530 dager, mens kreatininkonsentrasjoner <440 µmol/L hadde en gjennomsnittlig overlevelsestid på 949 dager (16). Denne assosiasjonen er også observert i andre studier (16, 17). Det er også funnet en sterk korrelasjon mellom alder, hematokritt ved ankomst og overlevelsestid (18).
Konklusjon
SUBTM-metoden er ressurskrevende, kirurgisk og økonomisk. De fleste komplikasjonene er overkommelige, og metoden viser en god langtids overlevelsesrate. Prognosen avhenger av kronisitet og grad av obstruksjonen, nyrefunksjon og serumkreatininkonsentrasjonen ved presentasjon, samt vellykket kirurgisk gjennomføring. I tillegg er tidsaspektet kritisk for bevaring av nyrefunksjonen. Ureterale obstruksjoner må håndteres som en akutt situasjon (3, 8). Det er viktig å informere eier om at SUBTM-metoden er en siste utvei for behandling av ureterale obstruksjoner og at det kreves jevnlig oppfølging hvor re-operasjon og utvikling av persisterende urinveisinfeksjoner kan forekomme.
Forfatteren av denne artikkelen er ikke kjent med andre katter i Norge med bilateral SUBTM. Katten har nå levd i 2 år med den første (venstre) SUBTM og 1,5 år med høyre SUBTM. Langtidskomplikasjonen har vært bakterielle cystitter. Katten har en kronisk enterokokk cystitt som mesteparten av tiden har vært subklinisk, men har respondert på behandling ved kliniske tegn på UVI. Katten lever fortsatt og vurderes å ha god livskvalitet.
Sammendrag
Denne artikkelen beskriver behandlingen av to ureterale obstruksjoner med SUBTM-metoden på en katt som fikk først en obstruksjon i venstre ureter og deretter i høyre ureter med 6 måneders mellomrom. SUBTM-metoden er relativ ny, men har blitt brukt mye i utlandet for behandling av ureterale obstruksjoner på katt med gode resultater. Dette er etter det forfatteren vet det første rapporterte tilfelle av anvendelse av SUBTM på katt i Norge. Katten lever etter 2 år med bilateral SUBTM og stabile nyreverdier klassifisert i IRIS Stadium 2. Langtidskomplikasjonen har vært residiverende bakterielle urinveisinfeksjoner, hvor lengste periode uten bakteriell cystitt var 6 måneder.
Summary
This article describes the use of a subcutaneous bypass device for treatment of ureteral obstructions in a cat with initially an obstruction in the left kidney and hence, in the right kidney 6 months later. The SUBTM-device was designed in 2009 for veterinary patients and has been used frequently abroad for treatment of ureteral obstructions in cats with good results. However, this is the first reported feline case with a SUBTM-device in Norway. The cat is still alive two years after the first SUBTM-device was with a bilateral SUBTMand stable kidney values classified at IRIS stage II. The long-term complications consisted of bacterial urinary tract infections, where the longest period without bacterial cystitis was 6 months.
Referanser
Berent A, Weisse C. The SUB™ 2.0. A subcutaneous ureteral bypass system. A surgical guide. Skokie, Illinois: Norfolk Vet Products, 2009. https://norfolkvetproducts.com/PDF/SUB/SUB2_Surgical_Guide_2018-03-email.pdf
Berent A. Ureteral obstructions in dogs and cats. Vet Focus 2013;23(3):17-25.
Lulich JP, Berent AC, Adams LG, Westropp JL, Bartges JW, Osborne CA. ACVIM small animal consensus recommendations on the treatment and prevention of uroliths in dogs and cats. J Vet Intern Med 2016;30:1564-74.
Adams LG. Nephroliths and ureteroliths: a new stone age. N Z Vet J 2013;61:212-6.
Osborne CA, Lulich JP, Kruger JM, Ulrich LK, Koehler LA. Analysis of 451,891 canine uroliths, feline uroliths, and feline urethral plugs from 1981 to 2007: perspectives from the Minnesota Urolith Center. Vet Clin North Am Small Anim Pract 2009;39:183-97.
Lekcharoensuk C, Osborne CA, Lulich JP, Albasan H, Ulrich LK, Koehler LA et al. Trends in the frequency of calcium oxalate uroliths in the upper urinary tract of cats. J Am Anim Hosp Assoc 2005:41:39-46.
Clarke DL. Feline ureteral obstructions. Part 1: Medical management. J Small Anim Pract 2018;59:324-33.
Berent AC. Ureteral obstructions in dogs and cats: a review of traditional and new interventional diagnostic and therapeutic options. J Vet Emerg Crit Care 2011;21:86-103.
Berent AC, Weisse CW, Todd K, Bagley DH. Technical and clinical outcomes of ureteral stenting in cats with benign ureteral obstruction: 69 cases (2006-2010). J Am Vet Med Assoc 2014;244:559-76.
Griffin S. Feline abdominal ultrasonography. What´s normal? What´s abnormal? Renal pelvis, ureters and urinary bladder. J Feline Med Surg 2020;22:847-65.
Achar E, Achar RAN, Paiva TB, Campos AH, Schor N. Amitriptyline eliminates calculi through urinary tract smooth muscle relaxation. Kidney Int 2003;64:1356-64.
Kyles AE, Hardie EM, Wooden BG, Adin CA, Stone EA, Gregory CR et al. Management and outcome of cats with ureteral calculi:153 cases (1984-2002). J Am Vet Med Assoc 2005; 226:937-44.
Clarke DL. Feline ureteral obstructions. Part 2: Surgical management. J Small Anim Pract 2018;59:385-97.
Culp WTN, Palm CA, Hsueh C, Mayhew PD, Hunt GB, Johnson EG et al. Outcome in cats with benign ureteral obstructions treated by means of ureteral stenting versus ureterotomy. J Am Vet Med Assoc 2016;249:1292-1300.
Berent AC, Weisse CW, Todd KL, Bagley DH. Use of locking-loop pigtail nephrostomy catheters in dogs and cats: 20 cases (2004-2009). J Am Vet Med Assoc 2012;241:348-57.
Kulendra NJ, Borgeat K, Syme H, Dirrig H, Halfacree Z. Survival and complications in cats treated with subcutaneous ureteral bypass. J Small Anim Pract 2021;62:4-11.
Berent AC, Weisse CW, Bagley DH, Lamb K. Use of a subcutaneous ureteral bypass device for treatment of benign ureteral obstruction in cats: 174 ureters in 134 cats (2009-2015). J Am Vet Med Assoc 2018;253:1309-27.
Vrijsen E, Devriendt N, Mortier F, Stock E, van Goethem B, de Rooster H. Complications and survival after subcutaneous ureteral bypass device placement in 24 cats: a retrospective study (2016-2019). J Feline Med Surg 2021;23:759-69.
Livet V, Pillard P, Goy-Thollot I, Maleca D, Cabon Q, Remy D et al. Placement of subcutaneous ureteral bypasses without fluoroscopic guidance in cats with ureteral obstruction: 19 cases (2014-2016). J Feline Med Surg 2017;19:1030-9.
Berent A. Weisse C. SUB 3.0. A subcutaneous ureteral bypass system. A surgical guide. The new and improved therapeutic option for dogs and cats to bypass ureteral obstructions. 2020. https://norfolkvetproducts.com/wp-content/uploads/2020/10/SUB3_Surgical_Guide_2020-09-email.pdf
Chik C, Berent AC, Weisse CW, Ryder M. Therapeutic use of tetrasodium ethylenediaminetetraacetic acid solution for treatment of subcutaneous ureteral bypass device mineralization in cats. J Vet Intern Med 2019;33:2124-32.
Balsa IM, Culp WTN, Palm CA, Hopper K, Hardy BT, Ben-Aderet DG et al. Factors associated with postobstructive diuresis following decompressive surgery with placement of ureteral stents of subcutaneous ureteral bypass systems for treatment of ureteral obstruction in cats: 37 cases (2010-2014). J Am Vet Med Assoc 2019;254:944-52.
Kopecny L, Palm CA, Drobatz KJ, Balsa IM, Culp WTN. Risk factors for positive urine cultures in cats with subcutaneous ureteral bypass and ureteral stents (2010-2016). J Vet Intern Med 2019;33:178-83.
Pennington CE, Halfacree Z, Colville-Hyde C, Geddes RF. Factors associated with positive urine cultures in cats with subcutaneous ureteral bypass system implantation. J Feline Med Surg 2021;23:331-6.
Mayer-Roenne B, Goldstein RE, Erb HN. Urinary tract infections in cats with hyperthyroidism, diabetes mellitus and chronic kidney disease. J Feline Med Surg 2007; 9:124-32.
Bailiff N, Westropp J, Sykes J, Nelson R, Kass P. Comparison of urinary tract infections in cats presenting with lower urinary tract signs and cats with chronic kidney disease, hyperthyroidism, and diabetes mellitus. J Vet Intern Med 2007;21:649.
Horowitz C, Berent A, Weisse C, Langston C, Bagley D. Predictors of outcome for cats with ureteral obstructions after interventional management using ureteral stents or a subcutaneous ureteral bypass device. J Feline Med Surg 2013;15:1052-62.
Sapora JA, Hardie RJ, Evans N. Use of a subcutaneous ureteral bypass device for treatment of bilateral proximal ureteral injury in a 9-month-old cat. J Feline Med Surg Open Rep 2019;5:doi:10.1177/2055116919831856.
Johnson C, Culp WTN, Palm CA, Zacuto AC. Subcutaneous ureteral bypass device for treatment of iatrogenic ureteral ligation in a kitten. J Am Vet Med Assoc 2015;247:924-31.