De tre vanligste hudsvulstene hos hest
Hudsvulster utgjør over halvparten av alle neoplasier hos hest, og kan gi store utfordringer både for eier og for behandlende veterinær, i tillegg til å forårsake åpenbar dyrevelferdsmessig lidelse. Slik som for mange andre sykdommer ligger nøkkelen til god respons på behandling og liten risiko for residiv i tidlig diagnostikk og behandling med evidensbaserte metoder. I denne artikkelserien gis en oversikt over etiologi og patogenese, diagnostikk og behandling av de tre vanligste hudsvulstene hos hest: melanom, ekvint sarkoid og plateepitelkarsinom.
Professor i hestekirurgi, DECVS, DECVSMR, Dyresykehuset - Hest
NMBU Veterinærhøgskolen
Innledning
Mens neoplasier generelt er forholdsvis uvanlig hos hest, er hudsvulster derimot relativt vanlig forekommende og utgjør langt over halvparten av alle neoplasier hos denne arten. De tre vanligste svulsttypene, melanomer, ekvint sarkoid og plateepitelkarsinomer har vært kjent i århundrer, men det er først i de senere år at årsakssammenhenger har blitt kartlagt mer i detalj. Tilsvarende har man opp gjennom tiden forsøkt ulike former for behandling, men ofte med dårlig resultater grunnet høye residivrater. I denne artikkelserien presenteres etiologi og patogenese, diagnostikk og evidensbasert behandling etter dagens kunnskapsnivå. Denne første delen omhandler melanom (‘the Good’?); Del 2 tar for seg ekvint sarkoid (‘the Bad’); mens Del 3 beskriver plateepitelkarsinom (‘the Ugly’).
Del 1: ‘The Good’ (?) – melanom
Etiologi og patogenese
Melanom, også kjent som ‘skimmel-kreft’, er en kreftform som er lett å kjenne igjen som faste, svartpigmenterte tumorer, som oftest lokalisert rundt naturlige kroppsåpninger. Som navnet antyder, rammer denne kreftformen hovedsakelig skimler – hester med andre farger rammes langt sjeldnere, og da gjerne på mer atypiske lokalisasjoner.
Skimmelfarge er en autosomal dominant egenskap, der homozygote hester (G/G) blir lyse i pelsen tidligere enn heterozygote (G/g). Den avblekbare fargen skyldes en mutasjon i syntaxin gen 17 som trolig stammer fra én enkelt stamfar (1). Mutasjonen medfører akselerert melanocyttproliferasjon i hårfolliklene som igjen resulterer i prematur utarming av stamceller med påfølgende depigmentering, slik at hesten blir lysere og lysere i fargen fra cirka 4 års alder. Mutasjonen medfører imidlertid også økt risiko for vitiligo samt neoplastisk transformasjon av melanocytter, og en ser en lineær økning i prevalens av melanomer på 4 %-8 % årlig hos skimler fra 4 års alder (2-4). Dette betyr med andre ord at jo eldre en skimmel blir, jo større er sannsynligheten for at den har melanomer, og forekomst av melanomer hos skimler eldre enn 15 år er rapportert til 52 %-75 % (2,3,5). Hos homozygote individ inntrer avblekningen tidligere, og disse hestene har også høyere prevalens av melanomer og får gjerne melanomer av større alvorlighetsgrad. Basisfargen spiller imidlertid også inn. Risiko for melanomer er større hos hester med svart basisfarge, deretter brun, mens lavest risiko sees ved rød basisfarge (6).
Kliniske funn og diagnostikk
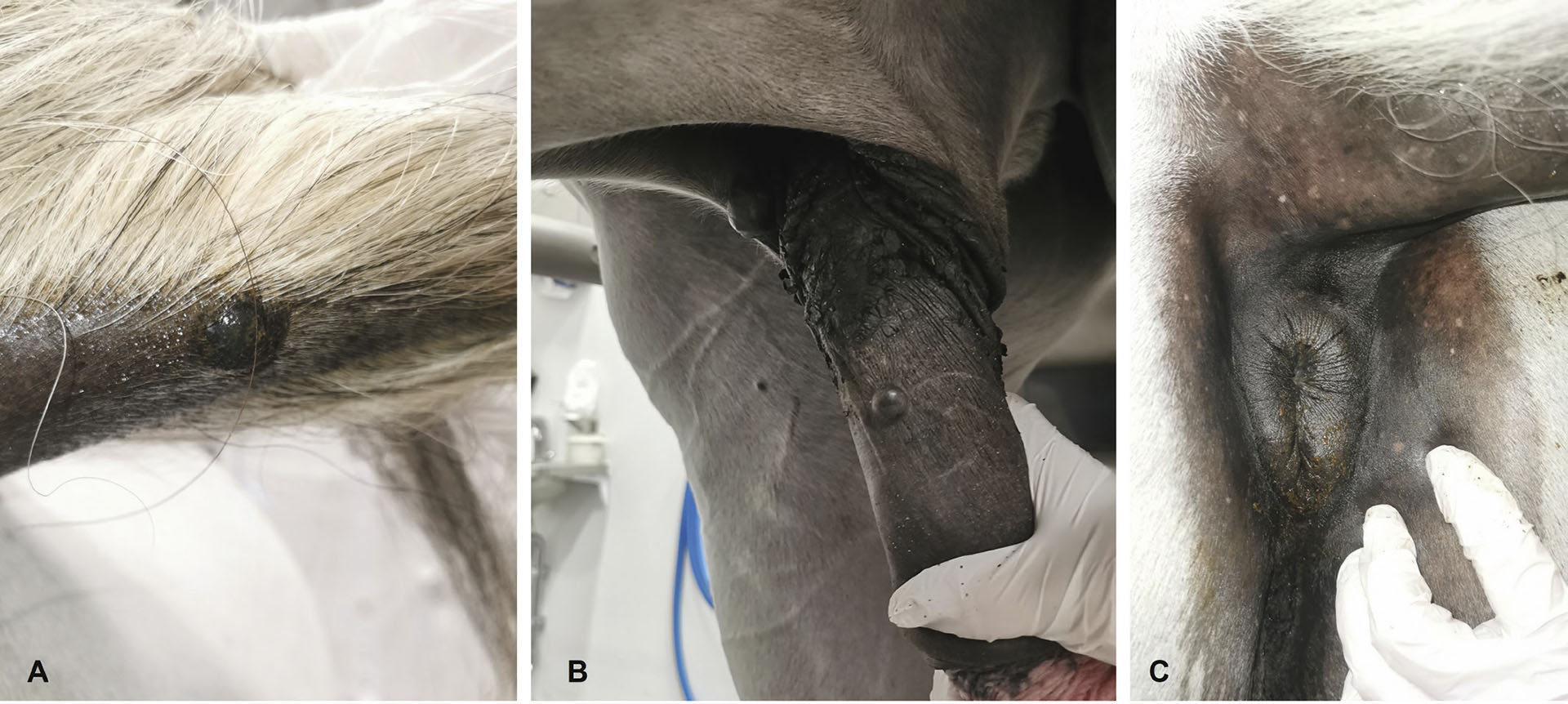
Figur 1. I tidlige stadier sees melanomer som solitære, faste, nodulære eller plakklignende lesjoner, med et karakteristisk svartpigmentert utseende.
A. Solitær, nodulær lesjon på undersiden av halen hos en varmblods ridehest vallak, 12 år. Foto: Cathrine Fjordbakk
B. Solitære, nodulære lesjoner på penis, preputium og på innsiden av låret. Foto: Cathrine Fjordbakk
C. Plakklignende lesjon ventrolateralt for anus. Alle bildene er fra den samme pasienten. Foto: Cathrine Fjordbakk

Figur 2.
A. Store, konfluerende perianale melanomer hos en varmblods ridehest, hoppe, 11 år. Svulstene obstruerer anus, som ikke lenger kan sees på grunn av sirkumferensielle lesjoner. I tillegg er det multiple, konfluerende lesjoner i perineum; den største er ulcerert og utsondrer et mørkfarget, illeluktende eksudat. Hos denne pasienten var også hele det ventrale aspektet av halen dekket av tumorer. På dette tidspunktet hadde hesten kliniske tegn til defekasjonsproblemer og irritasjon/ubehag i hele området. Foto: Cathrine Fjordbakk
B. Bildet er tatt et halvt år etter kirurgisk ‘de-bulking’ av lesjonene perianalt med rekonstruksjon av anus. Gjenstående svulster behandles med intralesjonal kjemoterapi. Hesten har ikke lenger defekasjonsproblemer, og viser ikke lenger tegn til ubehag. Inngrepet er imidlertid ikke kurativt, da hesten allerede på operasjonstidspunktet hadde tegn til metastaser. All behandling er dermed å regne som palliativ. Foto: Cathrine Fjordbakk
Melanomer ble tidligere delt inn i ulike typer avhengig av klinisk presentasjon, men svulsttypene lar seg ikke skille histologisk og representerer trolig heller ulike stadier av ett og samme sykdomskontinuum, som alle har malignt potensiale (7). Ved klinisk undersøkelse av melanomer bør disse klassifiseres etter alvorlighetsgrad (Tabell 1), og epidemiologiske data indikerer at lesjoner øker i alvorlighet med 0,3 grad per år (4). Dette betyr med andre ord at en nylig oppstått Grad 1 lesjon diagnostisert hos en 8-åring, vil kunne utvikle seg til Grad 4 i løpet av 10 år, og vil kunne bli til livstruende Grad 5 lesjoner to til tre år seinere (6).
I tidlige stadier opptrer svulstene som solitære, faste, nodulære eller plakklignende lesjoner, med et karakteristisk svartpigmentert utseende (Figur 1). Noen svulster kan være stilket, og multiple lesjoner er vanlig. De vanligste predileksjonsstedene er ubehåret hud langs ventrale aspekt av halen, perianalt, perineum og ytre kjønnsorgan. Ørespyttkjertelen, munnviker, øyelokk og ørebasis er noe mindre vanlige predileksjonssteder. Solitære lesjoner kan også forekomme andre steder på kroppen.
Grad |
Beskrivelse |
|---|---|
1 |
Tidlig stadium. Én solitær lesjon (< 0,5 cm) på en typisk lokalisasjon |
2 |
Flere lesjoner (< 0,5 cm), eller én lesjon (< 2 cm) på typiske lokalisasjoner |
3 |
Én eller flere lesjoner (< 5 cm), intra- eller subkutant, på typiske lokalisasjoner eller lepper |
4 |
Ekstensive konfluerende subkutane lesjoner med nekrose og ulcerasjon, metastaser |
5 |
Eksofytisk vekst av lesjonene; våt overflate og ulcerasjon; metastaser som gir kliniske tegn |
Kliniske tegn relatert til primærtumoren(e) og metastasene avhenger av lesjonenes størrelse – ofte dreier det seg om en masseeffekt som trykker på eller fortrenger det normale vevet i området. For eksempel kan perianale lesjoner medføre defekasjonsproblemer, mens metastaser i parotisregionen kan gi problemer ved bruk av grime eller hodelag (Figur 3). Lesjoner i dette området kan også bli så store at hesten får problemer med å bøye hodet. Metastaser i luftsekkene kan gi Horners syndrom, mens metastaser i bukvegg og indre organ kan gi opphav til vekttap og kolikk (9).

Figur 3. Transversalt CT-bilde av hodet til en varmblods ridehest hoppe, 12 år, på høyde med larynx (rett kaudalt for laryngealventriklene). Høyre side er til høyre på bildet. Hesten presenterte med en stor, knudrete masse i høyre ørespyttkjertel, dekket av normal hud, samt et 2 cm nodulært melanom ventralt på halen. Massen i ørespyttkjertelen var på dette tidspunktet til hinder for bruk av grime/hodelag, og hindret normal bevegelighet av hode og nakke. CT-undersøkelsen avdekket en stor multilobulær nydannelse i gl. parotis, i utstrekning fra ytre ørekanal og frem til høyre kjevegren. Massen sees som multiple, runde/ovale, velavgrensede hyperattenuerte og delvis mineraliserte lesjoner. Til sammenligning er den venstre siden normal. Hesten ble avlivet på grunn av omfanget av lesjonene. Obduksjon viste infiltrasjon av lymfekar fra halesvulsten, samt et større, multilobulært melanom i høyre gl.parotis som målte cirka 8x4x4 cm, med infiltrasjon av omkringliggende bløtvev av enkelte mindre nodulære lesjoner. Det ble også funnet multiple metastaser langs oesophagus, helt ned til brystaperturen.
Foto: Veterinærhøgskolen Dyresykehuset – hest
Diagnosen stilles som oftest basert på karakteristiske kliniske funn. Er man i tvil kan mørkt pigment sees makroskopisk ved finnålsaspirat (8), som ved cytologisk undersøkelse viser pleomorfe og atypiske melanocytter. Histologisk er melanomer karakterisert av atypiske melanocytter arrangert i flak, klynger eller strenger, men verken lokalisasjon eller histologiske funn predikerer hvordan lesjonen vil utvikle seg over tid, eller metastaserisiko (9).
Solitære, saktevoksende svulster med tilsynelatende begrenset klinisk relevans har tidligere ofte blitt regnet som ufarlige (‘the good’), med den konsekvensen at de har blitt ignorert av både eiere og veterinærer. Histologi av slike svulster viser derimot kankrøse trekk slik at selv små, solitære, tilsynelatende ubetydelige melanomer skal betraktes som pre-kankrøse med potensiale for lokal invasjon og metastaser (7,9,10). Etter hvert som hesten blir eldre, vil gjerne lesjonene tilta i størrelse og bli mer invasive, og kan danne konfluerende lesjoner spesielt perianalt og i perineum (Figur 2). Større lesjoner kan ulcerere, og eksudere et mørkfarget, illeluktende sekret (7). Risikoen for hematogent og/eller lymfatisk spredte metastaser øker jo eldre hesten blir. Metastaser er funnet i nær sagt alle indre organ og vev og sees blant annet i lymfeknuter, langs blodkar, i luftsekkene, vertebralkanalen, tarmvegg, lever, milt, skjelettmuskulatur og lunger (9). Plutselig endring i vekstraten av melanomer som tidligere har vært forholdsvis stabile, er et tegn på malign transformasjon og økt metastase-risiko. Så mye som 66 % av alle melanomer regnes å bli maligne i løpet av hestens levetid (11). Det metastatiske potensialet underbygges av obduksjonsfunn, der 2/3 av obduserte skimler hadde metastaser til indre organ (12). På den andre siden demonstreres den forebyggende effekten av tidlig behandling, det vil si kirurgisk fjerning av Grad 1 lesjoner etter hvert som de oppdages, av at ingen av 18 hester behandlet på denne måten fra 2-4 års alder hadde tegn til melanomer da de var 22 år gamle (8). Eierne til 5 hester i den samme studien ønsket ikke tidlig behandling. Av disse ubehandlede hestene døde én av andre årsaker i løpet av studieperioden; én hest måtte opereres på et senere tidspunkt på grunn av svulstekspansjon; mens de 3 siste hestene ble avlivet i 15 – 20 års alderen grunnet alvorlighetsgraden av melanomene (8).
Behandlinger og prognoser
I en nylig publisert litteraturgjennomgang av 23 artikler om behandling av melanomer, ble kirurgi funnet å være den behandlingsformen som ga best respons på behandling (lokal kurativ respons for 93,1 % av lesjonene), etterfulgt av intralesjonal kjemoterapi (delvis eller kurativ respons i 90 % av lesjonene). Disse to behandlingsformene brukes også ofte i kombinasjon. Derimot hadde ulike former for immunterapi delvis eller kurativ respons kun i cirka 40 % av tilfellene (13). Da de fleste immunologiske behandlingsformene foreløpig regnes som eksperimentelle, slik som autologe vaksiner og DNA-vaksiner kodet for IL-12 og IL-18 eller for ulike tumorspesifikke antigen, blir disse ikke nærmere omtalt i denne artikkelen og leseren henvises til referanselitteraturen. Det pågår imidlertid omfattende forskningsaktivitet på immunterapi for ulike kreftformer hos mange arter, inkludert hest, slik at dette forhåpentligvis vil kunne resultere i effektive behandlingsformer også for hudsvulster hos hest på sikt. Stråleterapi omtales heller ikke i denne artikkelen, da denne type behandling kun tilbys et fåtall steder i verden og foreløpig ikke i Norge. Leseren henvises til Henson et al (14) og Hollis (15).
Kirurgi
Grad 1 og 2 lesjoner bør fjernes kirurgisk så fort de oppdages - jo mindre lesjonen er på behandlingstidspunktet, jo lettere er den å behandle, og jo mindre risiko vil hesten ha for videre svulstutvikling (8). I motsetning til andre vanlige hudsvulster, er solitære melanomer ofte takknemlige å fjerne kirurgisk – de er velavgrensede, og kan ofte lett fridissekeres fra omkringliggende vev med liten risiko for lokalt residiv (6). Både konvensjonell skalpell og andre metoder slik som elektrokirurgi og laserkirurgi kan brukes. Mindre lesjoner og lesjoner lett tilgjengelige fjernes enkelt under stående sedasjon og lokalbedøvelse med skalpell eller ved bruk av en biopsipunch, og snittet kan stå åpent for sekundær sårheling. Større lesjoner eller lesjoner vanskelig tilgjengelig fjernes best under generell anestesi. Rekonstruksjonsteknikker brukes ved behov, for eksempel ved eksisjon av periorbitale svulster, og ved partiell eller fullstendig eksisjon av større, konfluerende perianale svulster.
Kjemoterapi og elektrokjemoterapi
Kirurgi er altså førstevalget for behandling av solitære melanomer, og er kurativt for den enkelte lesjon. Dersom lesjonen ikke lar seg fjerne kirurgisk i sin helhet, enten på grunn av størrelse eller lokalisasjon, anbefales partiell reseksjon kombinert med intralesjonal kjemoterapi med platinoler. Ingen større Grad 3 eller Grad 4 lesjoner behandlet på denne måten viste residiv i løpet av en oppfølgingsperiode på 1 til 13,5 år (16). Intralesjonal kjemoterapi med platinoler kan også brukes alene, 87,5 % av svulster opp til 5 cm i diameter behandlet kun med intralesjonal kjemoterapi ble eliminert og viste ikke residiv i løpet av en oppfølgingsperiode på 2 år (17). Nye lesjoner forekom imidlertid på andre lokalisasjoner gjennom oppfølgingsperioden.
Rasjonale for topikal eller intralesjonal kjemoterapi er å oppnå en høy terapeutisk konsentrasjon i tumoren over tid, uten å påvirke omkringliggende normalt vev. Lokal administrasjon av legemiddelet tas i liten grad opp i den systemiske sirkulasjonen slik at systemisk toksisitet holdes på et minimum, noe som er spesielt gunstig for svært toksiske forbindelser slik som platinoler. De vanlig brukte platinolene er cisplatin og carboplatin. Disse regnes som bioekvivalente og hemmer celledeling via kryssbinding av puriner og induserer apoptose (18). På grunn av stoffenes toksisitet (teratogene, mutagene og karsinogene egenskaper) skal all håndtering av platinoler gjøres under strenge HMS-rutiner. Både behandlende veterinær og personell som assisterer ved prosedyren må bruke nødvendig verneutstyr (Figur 4), og alt kontaminert forbruksmateriell skal håndteres som risikoavfall. For å minimere lekkasjerisiko brukes små kanyler (22G eller 23G) og Luer-Lok sprøyter under selve injeksjonene. Det vites ikke hvor lenge det behandlede vevet er å regne som cytotoksisk.

Figur 4. Intralesjonal kjemoterapibehandling (carboplatin i en jordnøttolje emulsjon) av et periokulært ekvint sarkoid. Både behandlende veterinær og personell som assisterer ved prosedyren skal bruke verneutstyr som inkluderer vernebriller/visir og åndedrettsvern, vannavstøtende frakk og nitrilhansker. Hanskene trekkes godt opp på frakken for å unngå eksponert hud. Injeksjonen foretas ved bruk av tynne kanyler (22 – 23G) koblet til LuerLok sprøyter. Alt brukt og kontaminert forbruksmateriell skal håndteres som risikoavfall. All rekonstituering av cytostatika som foreligger som tørrstoff, skal foregå i avtrekksskap og med godkjent åndedrettsvern – vanlige munnbind er ikke tilstrekkelig.
Foto: Cathrine Fjordbakk
Ved intralesjonal injeksjon av cytostatika ønsker man å mette svulstvevet med 1 mg av aktivt virkestoff per cm3. For å oppnå en lokal depot-effekt, og dermed en mer langvarig effekt i svulstvevet, blandes en 10 mg/mL løsning av legemiddelet med en steril olje (fortrinnsvis sesamolje eller jordnøttolje) til en endelig emulsjonskonsentrasjon på 3,3 mg/mL. Dersom en svakere legemiddelløsning brukes, blir den endelige emulsjonskonsentrasjonen mindre effektiv. Per i dag er carboplatin humanregistrert og tilgjengelig i en konsentrasjon på 10 mg/mL, mens det registrerte cisplatinpreparatet kun er tilgjengelig som 1 mg/mL. For melanomer og tumorer av vaskulær opprinnelse kan emulsjonen også tilsettes adrenalin for å oppnå en enda bedre lokal effekt (17).
Både svulsten og svulstsengen injiseres med emulsjonen i et systematisk rutemønster i flere plan. Injeksjonsteknikken er avgjørende for behandlingseffekten da platinolene ikke diffunderer lengre enn 5 mm fra injeksjonsstedet. Det bør dermed ikke være lengre avstand mellom injeksjonsradene enn 6 – 10 mm og ortogonale injeksjonsakser er som oftest nødvendig. Mangelfull respons på behandling regnes i hovedsak å skyldes feil injeksjonsteknikk (17). Et vanlig brukt behandlingsregime er minimum 4 behandlinger med 2 ukers mellomrom (17,19). Flere behandlinger kan være nødvendig for å oppnå full remisjon. Denne behandlingen har også blitt gitt til drektige hopper og avlshingster uten å gi fosterskader eller nedsatt fertilitet (17). Bivirkninger dreier seg i hovedsak om lokal inflammasjon og irritasjon på injeksjonsstedet som er mer uttalt etter den tredje og fjerde injeksjonen (17). Respons på behandling sees som at svulstene krymper i volum, enkelte kan imidlertid også ulcerere.
Elektrokjemoterapi potenserer cytotoksisiteten av cytostatika ved å øke cellemembranens permeabilitet ved hjelp av strømpulser, slik at opptak av legemiddelet øker. Svulsten injiseres først med cytostatika etter samme regime som beskrevet over, før den utsettes for bifasiske strømpulser levert gjennom spesialelektroder implantert i svulstvevet. Siden strømpulsene når begrenset ned i vevet angitt til en dybde på 1 cm, forbeholdes elektrokjemoterapi små lesjoner eller brukt i kombinasjon med partiell kirurgisk reseksjon (20). To behandlinger gitt med to ukers mellomrom enten brukt alene, eller i kombinasjon med partiell kirurgisk reseksjon, ga delvis eller fullstendig respons hos henholdsvis 5/9 og 3/9 hester med melanomer på ulike lokalisasjoner (21).
Immunterapi
En melanomvaksine markedsført til hund er angitt å kunne øke levetiden til hunder diagnostisert med malignt melanom i stadie 2 til 4 dersom den brukes som tilleggsbehandling til kirurgi. Selv om denne vaksinen anekdotisk har blitt brukt til hest over flere år, finnes det ingen studier som angir responsrate eller eventuelle bivirkninger (6,13).
I en kasuistikk ble cimetidin, en histamin type II reseptor antagonist, angitt å redusere svulststørrelsen hos 3 hester med multifokale melanomer (22). Tilsvarende effekt har ikke blitt ettervist i senere studier, heller ikke ved bruk av høyere doser enn i den opprinnelige kasuistikken (23). Cimetidin anbefales ikke brukt til melanomer på grunn av manglende effekt.
Konklusjon
Selv om små, solitære og saktevoksende melanomer kan virke tilsynelatende ufarlige, har selv den minste svulst et potensiale for lokal invasjon og metastaser over tid. En avventende holdning til disse vil med andre ord medføre unødig risiko for en mye mer alvorlig tilstand på et senere tidspunkt. Små, solitære svulster lar seg enkelt fjerne kirurgisk, og er kurativt for den enkelte lesjon. Store, konfluerende lesjoner lar seg derimot mye vanskeligere behandle, og er oftere forbundet med etablerte metastaser.
Sammendrag
Melanom er en vanlig forekommende hudsvulst hos hester med skimmel-farge, siden mutasjonen som gir opphav til skimmelfargen også disponerer for neoplastisk transformasjon av melanocytter. Predileksjonssteder er ubehåret hud langs ventrale aspekt av halen, perianalt, perineum og ytre kjønnsorgan. I tidlige stadier opptrer svulstene som solitære, faste, nodulære eller plakk-lignende lesjoner, med et karakteristisk svartpigmentert utseende. Etter hvert som hesten blir eldre, vil gjerne lesjonene tilta i størrelse og bli mer invasive, og kan danne konfluerende lesjoner spesielt perianalt og i perineum. Større lesjoner kan ulcerere, og eksudere et mørkfarget, illeluktende sekret. Risikoen for hematogent og/eller lymfatisk spredte metastaser øker med alderen. Selv små, solitære og saktevoksende svulster har et potensiale for lokal invasjon og metastaser, og så mye som 66 % av alle melanomer antas å bli maligne i løpet av hestens levetid. Tidlig diagnostikk og behandling er dermed essensielt for å redusere risiko for alvorlig sykdom på sikt. Små, solitære svulster lar seg enkelt fjerne kirurgisk, og er kurativt for den enkelte lesjon. Større lesjoner kan la seg behandle med en kombinasjon av kirurgi og intralesjonal kjemoterapi. Jo større lesjonen er på behandlingstidspunktet, jo større er risikoen for at svulsten allerede har metastasert, samt at selve behandlingen blir av en langt mer invasiv karakter. En forebyggende tilnærming til disse svulstene, der små svulster fjernes etter hvert som de oppdages, er den beste strategien for å minimere risiko for uhelbredelige melanomer og/eller metastaser etter hvert som hesten aldres.
Summary
Melanoma is a common skin tumor of grey horses, as the mutation responsible for the grey coat color also predisposes for melanomas. Predilection sites are non-haired skin along the ventral aspect of the tail; in the perianal and perineal region; and on external genitalia. In the early stages of tumor development, melanomas are seen as black pigmented small, solitary, firm nodular or plaque-like lesions. With age, the tumors increase in size and become more locally invasive and may form confluent larger lesions, especially in the perianal and perineum region. Larger lesions may ulcerate and exude a dark, foul-smelling exudate. The risk of hematogenous or lymphatic metastases increase with age. However, even small, solitary, and slow-growing lesions have the potential for local invasion and metastasis, and 66 % of all melanomas are believed to become malignant during the horse’s lifespan. Early diagnosis and treatment are essential to reduce the risk of incurable disease long-term. Small, solitary tumors are amenable to surgical excision, which is curative for the respective lesion. Larger lesions may be treated with a combination of surgical debulking and intralesional chemotherapy. The larger the lesion at the time of treatment, the larger the risk of metastases as well as the more invasive treatment methods necessary. A preemptive approach where small melanomas are surgically removed when they occur, is the best strategy in minimizing risk of incurable disease and/or metastases as the horse age.
Referanser
Rosengren Pielberg G, Golovko A, Sundström E, Curik I, Lennartsson J, Seltenhammer MH et al. A cis-acting regulatory mutation causes premature hair graying and susceptibility to melanoma in the horse. Nat Genet 2008;40:1004-9.
Fleury C, Bérard F, Leblond A, Faure C, Ganem N, Thomas L. The study of cutaneous melanomas in Camargue-type gray-skinned horses (2): epidemiological survey. Pigment Cell Res 2000;13:47-51.
Teixeira RBC, Rendahl AK, Anderson SM, Mickelson JR, Sigler D, Buchanan BR et al. Coat color genotypes and risk and severity of melanoma in gray Quarter horses. J Vet Intern Med 2013;27:1201-9.
Hofmanová B, Vostrý L, Majzlík I, Vostrá-Vydrová H. Characterization of greying, melanoma, and vitiligo quantitative inheritance in Old Kladruber horses. Czech J Anim Sci 2015;60:443-51.
Seltenhammer MH, Simhofer H, Scherzer S, Zechner R, Curik I, Sölkner J et al. Equine melanoma in a population of 296 grey Lipizzaner horses. Equine Vet J 2003;35:153-7.
MacKay RJ. Treatment options for melanoma of gray horses. Vet Clin North Am Equine Pract 2019;35:311-25.
Moore JS, Shaw C, Shaw E, Buechner-Maxwell V, Scarratt WK, Crisman M et al. Melanoma in horses: current perspectives. Equine Vet Educ 2013;25:144-51.
Sullins KE. Melanocytic tumours in horses. Equine Vet Educ 2020;32:624-30.
MacGillivray KC, Sweeney RW, Del Piero F. Metastatic melanoma in horses. J Vet Intern Med 2002;16:452-6.
Fleury C, Bérard F, Balme B, Thomas L. The study of cutaneous melanomas in Camargue-type gray-skinned horses (1): clinical-pathological characterization. Pigment Cell Res 2000;13:39-46.
Gorham S, Robl M. Melanoma in the grey horse: the darker side of equine aging. Vet Med 1986;81:446-8.
Garvican ER, Elce YA, Woolard K, Blikslager AT. Preputial melanoma with systemic metastasis in a pony gelding and disseminated metastatic melanoma in a Thouroughbred gelding. Equine Ved Educ 2007;19:312-5.
Yi Z, Gao Y, Yu F, Zhu Y, Liu H, Li J et al. Interventions for treatment of cutaneous melanoma in horses: a structured literature review. Vet Res Commun 2023;47:347-60.
Henson FMD, Dobson JM. Use of radiation therapy in the treatment of equine neoplasia. Equine Vet Educ 2004;16:315-8.
Hollis AR. Radiotherapy for the treatment of periocular tumours in the horse. Equine Vet Educ 2019;31:647-52.
Groom LM, Sullins KE. Surgical excision of large melanocytic tumours in grey horses: 38 cases (2001–2013). Equine Vet Educ 2018;30:438-43.
Théon AP, Wilson WD, Magdesian KG, Pusterla N, Snyder JR, Galuppo LD. Long-term outcome associated with intratumoral chemotherapy with cisplatin for cutaneous tumors in equidae: 573 cases (1995–2004). J Am Vet Med Assoc 2007;230:1505-13.
Khosla S, Kennedy L, Abdulaal Y. Cisplatin induced acute mesenteric ischaemia: a case report and review of the literature. Int J Surg Case Rep 2017:41:347-51.
Goodrich LR, Semevolos SA. How to prepare and inject cisplatin in oily emulsion to treat equine sarcoids and squamous cell carcinomas. I: Proceedings of 46th Annual Convention of the American Association of Equine Practitioners. San Antonio, Texas 2000:173-5.
Tamzali Y, Borde L, Rols MP, Golzio M, Lyazrhi F, Teissie J. Successful treatment of equine sarcoids with cisplatin electrochemotherapy: a retrospective study of 48 cases. Equine Vet J 2012;44:214-20.
Spugnini EP, Scacco L, Bolaffio C, Baldi A. Electrochemotherapy for the treatment of cutaneous solid tumors in equids: a retrospective study. Open Vet J 2021;11:385-9.
Goetz TE, Ogilvie GK, Keegan KG, Johnson PJ. Cimetidine for treatment of melanomas in three horses. J Am Vet Med Assoc 1990;196:449-52.
Laus F, Cerquetella M, Paggi E, Ippedico G, Argentieri M, Castellano G et al. Evaluation of cimetidine as a therapy for dermal melanomatosis in grey horse. Isr J Vet Med 2010;65:48-52.