Her er diagnosen!
En hund med stranguri
Cytologisk vurdering av urinpreparat
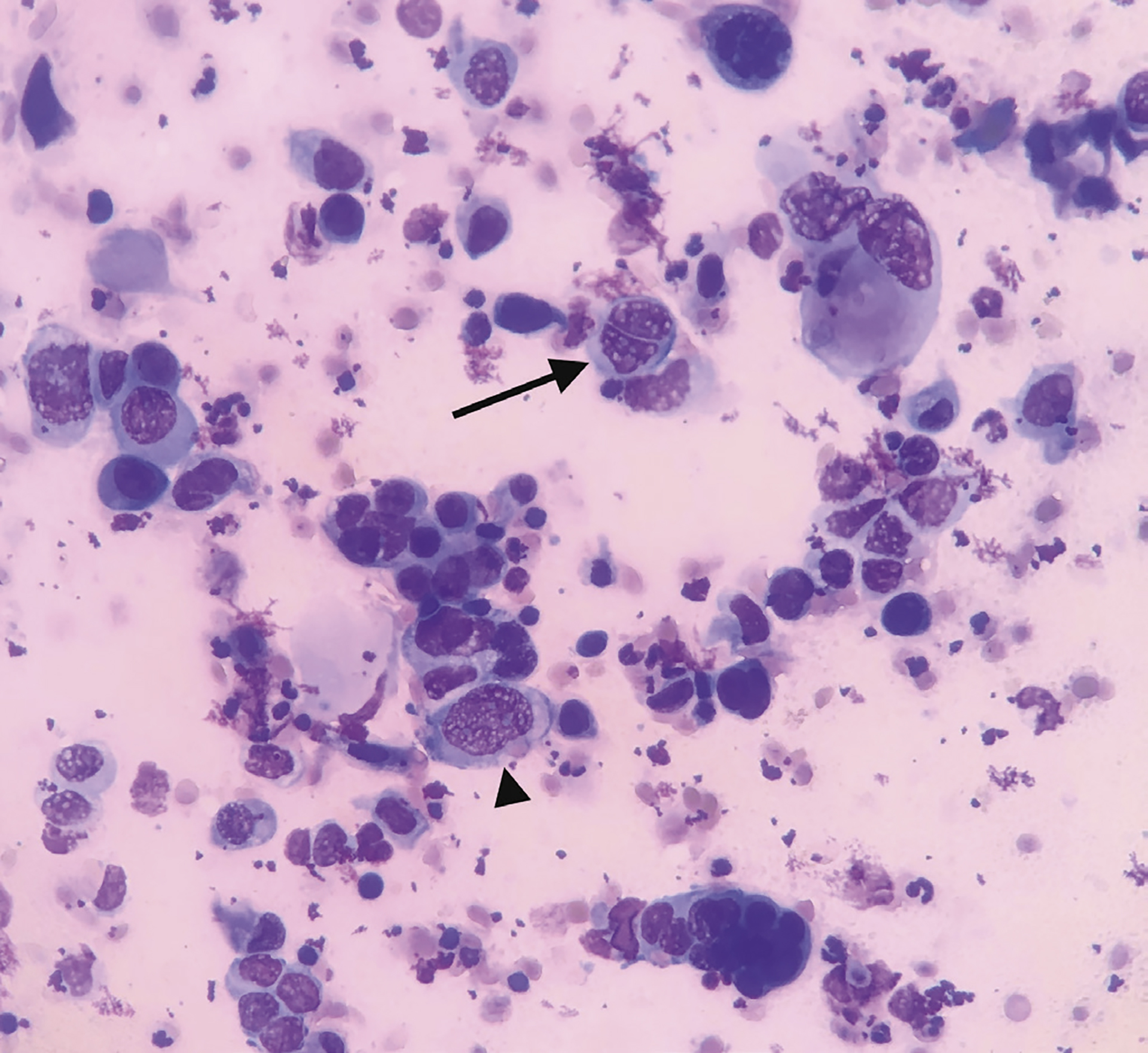
Figur 2b: Tørrpreparat fra urinkatetertupp, Diff-quikTM farging. Flerkjernet celle med grovkornet kromatin (Sort pil). Tydelige nukleoler (Sort pilhode).
Foto: Cecilie Benedicte Meidel-Røssum
De cytologiske prøvene ble undersøkt av europeisk spesialist i klinisk patologi og viste følgende funn: Granulær bakgrunn med amorft materiale, celledebris, nakne cellekjerner og røde blodceller forenlig med inngrepsblødning. Polygonale til runde celler med epitelialt preg av variabel størrelse dominerte bildet. Cellene hadde runde til irregulære, eksentrisk orienterte kjerner med tydelige nukleoler og rikelig basofilt cytoplasma. Det var moderat til markert anisokaryose og enkelte flerkjernede celler (Figur 2b).
Cytologisk diagnose
De cytologiske funnene var forenlige med urotelialt karsinom.
Cystoskopi
Det ble besluttet å gå videre med cystoskopi for å få oversikt over vagina, urinrør, blærehals, innside av blærevegg og urinlederutmunningene. Pasienten ble premedisinert med 0,2 mg/kg metadonhydroklorid (Metadon, NAF) kombinert med 2,9 µg/kg medetomidin (Domitor®, Orion Pharma) intramuskulært.
Anestesi ble indusert med 1,7 mg/kg Propofol (Propovet multidose, Zoetis) intravenøst, og hunden ble intubert. Generell anestesi ble vedlikeholdt med Isofluran (IsoFlo vet., Zoetis) 1,0-1,5 %. Hunden ble undersøkt i dorsalt leie. Et 3,5 mm fleksibelt videoendoskop (Karl Stortz) med 1,2 mm arbeidskanal ble benyttet.
Cystoskopisk undersøkelse viste en stor, papillomatøs, ikke-ulcerert masse med bred basis, som var adherent til dorsale blærevegg i området for trigonen (Figur 3). Urinlederutmunningene kunne ikke visualiseres grunnet den overliggende massen. Blæreveggens innside ble makroskopisk vurdert som normal.
Endelig diagnose
Urotelialt karsinom (tidligere benevnt transitional cell carsinoma (TCC)/overganscellekarsinom), med sekundær hydronefrose.
Videre oppfølging
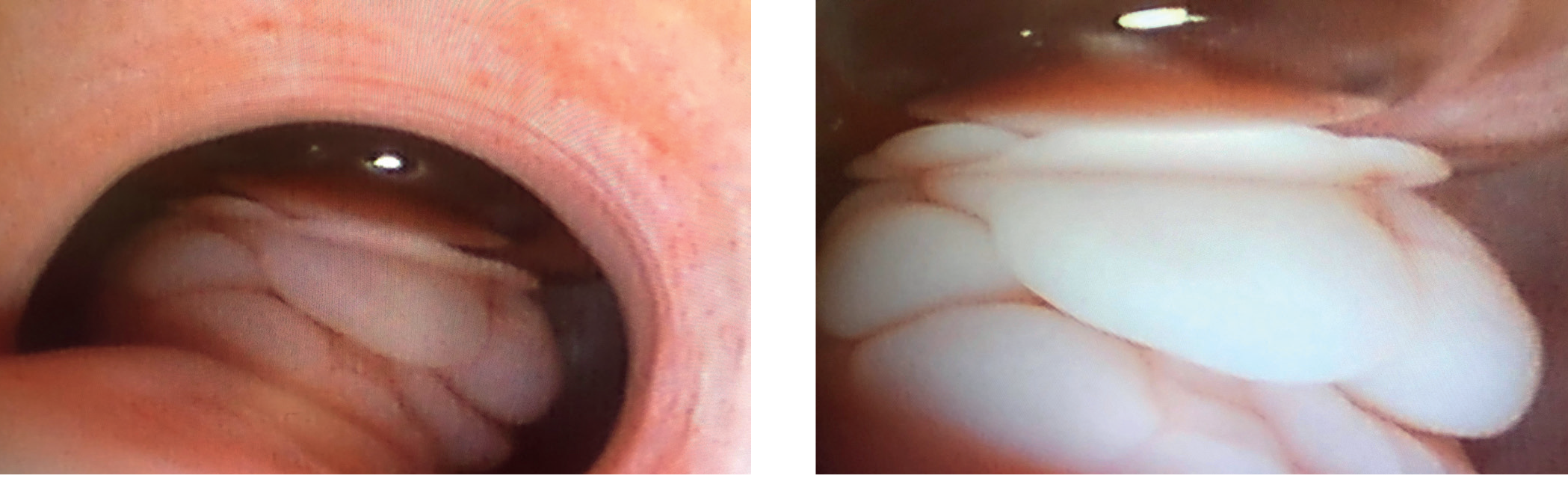
Figur 3: Cystoskopiske bilder ved overgang urethrasfinkter/vesica. Dorsalt er nederst i bildet. Stor, papillomatøs, ikke-ulcerert masse adherent til dorsale blærevegg i trigonen.
Foto: Cecilie Benedicte Meidel-Røssum
Eier ble forelagt informasjon om diagnose, mulighet for videre stadiumsbestemmelse inkludert røntgen thorax og finnålsaspirat av regionale lymfeknuter. Det ble diskutert behandlingsmuligheter (inkludert stenting) og prognose. Dyrevelferdsmessige aspekter ble vurdert, og eier ble informert om fare for blæreruptur, samt eventuelle kliniske tegn på nyresvikt. Eier ønsket ikke videre stadiumbestemmelse, men ønsket å ha hunden hjemme så lenge den hadde god allmenntilstand og livskvalitet. Pasienten ble forskrevet piroxicam 0,35 mg/kg én gang daglig i to dager, deretter 0,35 mg/kg hver annen dag. Det ble avtalt at eier tok kontakt ved endring i urineringsmønster, allmenntilstand eller dersom hunden utviklet andre kliniske tegn. Det ble uansett avtalt revurdering av status etter cirka 1 måned.
Utfall
Hunden ble avlivet av dyrevernmessige hensyn, én måned og fire dager etter diagnosetidspunktet.
Diskusjon
Urotelialt karsinom (Invasive urothelial carcinoma), er den vanligste formen for neoplasi i urinveiene hos hund (1). Andre neoplasier i urinveiene, som leiomyosarkomer og lymfomer, er også beskrevet (2,3). Metastatiske urinblæreneoplasier er sjelden hos hund, mens lokal invasjon fra urethra eller prostata er vanlig forekommende (4). Urinblæreneoplasier utgjør cirka 2 % av alle maligniteter hos hund.
Urotelialt karsinom er vanligvis en høygradig, papillær, invasiv kreftform, og sykdommen er ofte lokalt fremskreden når diagnosen stilles (4,5). Tumoren er oftest lokalisert i trigonen, og dette sammen med hyppig affeksjon av urethra fører til at de kliniske tegnene dysuri, hematuri, pollakiuri og stranguri oftest er assosiert med sykdom i nedre urinveier (4,5), og dermed ikke mulig å skille fra kliniske tegn ved urinveisinfeksjoner og andre sykdommer i nedre urinveier. Antibiotikabehandling kan gi midlertidig bedring av de kliniske tegnene, da urotelialt karsinom disponerer for UVI og mange pasienter/hunder initialt presenterer med dette. Halthet kan også forekomme dersom det er metastaser til knokkel eller hypertrofisk osteopati.
Urethra og prostata er ofte involvert (henholdsvis 56 % og 29 %) ved diagnosetidspunktet (4). Spredningspotensialet for uroteliale karsinomer er generelt høyt. Ved diagnosetidspunktet har 16 % spredning til regional lymfeknute, mens 14-20 % av pasientene har fjernmetastaser (5). Ved dødstidspunktet er det angitt at hele 49-58 % har metastatisk sykdom (4,5). Påvisning av metastaser ved diagnosetidspunktet er assosiert med en dårligere prognose (4).
Til tross for høyt metastatisk potensiale, er progresjon av lokal sykdom med påfølgende obstruksjon av urinveiene dødsårsaken for mange hunder med urotelialt karsinom. En studie dokumenterte at dødsårsak var knyttet til primærtumor hos 61 % av affiserte hunder. Metastaser og sykdom ikke relatert til urotelialt karsinom ble rapportert som dødsårsak blant henholdsvis 14 % og 25 % i samme studie (6).
Risikofaktorer for utvikling av urotelialt karsinom inkluderer eksponering for eldre typer ektoparasittmidler, kjemikaler til hagebruk og insekticider, overvekt, hunnkjønn, tidligere kastrering samt raserelatert risiko (5). De kliniske tegnene ved urotelialt karsinom er de samme som ved UVI. Det er derfor viktig å være oppmerksom på denne diagnosen hos eldre hunder, særlig hos predisponerte raser (Tabell 1) eller ved tilbakevendende symptomer etter behandlet UVI. Diagnosen er derfor både av betydning på individnivå, og for å redusere unødig antibiotikabruk. Urotelialt karsinom affiserer i hovedsak eldre individer, median alder for 102 pasienter innlagt ved Purdue University Veterinary Teaching Hospital var 11,05 år (6).
Rase |
OR med blandingshund som referanse |
|---|---|
Blandingshund |
1,00 |
Skotsk terrier |
21,12 |
Eskimohund |
6,58 |
Shetland sheepdog |
6,05 |
West highland white terrier |
5,84 |
Keeshond |
4,26 |
Samojed |
3,43 |
Beagle |
3,09 |
Dalmatiner |
2,43 |
OR = Odds ratio
Diagnosen stilles ved histopatologisk undersøkelse av vevsbiopsier fra eksplorativ laparotomi, cystoskopi eller ved diagnostisk kateterisering. Biopsier via transuretral cystoskopi er rapportert å være diagnostiske i 96 % og 65 % av tilfellene hos henholdsvis tisper og hannhunder (7). Perkutane aspirater og biopsier bør unngås grunnet risiko for spredning langs stikkanalen (4,5). En nyere studie har vist at cytologi utført på histologiske prøver (klempreparater) har 98 % sensitivitet og 65 % spesifisitet (8). En retrospektiv studie av 298 kasus, utført ved to separate institusjoner, viste 100 % sensitivitet og spesifisitet for de 11 kasusene der cytologi ble utført på prøver fra diagnostisk kateterisering (9). Det var diagnostisk kateterisering som ble benyttet for uttak av cytologi hos pasienten i denne kasuistikken. PCR for deteksjon av BRAF V595E genmutasjon er rapportert å ha en sensitivitet på 70,9-85 % og spesifisitet på 100 % ved testing av skålurin fra hunder med både prostata- og uroteliale tumorer (4).
Det ble ikke tatt ut cystoskopiske biopsier hos denne pasienten ettersom 1,0 mm biopsitang ikke var tilgjengelig på undersøkelsestidspunktet. Ettersom histologisk diagnose i dette kasuset ikke forelå, kunne man valgt å understøtte den cytologiske diagnosen, urotelialt karsinom, med for eksempel PCR-test for BRAF V595E. Dette ville teoretisk sett kunne styrket sikkerheten i diagnostikken, men basert på ovennevnte rapporterte sensitivitet ved cytologi (9) samt øvrige kliniske funn, ble diagnosen vurdert som tilstrekkelig sikker.
En WHO-retningslinje fra 1998 beskriver anbefalt stadiumsbestemmelse for blæreneoplasier med mål om å angi prognose, samt å gi retningslinjer for behandling (10). Tumorgrad og såkalt TNM (tumor, nodes, metastasis) stadium etter WHOs klassifiseringssystemet har vist seg å korrelere godt med utfallet for disse pasientene (4). Hunden i denne kasuistikken hadde på diagnosetidspunktet omfattende renale skader. Dersom tumoren ikke responderte adekvat på medisinsk behandling, var disse forandringene forventet å progrediere raskt. Videre stadiumsbestemmelse for denne pasienten ble ikke utført som følge av en totalvurdering gjort i samråd med eier.
Ultralyd eller CT er anbefalt for å vurdere primærtumorens lokalisasjon før en eventuell kirurgisk intervensjon, samt for prognostisk informasjon og mål av tumoren for videre monitorering etter oppstart av behandling. Det er også mulig å monitorere størrelsen ved cystoskopi (4,5). Ultralyd har fordelen av at det kan gjøres på våken eller lett sedert hund, i motsetning til CT og cystoskopi som krever narkose. Undersøkelsen er imidlertid operatøravhengig og krever standardiserte prosedyrer for reproduserbarhet (4,5).
Medisinsk terapi ansees som bærebjelken i behandling av urotelialt karsinom hos hund. Denne behandlingen består av systemisk kjemoterapi, COX-inhibitorer (selektive og ikke-selektive) eller en kombinasjon av disse (11). Behandlingen er vanligvis ikke kurativ, men kan ofte gi midlertidig remisjon eller stabil sykdom, og de fleste behandlinger tolereres godt (11).
Ved Purdue University Veterinary Teaching Hospital har de utviklet et regime som involverer en kombinasjon av NSAIDs og kjemoterapi, som de hevder kontrollerer veksten i cirka 75 % av hundene og gir en overlevelse på 1 år eller mer (4). Tumorens størrelse måles før behandlingsoppstart, og deretter hver 4.-8. uke. Dersom progresjon av tumorvekst eller uakseptable bivirkninger av behandling oppstår, skifter de til et annet preparat (11).
For eiere som ønsker konservativ behandling begrenset til perorale preparater, er COX-inhibitorer et godt alternativ. Som monoterapi er oral piroxicam (0,3 mg/kg) daglig med mat en nyttig palliativ behandling som gir god livskvalitet (5). De fleste hunder tolererer piroxicam godt, men det er likevel viktig å være oppmerksom på gastrointestinale symptomer/gastrointestinale ulcerasjon, og seponere behandling dersom dette oppstår. I disse tilfellene vil det sannsynligvis være best å bytte til en selektiv COX 2 hemmer når symptomene på toksisitet har opphørt (5). En klinisk studie med bruk av piroxicam hos 76 hunder viste følgende resultater: Fullstendig remisjon i 2,6 %, partiell remisjon i 18,4 %, stabil sykdom hos 59,2 % og progressiv sykdom hos 19,7 %. Median overlevelse var 244 dager (12). Det er også gjort en studie på firocoxib som viste partiell remisjon i 20 % og stabil sykdom hos 30 % av hundene (13).
Når det kommer til kirurgisk behandling av urotelialt karsinom i urinveiene hos hund, har man med tiden blitt oppmerksom på at kirurgisk fjerning av primærtumor i blære/blærehals ikke nødvendigvis gir noen helsemessig gevinst for pasienten (4,5,14). Dette ettersom lokal tumorinvasjon i omkringliggende vev/strukturer samt fjernmetastaser vanligvis foreligger på diagnosetidspunktet.
Teknikker for fjerning av primærtumorer i trigoneområdet, samt total/subtotal cystektomi med inkorporering av graft for rekonstruksjon av urinblæren er beskrevet der kurativ kirurgi ble forsøkt. Men slik kirurgi er ikke lenger anbefalt fordi den ikke gir noen påviselig positiv langtidseffekt for pasienten og dermed ikke er forsvarlig basert på ubehaget og mulige komplikasjoner (4,5,14).
Indikasjoner for kirurgi hos disse pasientene er i dag hovedsakelig gjenoppretting av urinpassasje, biopsitagning eller eventuell fjerning av tumor dersom denne ikke er lokalisert i trigonen. Ved kirurgisk intervensjon er det imidlertid en ikke ubetydelig risiko for spredning av tumorceller til peritoneum, noe som er forbundet med en dårlig prognose da det er sett aggressiv vekst av metastasene med dårlig respons på medisinsk behandling (15). Median overlevelse for hunder med TCC i peritoneum i en studie var 57 dager (0-324 dager) (15).
Plassering av stent i urethra og/eller ureter kan gjøres ikke-kirurgisk ved hjelp av fluoroskopi (4,5). Mulige komplikasjoner inkluderer urininkontinens (26-38,8 %) (16- 18), migrasjon av stenten, reobstruksjon ettersom tumoren vokser og økt risiko for UVI. Median overlevelse etter plassering av stent var i en studie 78 dager (2-366) (16).
Strålingsterapi er foreløpig lite brukt. Det foreligger enkelte studier på bruk, men de har enten høy forekomst av bivirkninger og/eller ikke bedre effekt enn medisinsk behandling alene (5). En nyere studie viser lovende resultater av sorafenib på vekst av urotelialt karsinom tumorceller in vitro samt i musemodell (19).
Urotelialt karsinom har mange likheter med invasiv blærekreft hos mennesker. Det gjøres derfor forskning og fremskritt på dette hos hund, som deretter forhåpentligvis kan overføres til mennesker (5).
Etterskrift
Vi takker gode kollegaer ved Logre Veterinærklinikk og Evidensia Dyreklinikk Lillehammer for henvisning av denne pasienten.
Referanser
Valli VE, Norris A, Jacobs RM, Laing E, Withrow S, Macy D et al. Pathology of canine bladder and urethral cancer and correlation with tumour progression and survival. J Comp Pathol 1995;113:113-30.
Michishita M, Ishizaki Y, Konnai M, Machida Y, Nakahira R, Hatakeyama H et al. Primary lymphangiosarcoma of the urinary bladder in a dog. J Comp Pathol 2020;179:31-5.
Park J, Nam A, Lee HB, Jeong SM, Kim DH. Leiomyosarcoma of urinary bladder in a Shih Tzu dog. J Vet Med Sci 2022;84:799-803.
Griffin MA, Culp WTN, Rebhun RB. Lower urinary tract neoplasia. Vet Sci 2018;5:96.
Fulkerson CM, Knapp DW. Management of transitional cell carcinoma of the urinary bladder in dogs: a review. Vet J 2015;205:217-25.
Knapp DW, Glickman NW, Denicola DB, Bonney PL, Lin TL, Glickman LT. Naturally-occurring canine transitional cell carcinoma of the urinary bladder. A relevant model of human invasive bladder cancer. Urol Oncol 2000;5:47-59.
Childress MO, Adams LG, Ramos-Vara JA, Freeman LJ, He S, Constable PD et al. Results of biopsy via transurethral cystoscopy and cystotomy for diagnosis of transitional cell carcinoma of the urinary bladder and urethra in dogs: 92 cases (2003-2008). J Am Vet Med Assoc 2011;239:350-6.
Pierini A, Criscuolo MC, Bonfanti U, Benvenuti E, Marchetti V, Bottero E. Usefulness of squash preparation cytology in the diagnosis of canine urinary bladder carcinomas. Vet Clin Pathol 2022;51:498-506.
McAloney CA, Evans SJM, Hokamp JA, Wellman mL, White ME. Comparison of pathologist review protocols for cytologic detection of prostatic and urothelial carcinomas in canines: a bi-institutional retrospective study of 298 cases. Vet Comp Oncol 2021;19:374-80.
Epstein JI, Amin MB, Reuter VR, Mostofi FK. The World Health Organization/International Society of Urological Pathology consensus classification of urothelial (transitional cell) neoplasms of the urinary bladder. Bladder Consensus Conference Committee. Am J Surg Pathol 1998;22:1435-48.
Fulkerson CM, Knapp DW. Tumors of the urinary system. I: Vail DM, Thamm DH, Liptak JM, eds. Withrow & MacEwen’s small animal clinical oncology. 6th ed. St.Louis, Missouri: Elsevier, 2020: 645-56.
Knapp DW, Ramos-Vara, JA, Moore, GE, Dhawan, D, Bonney PL, Young KE. Urinary bladder cancer in dogs, a naturally occurring model for cancer biology and drug development. ILAR J 2014;55:100-18.
Knapp DW, Henry CJ, Widmer WR, Tan KM, Moore GE, Ramos-Vara JA et al. Randomized trial of cisplatin versus firocoxib versus cisplatin/firocoxib in dogs with transitional cell carcinoma of the urinary bladder. J Vet Intern Med 2013;27:126-33.
Tobias KM. Johnston SA. Bladder. I: Veterinary surgery: small animal. St.Louis, Missouri: Saunders, 2012: 1978-92.
Higuchi T, Burcham GN, Childress MO, Rohleder JJ, Bonney PL, Ramos-Vara JA et al. Characterization and treatment of transitional cell carcinoma of the abdominal wall in dogs: 24 cases (1985-2010). J Am Vet Med Assoc 2013;242:499-506.
McMillan SK, Knapp DW, Ramos-Vara JA, Bonney PL, Adams LG. Outcome of urethral stent placement for management of urethral obstruction secondary to transitional cell carcinoma in dogs: 19 cases (2007-2010). J Am Vet Med Assoc 2012;241:1627-32.
Blackburn A, Berent A, Weisse C, Brown DC. Urethral stenting in canine patients with urothelial carcinoma: a review of 41 cases (2004-2008). J Vet Intern Med 2010;24:676.
Weisse C, Berent A, Todd K, Clifford C, Solomon J. Evaluation of palliative stenting for management of malignant urethral obstructions in dogs. J Am Vet Med Assoc 2006;229:226-34.
Yokota S, Yonezawa T, Momoi Y, Maeda S. Sorafenib inhibits tumor cell growth and angiogenesis in canine transitional cell carcinoma. J Vet Med Sci 2022;84:666-74.