Plantealkaloidet taxol – historien om barlindslektens (Taxus) bidrag til kreftbehandling
Det er estimert at omkring 25 % av samtlige legemidler som forskrives stammer fra en naturlig kilde, svært ofte planteriket. I vår tid har særlig jakten på legemidler mot kreft fått oppmerksomhet i offentligheten, og i denne legemiddelgruppen er hele 60 % enten rene naturprodukter, videreutviklet fra slike ved hjelp av kjemiske endringer (semisyntese), eller de er syntetisert med naturprodukter som modell.
NMBU Veterinærhøgskolen,
Seksjon for farmakologi og toksikologi
Forfatter har fylt ut ICMJE-skjemaet og oppgir ingen interessekonflikter.
kristian.ingebrigtsen@nmbu.no
Førsteamanuensis
NMBU Veterinærhøgskolen, Seksjon for farmakologi og toksikologi
Forfatter har fylt ut ICMJE-skjemaet og oppgir ingen interessekonflikter.
Innledning
En spennende og lærerik suksesshistorie fra utviklingen av legemidler mot kreft er historien om taxol med opphav i barlindslekten (Taxus). Taxol regnes for å være tidenes «best-selgende» anticancer legemiddel. Den bakenforliggende forskningen var særdeles tid- og ressurskrevende. Fra man fikk indikasjoner på at det fantes en lovende kandidat i barken til Taxus brevifolia til taxol ble godkjent som legemiddel, lå det tretti års arbeid (1-2).
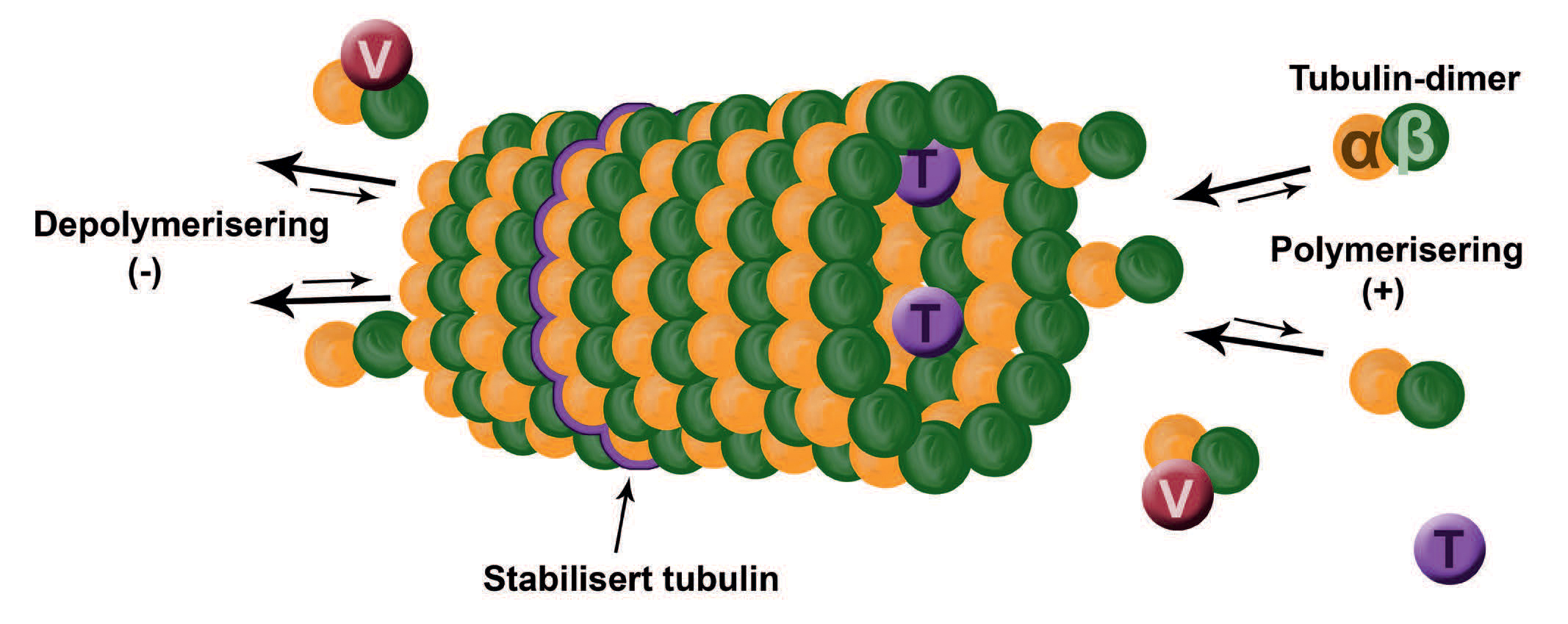
Figur 1: Mikrotubuli er hule proteinsylindere som polymeriserer ved at tubulin-dimerer med to subenheter (α og β) hekter seg på hverandre. Tilsvarende depolymeriserer mikrotubuli ved at dimerene frigjøres. Polymerisering og depolymerisering skjer i hovedsak på hver sin ende av mikrotubuli, slik at det blir en drift av dimerer fra den enden til den andre. Taxol (T) binder seg til og stabiliserer polymerisert tubulin fra innsiden av sylinderen, og forhindrer depolymerisering. Vinkristin (V) binder seg til depolymeriserte og frie tubulin-dimerer, og forhindrer videre polymerisering. Begge substansene påvirker cellevekst negativt ved å ødelegge/forstyrre den normale funksjonen til mikrotubuli under mitosen. Illustrasjon: Marit J. Bakke
Nomenklatur
Alkaloidet ble døpt taxol allerede før det var strukturbestemt, og navnet ble satt sammen av Tax(us) og -ol, første stavelse fra Taxus som er barlindslekten, og siste stavelse fordi man visste at den komponenten man jaktet på, inneholdt flere hydroksylgrupper. Substansen ble senere gitt det generiske navnet paclitaxel (paklitaksel no.) etter pacific yew, det engelske navnet for Taxus brevifolia (Stillehavsbarlind), den Taxus-arten som substansen først ble isolert fra. I litteraturen brukes taxol og paclitaxel om hverandre. Vi har valgt å benytte den kjemiske betegnelsen taxol.
Utviklingen av taxol
I 1955 etablerte National Cancer Institute (NCI) i USA et senter for å identifisere kjemiske substanser med virkning mot kreft, og det ble iverksatt en omfattende screening hovedsakelig av syntetiske substanser. I 1960 ble det imidlertid opprettet et delprosjekt med formål å innsamle prøvemateriale fra 1000 plantearter per år, og undersøke ekstrakter fra disse for cytotoksisk/antiproliferativ og antitumor effekt (Ramme 1). I 1962 ble det innsamlet og ekstrahert bark fra Taxus brevifolia som er en nær slektning av «vår egen» barlind (T. baccata), og i 1964 ble det observert at en av fraksjonene fra dette ekstraktet hadde cytotoksisk effekt i en kreftcellelinje. Etter omfattende og tidkrevende videre undersøkelser ble den aktive ingrediensen isolert, strukturbestemt og gitt navnet taxol. Etter at taxol på midten av 1970-tallet ble vist å ha cytotoksisk effekt også mot en annen kreftcellelinje, startet man in vivo forsøk, og i 1978 ble det rapportert at taxol hadde antitumor effekt mot leukemi i en musemodell. I denne rapporten fremkom det også at taxol øyensynlig virket som en mitoseinhibitor, noe som allerede året etter ble bekreftet ved molekylærfarmakologiske undersøkelser. Disse oppdagelsene førte til at det ble igangsatt dyretoksikologiske studier, og i 1983 kunne man starte klinisk utprøving for å avgjøre om taxol hadde anticancer effekt. Det viste seg å være tilfellet, og i 1993 ble taxol godkjent til bruk mot eggstokkreft. Indikasjonsområdet har siden stadig blitt utvidet, og omfatter i dag en lang rekke kreftformer. I 2015 ble taxol innlemmet i WHOs liste over essensielle medikamenter, som omfatter de mest effektive og sikre medikamenter (Tabell 1) (1-2).
NCI etablerer senter for å identifisere kjemiske substanser med anticancer effekt |
1955 |
Delprosjekt for identifikasjon av plantebaserte substanser med anticancer effekt |
1960 |
Prøvemateriale fra Taxus brevifolia innsamles |
1962 |
En ekstrakt-fraksjon fra T. brevifolia viser cytotoksisk effekt i en kreftcelle-linje |
1964 |
Virksom komponent isoleres, strukturbestemmes og gis navnet taxol |
1971 |
Taxol viser antitumor effekt mot leukemi i en muse-modell |
1978 |
Taxols virkningsmekanisme klarlegges: Stabilisering av microtubuli |
1979 |
Dyretoksikologiske studier |
1982-84 |
Kliniske utprøvinger |
1983-86 |
Klinisk utprøving viser at taxol har anticancer effekt |
1988 |
Taxol godkjennes til medisinsk bruk ved eggstokk-kreft |
1993 |
Taxol innlemmes i WHOs liste over essensielle medikamenter |
2015 |
Isolasjon og strukturbestemmelse
Hele tretti år skulle det altså gå fra oppdagelsen av at én fraksjon av et ekstrakt fra T. brevifolia hadde cytotoksisk effekt, til taxol ble godkjent som legemiddel mot kreft. Denne tiden kan synes urimelig lang, men her må man huske på at både isolasjon og strukturbestemmelse av den aktive komponenten bød på svært store utfordringer. Ekstraktet fra T. brevifolia ble separert i et stort antall fraksjoner, basert på blant annet polaritet. Hver enkelt fraksjon ble så undersøkt for cytotoksisk aktivitet i et batteri av cellelinjer, og utvalgte fraksjoner ble testet for antitumor effekt i dyremodeller. Flere av dyremodellene hadde livsforlengelse som endepunkt og var derfor av flere måneders varighet. Når man endelig hadde isolert den virksomme komponenten, var strukturbestemmelsen ekstremt vanskelig med det begrensede utvalget av metoder man rådde over på den tiden. Taxol er et diterpen med svært kompleks struktur, og før utviklingen av avanserte metoder basert på nukleær magnetisk resonans (NMR), var strukturbestemmelse av slike substanser ansett som en nærmest uovervinnelig oppgave. Oppklaringen av taxols kjemiske struktur har da også i ettertid blitt karakterisert som et mesterstykke, og taxol brukes gjerne som et skoleeksempel på utvikling av legemidler fra planteriket (1-2).
Råstofftilgang
Foruten utfordringene knyttet til kjemisk isolering og strukturbestemmelse hadde også tilgangen på råstoff avgjørende betydning for fremdriften i forskningen. Naturlig nok løp flere prosesser parallelt i tid, men det er mulig å peke ut visse sentrale hendelser under arbeidets gang (1-7).
Lavt utbytte av taxol legger en demper på forskningen
På begynnelsen av 1970-tallet ble deler av forskningen nedprioritert fordi innholdet av taxol i råmaterialet ble vurdert til å være for lavt og ekstraksjon og isolering for ressurskrevende til at en eventuell fremtidig produksjon skulle kunne bli regningssvarende. Det lave utbyttet utløste også bekymring for skjebnen til den begrensede bestanden av T. brevifolia.
Oppdagelsen av taxols antitumoreffekt stimulerer fremdriften
Mot slutten av 1970-tallet oppsto det imidlertid fornyet interesse og entusiasme. Dette skyldtes først og fremst at taxol viste antitumoreffekt mot leukemi i en musemodell. Den samme studien avslørte også at taxol øyensynlig utøvet sin effekt ved å stabilisere mikrotubuli. Umiddelbart antok man at virkningsmekanismen var lik den til andre såkalte «mitose-gifter», som for eksempel vinkristin. Det skulle imidlertid vise seg at taxol inhiberte mitosen ved å binde seg til polymerisert tubulin, mens de tidligere «mitose-giftene» bandt seg til depolymerisert tubulin (frie tubulin-dimerer). Dermed hadde man tilgjengelig en ny antitumor substans med et nytt angrepsmål, og et mulig behandlingsalternativ ved resistens mot de klassiske «mitose-giftene» (Figur 1).
Lovende kliniske resultater gir økt miljøbekymring
T. brevifolia er en langsomt voksende art med begrenset utbredelse, og det tar cirka 100 år før et tre har vokst seg stort nok til at barken kan høstes for utvinning av taxol. Dessuten er utbyttet av taxol lavt, og barkingen tar livet av trærne. Det hadde tidligere blitt uttrykt bekymring for bestanden av T. brevifolia, og denne ble vesentlig forsterket etter at den første rapporten fra klinisk utprøving ble publisert på slutten av 1980-tallet. Den viste at taxol hadde anticancer effekt på pasienter med melanom og eggstokk-kreft, og man så for seg at dette var en behandling som kunne bli førstevalget ved disse to kreftformene. Kalkyler tilsa at om alle pasientene med melanom og eggstokk-kreft i USA ble tilbudt behandling med taxol, ville det medføre destruksjon av 360 000 trær årlig - en katastrofal overbeskatning av bestanden. Det ble derfor påtrengende klart at forsyningen av taxol måtte komme fra alternative og mer bærekraftige kilder.
Barnåler viser seg å være en bærekraftig taxolkilde
En omfattende søking etter fornybare kilder ledet til funn av taxol i nåler fra T. brevifolia og beslektede Taxus-arter. Til tross for et lavt og svært variabelt innhold, lyktes man etter hvert å fremskaffe et meningsfullt bidrag av taxol fra barnåler, som i motsetning til barken kunne høstes uten at treet døde. Selv om utbyttet var relativt magert, var i det minste råstoffkilden bærekraftig.
Barlind (T. baccata) blir hovedkilde for råstoff til semisyntese av taxol
Det lave innholdet av taxol i barnåler ansporet interessen for å kartlegge synteseveier og utrede hvilke faktorer som påvirket produksjonen av taxol i ulike arter innen barlindslekten. Det viste seg at flere Taxus-arter produserer et stort antall diterpener som er beslektet med taxol, og man tenkte seg at ett eller flere av disse kanskje kunne omdannes til taxol ved hjelp av enkle kjemiske reaksjoner. I 1988 ble det publisert en semisyntetisk produksjonsmetode for taxol som tok utgangspunkt i 10-deacetylbaccatin (10-DAB), et diterpen som finnes i relativt store mengder i nålene til barlind (T. baccata), et tre vi best kjenner for dets giftighet. Endelig var det funnet en råstoffkilde som både var fornybar og rikholdig. Forskerne følte at de hadde utvidet erkjennelsens porter, medisinere og pasienter fattet nytt håp, miljøvernere jublet og legemiddelinvestorer gned seg forventningsfullt i hendene. Produksjonsmetoden ble patentert i 1992, og etter få år kom nåler fra barlind til å representere hovedkilden for råstoff, en posisjon treet beholdt helt frem til 2013 (Figur 2).
Det skal også nevnes at det i lang tid ble arbeidet iherdig med å utvikle en syntese av taxol på grunnlag av enkle, naturlig forekommende kjemiske substanser, en såkalt total syntese. En slik synteseprosess ble publisert i 1993, men umiddelbart vurdert til å være langt fra kommersielt regningsvarende.
Plantecellekulturer overtar som hovedkilde til taxol
Det varte ikke lenge før også semisyntesen fra 10-DAB ble regnet for å være lite kostnadseffektiv. Man vendte seg da mot bioteknologiske prinsipper for storstilt celledyrking, slik vi kjenner blant annet fra produksjonen av penicillin, og etter mye prøving og feiling ble det omsider etablert plantecelledyrking på industrielt nivå. Produksjonen startet i 1995, og etter en stadig utvidelse av volumet kom dette til å bli hovedkilden for taxol fra 2013. Taxus-celler dyrkes i store kar, såkalte bioreaktorer, og taxol ekstraheres fra det vandige medium, renses ved kromatografi og isoleres ved krystallisasjon.
Stammer taxol fra planteceller eller intracellulære mikrosopper?
I 1993 ble taxol isolert fra en mikrosopp, en såkalt endofytt, som vokser intracellulært i Taxus-trær. Denne banebrytende oppdagelsen åpnet et nytt forskningsfelt, og senere års resultater indikerer at en rekke medisinsk viktige substanser som tidligere ble ansett for å være produsert av planteceller, i realiteten helt eller delvis syntetiseres av intracellulære mikroorganismer, som oftest mikrosopper.
Hvorvidt Taxus-cellenes endofytter er i stand til å syntetisere taxol om de dyrkes alene, vet man ennå ikke. Biosyntese av Taxus-alkaloider er også gjort mulig ved at man har lyktes med å inkorporere det genetiske grunnlaget for syntesen av terpenoider i genomet til E. coli og gjærsopp. Hvilken betydning dette vil kunne ha for fremtidig taxolproduksjon vet man heller ikke. Man øyner imidlertid muligheter for et fremtidig bidrag fra mikroorganismer til det stadig voksende behovet for anticancer medikamenter.
Offentlig finansiert kunnskapsutvikling: Statlig eller privat eiendom?
Investorenes forventninger ble langt på vei innfridd da legemiddelfirmaet Bristol-Myers Squibb i 1991 ble tildelt eksklusive rettigheter til all kunnskap om taxol, inkludert klinisk utprøving, samt rett til å utvikle taxol for det kommersielle markedet. Ettersom kunnskapen om taxol var generert med offentlige midler, fant mange det uhyrlig at den ble overdratt vederlagsfritt til privat sektor. Det ble satt et kritisk søkelys på overdragelsen som to ganger var gjenstand for behandling i kongressen. Denne prosessen som var en vekker både for politikere, akademikere og lekmenn, har formodentlig hatt en viss effekt på offentlig regulering av legemiddelsektoren.
Ramme 1. Terminologi (1)
Uheldigvis er det en tendens til å benytte upresis terminologi når det rapporteres om effekt av kjemiske substanser innen kreftforskning. Følgende adjektiver bør benyttes om biologisk effekt på ulike organisasjonsnivåer:
Cytotoksisk/antiproliferativ effekt: In vitro effekt, for eksempel i dyrkede leukemicellelinjer.
Antitumor effekt: In vivo effekt i dyremodeller, for eksempel i en musemodell med leukemi.
Anticancer effekt:In vivo effekt i mennesket, for eksempel i klinisk utprøving mot leukemi.
Formulering
Biotilgjengelighet
Medikamenter administrert per os møter i fordøyelseskanalen enzymer fra en rekke mikroorganismer og kan bli omdannet til mindre aktive eller helt inaktive metabolitter. I tillegg kan CYP (cytochrome P-450) -enzymer og ABC (ATP-binding casette)-transportører i tarmmucosa begrense medikamenters absorbsjon. Disse to systemene samarbeider gjerne ved at CYP-enzymene omdanner et substrat til en metabolitt som så tas hånd om av en ABC-transportør som i sin tur besørger retur-transport fra tarmmucosa til tarmlumen. Dette samarbeidet resulterer i en dramatisk reduksjon av biotilgjengeligheten av taxol. Taxol ble derfor opprinnelig formulert i et syntetisk ikke-ionisk løsemiddel (Cremophor® EL) for intravenøs administrering (8-10).
Bivirkninger fremtvinger ny formulering
Denne formuleringen var imidlertid beheftet med til dels alvorlige bivirkninger som hovedsakelig var knyttet til vehikkel (Cremophor® EL). En ny formulering, Abraxane®, som ble godkjent av FDA (Food and Drug Administration, USA) i 2005 og EMA (European Medicines Agency) i 2008, har langt færre bivirkninger enn den opprinnelige, og kan derfor administreres i en signifikant høyere maksimal dose. Abraxane®, som er en såkalt nano-formulering av taxol (Ramme 2), overtok markedsledelsen i 2016 (11-13).

Figur 2: Barlind (T. baccata) har vært, og er, høyt skattet som emne til henholdsvis våpen- og konkurranse-buer, ettertraktet som prydbusk/-tre og viden kjent for sin giftighet. I vår tid har barlind i tillegg tjent menneskeheten som kilde for råstoff til semisyntese av taxol. Foto: Marit J. Bakke
Abraxane® – en nano-formulering av taxol
Plasmaproteinet albumin har generelt en viktig funksjon som transportmolekyl både for endogene forbindelser og for en rekke legemidler. Ett albuminmolekyl kan binde flere taxolmolekyler reversibelt, og Abraxane® består av albumin-taxolpartikler på cirka 130 nm i diameter. Abraxane® øker antitumor aktiviteten sammenliknet med den opprinnelige taxolformuleringen grunnet en høyere akkumulering av legemiddelet i tumorvevet. Samtidig er toksisiteten vesentlig redusert ettersom det syntetiske løsemiddelet Cremophor® EL er fraværende. For tiden er det høy aktivitet når det gjelder utvikling av nanoformuleringer av taxol basert på ulike transport- eller bæresubstanser, og i nær fremtid vil sannsynligvis flere slike bli tilgjengelig (11-13).
Albuminet som benyttes som bæresubstans i Abraxane® er humant og formuleringen er derfor lite egnet til andre dyrearter. Taxol representerer imidlertid kun ett av virkestoffene som inngår i utviklingsarbeidet med nano-formuleringer til veterinærmedisinsk cancerterapi (14, 15).
Historien fortsetter
Historien om utviklingen av taxol startet for om lag 60 år siden og pågår stadig. Prosessen har vært uforutsigbar, kostbar og tidkrevende, med mange blindveier og uforutsette utfordringer. I tillegg til et effektivt legemiddel, har arbeidet bidratt med verdifull kunnskap om plantekjemi og til metodeutvikling. Med dagens avanserte metoder basert på NMR er strukturoppklaring av komplekse molekyler en svært mye enklere oppgave, og det forventes at blant annet flere diterpener vil bli kandidater for legemiddelutvikling i fremtiden. Planter inneholder et rikt utvalg av kjemiske substanser, såkalte sekundære metabolitter, som tjener spesifikke beskyttelsesfunksjoner og som med høy presisjon evner å gjenkjenne sårbare målmolekyler i deres fiender eller konkurrenter. Ettersom kun en liten prosentdel av de om lag 350 000 høyere planteartene er undersøkt systematisk for bioaktive molekyler, er forventningene til planteriket som kilde til nye legemidler store og forskningsfeltet er i rask og hektisk vekst (1, 16).
Sammendrag
Forventningene til planteriket som kilde til nye legemidler er store og forskningen i rask vekst. En suksesshistorie fra dette feltet er utviklingen av taxol som har sitt opphav i barlindslekten (Taxus), og som regnes for å være tidenes «best-selgende» legemiddel mot kreft. Hele tretti år tok det fra oppdagelsen av at én fraksjon av et ekstrakt fra T. brevifolia hadde cytotoksisk effekt, til taxol ble godkjent som legemiddel. Utfordringene var især knyttet til isolasjon og strukturbestemmelse av den virksomme komponenten samt råstofftilgang. Foruten et effektivt legemiddel, resulterte den enorme satsingen i verdifull kunnskap blant annet om plantekjemi og -fysiologi, kunnskap som helt åpenbart vil være av stor betydning for fremtidig utvikling av plantebaserte legemidler. Vi forteller her historien om utviklingen av taxol og beretter videre om arbeidet med å bedre legemiddelets kinetikk og terapeutiske potensial. Vår tids utviklingsarbeid har resultert i at taxol har tatt skrittet over i nano-farmakologien, noe som gir muligheter for målstyring av cancerlegemidler til tumorvevet, og som kan revolusjonere behandlingen av kreft.
Summary
The plant kingdom is a rich source of new therapeutic agents. Taxol, originating from the Taxus-family, is an example of a plant-derived compound that is currently one of the best-selling anticancer drugs. It took thirty years from the discovery that an extract-fraction from Taxus brevifolia showed cytotoxic effect, until taxol was approved for medical use. Great challenges were related to isolation and structural determination as well as to a scarcity of raw materials. Apart from an efficient drug, the enormous input of resources generated new knowledge in the field of plant-chemistry and -physiology, knowledge that will obviously be supportive to the future search for plant-based drug candidates. Here we summarize the history of taxol and give a brief account of the efforts undertaken to improve its pharmacokinetics and therapeutic potential. The developmental efforts of our time have resulted in nano-formulations, enabling the specific targeting of tumor tissues.
Ramme 2. Nano-formuleringer (11-15)
Nano-formuleringer består av partikler av en egnet substans hvortil er knyttet legemiddelmolekyler. Partiklene har en størrelse og overflate som gjør dem løselige i blodet, og de holder legemiddelet adskilt fra øvrige vev under transport til målvevet. For visse legemidler byr nano-formuleringer på store fordeler. Dette gjelder særlig anticancer legemidler hvis terapeutiske potensiale ikke kan utnyttes til fulle på grunn av toksisitet, tungløselighet eller høy molekylvekt. Prinsippet er å redusere bivirkninger og målstyre legemidlene til tumorvevet. Det skilles gjerne mellom aktiv og passiv målstyring. Ved aktiv målstyring er nano-partikkelen utstyrt med en ligand på overflaten som interagerer med spesifikke molekyler på målcellenes membran. Ved passiv målstyring forstås at nano-partikler «lekker» inn i tumorvevet via delvis defekte nydannede kapillærer.
Referanser
Heinrich M, Barnes J, Prieto Garcia JM, Gibbons S, Williamson EM. Fundamentals of pharmacognosy and phytotherapy. 3rd ed. New York: Elsevier, 2018.
Wall ME, Wani MC. Camptothecin and taxol: discovery to clinic. Thirteenth Bruce F. Chain Memorial Award Lecture. Cancer Res 1995;55:753-60.
Ingebrigtsen K. Barlindforgiftning – kan utviklingen av legemidler mot kreft gi svar på århundregamle spørsmål om dyrs følsomhet? Nor Vet Tidsskr 2018;130:430-7.
Cusido RM, Onrubia M, Sabater-Jara AB, Moyano E, Bonfill M, Goossens A et al. A rational approach to improving the biotechnological production of taxanes in plant cell cultures of Taxus spp. Biotechnol Adv 2014;32:1157-67.
Stierle A, Strobel G, Stierle D. Taxol and taxane production by Taxomyces andreanae, an endophytic fungus of Pacific yew. Science 1993;260:214-6.
Newman DJ, Cragg GM. Plant endophytes and epiphytes: burgeoning sources of known and “unknown” cytotoxic and antibiotic agents? Planta Med 2020;86:891-905.
Walsh V, Goodman J. Cancer chemotherapy, biodiversity, public and private property: the case of the anti-cancer drug Taxol. Soc Sci Med 1999;49:1215-25.
Schellens JH, Malingré MM, Kruijtzer CM, Bardelmeijer HA, van Tellingen O, Schinkel AH et al. Modulation of oral bioavailability of anticancer drugs: from mouse to man. Eur J Pharm Sci 2000;12:103-10.
Barbuti AM, Chen Z-S. Paclitaxel through the ages of anticancer therapy: exploring its role in chemoresistance and radiation therapy. Cancers 2015;7:2360-71.
Hendrikx JJ, Lagas JS, Rosing H, Schellens JH, Beijnen JH, Schinkel AH. P-glycoprotein and cytochrome P450 3A act together in restricting the oral bioavailability of paclitaxel. Int J Cancer 2013;132:2439-47.
Miele E, Spinelli GP, Miele E, Tomao F, Tomao S. Albumin-bound formulation of paclitaxel (Abraxane® ABI-007) in the treatment of breast cancer. Int J Nanomed 2009;4:99-105.
Löhr M, van der Wijngaart W, Fagerberg B. Nanotekniken kan revolutionera behandlingen av cancer. Ger nya möjligheter att målstyra läkemedel, men flera stora utmaningar återstår att tackla. Läkartidningen 2017;114:EIAC
Sofias AM, Dunne M, Storm G, Allen C. The battle of “nano” paclitaxel. Adv Drug Deliv Rev 2017;22:20-30.
Khanna C, Rosenberg M, Vail DM. A review of paclitaxel and novel formulations including those suitable for use in dogs. J Vet Intern Med 2015;29:1006-12.
Zabielska-Koczywas K, Lechowski R. The use of liposomes and nanoparticles as drug delivery systems to improve cancer treatment in dogs and cats. Molecules 2017; 22:2167.
Ritter JM, Flower RJ, Henderson G, Loke YK, MacEwan D, Rang HP. Rang & Dale´s pharmacology. 9th ed. Edinburgh: Elsevier, 2020.