De tre vanligste hudsvulstene hos hest
Hudsvulster utgjør over halvparten av alle neoplasier hos hest og kan gi store utfordringer både for eier og for behandlende veterinær. Dessuten kan hudsvulster forårsake åpenbar dyrevelferdsmessig lidelse. Slik som for mange andre sykdommer ligger nøkkelen til god respons på behandling og liten risiko for residiv i tidlig diagnostikk og behandling med evidensbaserte metoder. I denne artikkelserien gis en oversikt over etiologi og patogenese, diagnostikk og behandling av de tre vanligste hudsvulstene hos hest: melanom, ekvint sarkoid og plateepitelkarsinom. Denne artikkelen tar for seg ekvint sarkoid.
Professor i hestekirurgi, DECVS, DECVSMR, Dyresykehuset - Hest
NMBU Veterinærhøgskolen
Innledning
Mens neoplasier generelt er forholdsvis uvanlig hos hest, er hudsvulster derimot relativt vanlig forekommende og utgjør langt over halvparten av alle neoplasier hos denne arten. De tre vanligste svulsttypene; melanomer, ekvint sarkoid og plateepitelkarsinomer har vært kjent i århundrer, men det er først i de senere år at årsakssammenhenger har blitt kartlagt mer i detalj. Tilsvarende er det opp gjennom tiden forsøkt ulike former for behandling, men ofte med dårlig resultater grunnet høye residivrater. I denne artikkelserien presenteres etiologi og patogenese, diagnostikk og evidensbasert behandling etter dagens kunnskapsnivå. Den første delen omhandlet melanom (‘the Good’). Denne delen, Del 2, tar for seg ekvint sarkoid (‘the Bad’); mens Del 3 beskriver plateepitelkarsinomer (‘the Ugly’).
Del 2: Ekvint sarkoid – ‘The Bad’
Etiologi og patogenese

A. Fibroblastisk ekvint sarkoid, oppstått i granulasjonsvevet fra en opprinnelig sårskade hos en varmblods ridehest vallak, 6 år, oppstallet på en gård med storfe. Histologi er nødvendig for å skille neoplastisk transformasjon fra et sår med overvekst av granulasjonsvev, og neoplastisk transformasjon bør mistenkes ved unormal sårheling. Kirurgisk eksisjon eller biopsi vil imidlertid trigge en mer aggressiv svulstvekst, slik at en god behandlingsstrategi må være klar straks biopsisvaret foreligger. Denne pasienten ble behandlet med gjentatte intralesjonale cellegiftinjeksjoner.
Foto: Cathrine Fjordbakk
B. Samme pasient som i A. Bildet er tatt 9 måneder senere etter fullstendig remisjon og avheling av lesjonen. På dette bildet sees unormal hornkvalitet i hovveggen som antas å være en konsekvens av kjemoterapien. Dette har senere normalisert seg og hesten er 3 år seinere i full bruk som ridehest og uten tegn til residiv av tumoren.
Foto: Eier (brukt med eiers tillatelse)
Ekvint sarkoid er den desidert hyppigst forekommende hudsvulsten hos hest. Dette er lokalt invasive fibroblastsvulster som til tross for sin lokale aggressivitet (‘the Bad’) ikke metastaserer. Slik som for livmorhalskreft hos menneske er ekvint sarkoid en virusbasert kreftform, der bovint papillomavirus (BPV) 1 og 2 er kausale agens (1). BPV 1/2 følger således ikke de strenge artsbarrierene som er vanlig for papillomavirus siden disse virusene angriper både klauvdyr og hovdyr. Hovdyr klarer imidlertid ikke å initiere en effektiv immunrespons og kvitte seg med virusinfeksjonen, slik storfe gjør.
BPV er et lite virus med kun 8 gener og tre av disse; E5, E6 og E7, transformerer normale fibroblaster og keratinocytter til sarkoidceller (1). E5 sørger også for å hemme antigengjenkjenning via MHC klasse I systemet, slik at viruset unnslipper vertens immunforsvar. Virusprotein E1 og E2 sørger for viral oppformering synkront med vertscellenes celledeling. Siden økt celledeling er en normal, fysiologisk reparasjonsrespons etter et traume, ses dermed ofte sarkoider i kjølvannet av iatrogene traumer som kirurgi, eller traumatiske hendelser som sår eller kontusjoner (1). Intradermal inokulasjon av BPV-1 hos friske hester forårsaker imidlertid ikke ekvint sarkoid, men snarere sarkoidlignende lesjoner som tilbakedannes spontant, trolig på grunn av cellemediert immunitet (2). Dette betyr med andre ord at virusinfeksjonen alene ikke er tilstrekkelig for tumorutvikling. I kombinasjon med andre faktorer, slik som genetisk disposisjon eller et hudtraume, vil imidlertid sarkoid transformasjon kunne oppstå. På den andre siden kan spontan regresjon av oppståtte lesjoner også forekomme (3,4), og skyldes trolig at enkelte hester klarer å opparbeide en adekvat immunrespons mot viruset over tid.
Genetisk disposisjon for sarkoider er polygenisk, knyttet til gener som regulerer virusreplikasjon og immunrespons (5). For eksempel er enkelte haplotyper av Equine Leukocyte Antigen (ELA) assosiert med risiko for å utvikle sarkoider, trolig på grunn av redusert evne til å eliminere virusinduserte tumorceller, samt redusert cellemediert immunitet med hensyn til virus gjenkjenning (6). Parallelt settes også risiko for livmorhalskreft i sammenheng med variasjoner i det tilsvarende genet hos menneske, der forskjellige Human Leukocyte Antigen (HLA) haplotyper trolig ligger til grunn for ulik kapasitet til å eliminere HPV-infeksjon (7).
Som nevnt vil også traumer og sår disponere for sarkoid transformasjon (Figur 1). En stor andel hester er friske smittebærere med en latent BPV-1/2-infeksjon (8), og hos disse vil et hudtraume kunne trigge sarkoid transformasjon ved økt viral oppformering i takt med reparasjonsprosessen etter traumet. Åpne sår disponerer også for smitte med BPV-1/2 via fluer og andre vektorer. Betydningen av insektsvektorer har blitt undersøkt i flere studier, og BPV-1/2 DNA er funnet blant annet hos både vanlig husflue (Musca domestica) og stikkflue (Stomoxys calcitrans) (9,10). Smitteforsøk av stikkflue viste at selv om fluene plukket opp BPV-1/2 både fra ekvint sarkoid og fra bovint papillom, hadde fluene 10 ganger større virusmengde og ble bærere over lengre tid fra sistnevnte (10). Det er med andre ord større risiko for smitte med BPV-1/2 fra fluer eksponert for storfe med papillomer enn fra fluer eksponert for hester med sarkoider (10). Virusmengden avtok imidlertid etter tre dager, slik at en ikke skal være redd for å bruke beiter eller husdyrrom som tidligere har vært brukt av storfe til hest. Nærkontakt i samtid med storfe kan imidlertid representere en reell smitterisiko.
Kliniske funn og diagnostikk

Figur 2. Bildet viser multiple sarkoider av forskjellige typer i inguinalregionen hos en sportsponni, hoppe, 10 år. Hesten har en stor, stilket fibroblastisk lesjon; en mindre verrukøs lesjon; samt et stort felt med malignt sarkoid, utlinjert i hvitt. Lesjonene hadde vokst hurtig den siste tiden og det maligne sarkoidet fulgte blod- og lymfekar i området. Den fibroblastiske og den verrukøse lesjonen ble fjernet med elektrokirurgi og reseksjonsmarginene samt hele den maligne lesjonen ble behandlet med intralesjonal kjemoterapi. Denne behandlingen ble imidlertid ikke fulgt opp og sportsponnien ble avlivet 6 år seinere på grunn av residiv av svulstene.
Foto: Cathrine Fjordbakk
Sarkoider deles inn i 6 ulike former basert på kliniske karakteristika (Tabell 1), og multiple lesjoner hos samme hest er ofte av ulike typer (Figur 2). Selv om sarkoider kan oppstå hvor som helst, er de vanligst å se på tynnhudede steder som langs ventrale deler av kroppen inkludert aksille, lyske og innsiden av lårene; rundt øyne og ører; på bena og på halsen (11). Tilsynelatende stabile lesjoner kan plutselig bli aggressive om de utsettes for traumer slik som sårskader, biopsier, eller utilstrekkelig behandling. På den andre siden kan som nevnt spontan regresjon forekomme, spesielt hos yngre hester (3,4).
Kliniske tegn er relatert til svulstens størrelse, type og lokalisasjon, og globalt sett forårsaker ekvint sarkoid betydelig morbiditet og mortalitet (11). Svulster på steder som interfererer med sal, hodelag eller seletøy vil skape lokalt ubehag og etter hvert forhindre aktivitet som fordrer bruk av utstyr. Ulcererte lesjoner kan bli sekundært infiserte og halthet kan forekomme dersom lesjonen(e) sitter slik til at de hindrer bevegelse.
En tentativ diagnose av ekvint sarkoid baserer seg på kliniske funn. Funn av multiple mistenkelige lesjoner hos én hest styrker den kliniske mistanken. Differensialdiagnoser er granulasjonsvev, granulom, andre neoplasier som plateepitelkarsinomer og mastceller, eller hudinfeksjoner som for eksempel follikulitt forårsaket av Staphylococcus spp. Endelig diagnose stilles ved hjelp av histologi. Siden traumet fra en biopsi vil kunne trigge svulstens lokale invasivitet og proliferasjon er imidlertid dette en prosedyre som kun gjøres dersom klinisk presentasjon avviker fra det typiske og en må da ha en behandlingsstrategi klar så snart biopsisvaret foreligger. Histologisk sees epidermal akantose, hyperkeratose og hyperplasi med lange epidermale utstikkere som invaderer dermis, bestående av umodne fibroblaster med mitosefigurer og karakteristiske hvirvler (12,13). Det kan være vanskelig å skille ekvint sarkoid fra fibrom og fibrosarkom histologisk.
Sarkoid type |
Karakteristikk |
|---|---|
Okkult |
Flat, som regel ubehåret. Mild skorpedannelse |
Verrukøs |
Vortelignende, fortykket epidermis. Læraktig hud |
Nodulær |
Fast, velavgrenset, subkutan lesjon |
Fibroblastisk |
Ulcerert, granulasjonsvevslignende utseende |
Blandet |
Består av to eller flere av de overnevnte typene |
Malign |
Svært aggressiv og invasiv lesjon med hurtig vekst som kan spres langs fascieplan og blod – og/eller lymfekar |
Behandlinger og prognoser
I to nylig publiserte litteraturgjennomganger om behandling av ekvint sarkoid konkluderes det med at det er for få studier av god kvalitet (nivå 4 eller høyere) til sikkert å kunne angi beste behandling (14,15), samt at ulike typer av sarkoider fordrer ulike behandlingsstrategier. Sammenligning av behandlingsmetoder vanskeliggjøres også av at enkelte studier kun inkluderer én type sarkoid eller sarkoider kun på én lokalisasjon, mens detaljer rundt hvilke typer sarkoider som er behandlet mangler fra andre studier. Flere behandlingsmetoder brukt i klinisk praksis bygger på et svært tynt evidensgrunnlag med rapporterte responsrater angitt kun for et fåtall individer eller med for kort oppfølgingstid til å kunne vurdere risiko for residiv. Litteraturgjennomgangene identifiserte imidlertid stråleterapi, kjemoterapi eller elektrokjemoterapi, laserkirurgi og kryoterapi brukt i kombinasjon med kirurgi som de mest effektive behandlingsformene (14,15).
Foruten stråleterapi som regnes som ‘gullstandard’, finnes altså ingen universell behandling av sarkoider og alle behandlingsformer gir større eller mindre risiko for residiv. Sjansen for å lykkes med behandling er imidlertid bedre jo tidligere i sykdomsforløpet en kommer til – små svulster responderer bedre uavhengig av behandlingsmetode enn større lesjoner og risikoen for residiv reduseres (3). Viktigheten av tidlig behandling illustreres av en kasusserie med 42 periokulære sarkoider som ikke ble behandlet på diagnosetidspunktet, men som alle trengte behandling på et senere tidspunkt på grunn av lokal ekspansjon. Denne avventende strategien resulterte i at 27 av hestene (64 %) ble avlivet på grunn av alvorlighetsgraden av lesjonene (16).
Ved residiv reduseres responsen på all påfølgende behandling siden mislykket behandling medfører økt aggressivitet av tumoren (3,17). Dette betyr at en kun får én sjanse til effektiv behandling, og en multimodal behandlingsstrategi, for eksempel en kombinasjon av kirurgisk fjerning og intralesjonal kjemoterapi eller elektrokjemoterapi anbefales (15). Stråleterapi omtales ikke i denne artikkelen, da denne type behandling kun tilbys ved et fåtall steder i verden og per i dag ikke er tilgjengelig i Norge. Leseren henvises til Henson et al (2004) (18) og Hollis (2023) (14).
Kirurgi
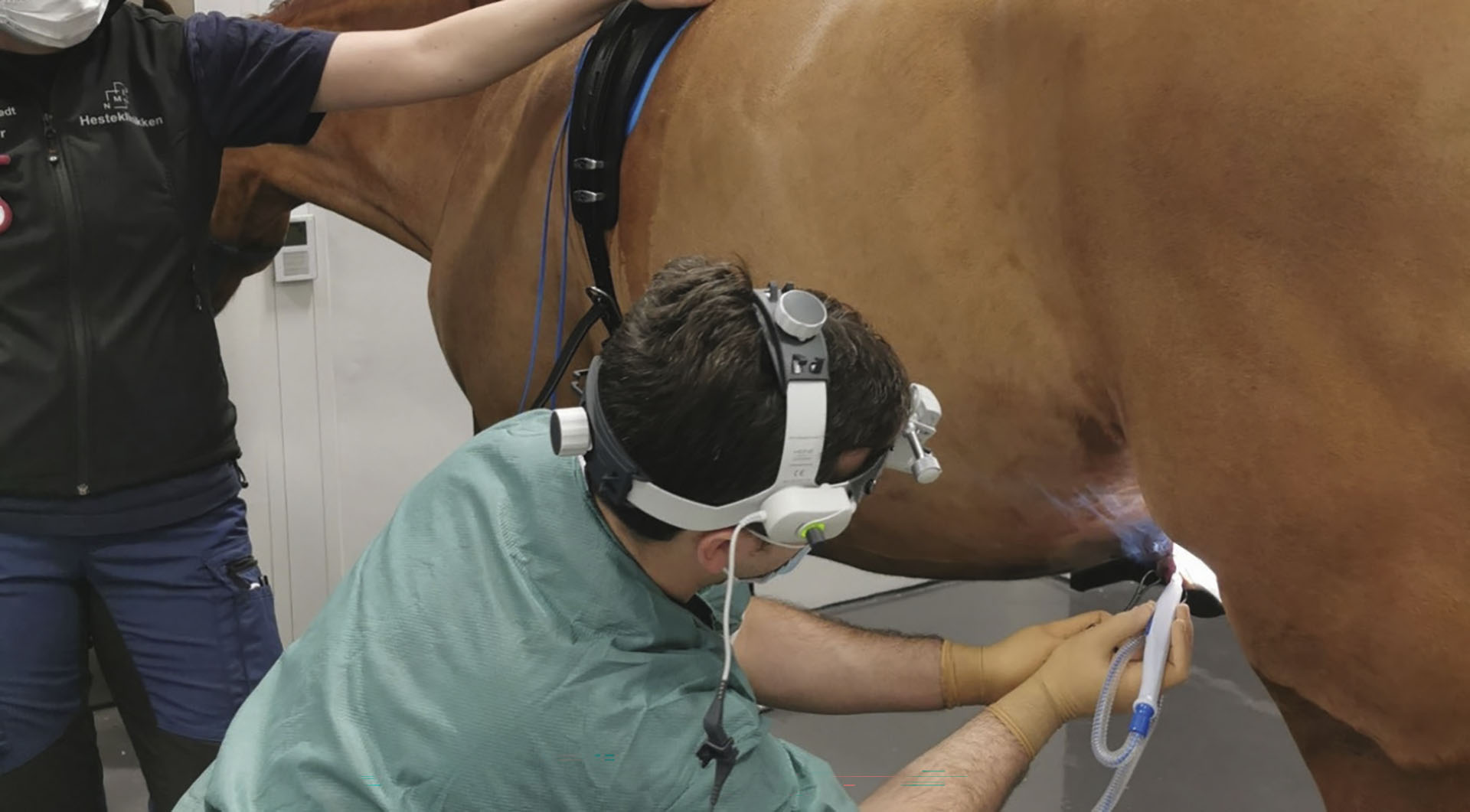
Figur 3. Multimodal behandling av et fibroblastisk sarkoid lokalisert på ventrokaudale aspekt av buken, rett til siden for forhuden, hos en 11 år gammel varmblods ridehest vallak. Tumoren var fast, sirkulær, cirka 15 mm i diameter, og ulcerert sentralt. Den ble fjernet med elektrokirurgi med 20 mm marginer og operasjonssnittet ble sydd igjen for primær sårheling. En emulsjon av carboplatin i olje ble injisert i reseksjonssengen etter endt suturering. Elektrokirurgi gir mindre risiko for utsæd av svulstceller og viruspartikler i snittlinjen sammenlignet med skarp kirurgi som frarådes for sarkoider. Kjemoterapi av snittlinjen påvirker sårhelingen fra inngrepet kun i liten grad. Histologi bekreftet diagnosen, samt frie reseksjonsmarginer med tanke på svulstceller. Rutinemessig histologisk undersøkelse vil imidlertid ikke avdekke eventuell tilstedeværelse av BPV i reseksjonsmarginene.
Foto: Cathrine Fjordbakk
Konvensjonell kirurgisk fjerning av sarkoider ved bruk av skarpe instrumenter er forbundet med høye residivrater og anbefales ikke. Opptil 70 % av svulstene kommer tilbake innen 6 måneder og da i en mer aggressiv form (3,19-21), trolig på grunn av aktivering av latente viruspartikler i snittlinjen. Dette illustreres av at BPV-1 ble funnet i reseksjonsmarginer i 84 % av tilfellene der disse ble erklært histologisk fri for sarkoidceller (20). Funn av BPV-partikler i reseksjonsmarginene ble også i en annen studie assosiert med residiv. BPV ble funnet så langt ut som 16 mm fra den makroskopisk synlige avgrensningen av tumoren (22).
En annen mulig årsak til residiv er at ikke hele tumoren har blitt fjernet. Sarkoider har lange epiteliale utstikkere som ikke er makroskopisk synlige og som når langt ut fra den makroskopisk synlige lesjonen (12). Kirurgisk fjerning med marginer på 5-10 mm, kombinert med elektrokirurgisk kauterisering av tumorsengen, resulterte i en heller dårlig responsrate på kun 28 % i minimum 6 måneder (19). Ved å øke reseksjonsmarginene opp til 16 mm økte responsraten til 82 % i minimum 6 måneder (22). For å minimere risikoen for residiv ytterligere er imidlertid enda større reseksjonsmarginer nødvendig. Så mye som 20-30 mm anbefales dersom kirurgisk fjerning med skarpe instrumenter brukes som den eneste behandlingsmodaliteten (23).
Både elektrokirurgi (Figur 3) og laserkirurgi er å foretrekke over skarp konvensjonell kirurgi. Elektrokirurgi ved bruk av ‘no touch’ teknikk med 12 mm marginer ga en responsrate på nesten 87 % (21). Fordelen med bruk av elektrokirurgi er at såret kan lukkes, mens det ved laserkirurgi står åpent for sekundær sårheling. Varmeenergien fra laserstrålen fordamper cellene i snittlinjen og resulterer i kollateral irreversibel koagulativ nekrose langs snittet som begrenser risikoen for utsæd av svulstceller og viruspartikler, men som samtidig forhindrer primær sårheling. Responsraten for laserkirurgi er angitt til 83 % ved en median oppfølgingsperiode på cirka 2 år (24), og residiverende lesjoner var hovedsakelig lokalisert til hode og hals. Til tross for store sårflater som må gro sekundært viser hestene lite ubehag forbundet med denne behandlingen. Eiere må imidlertid forberedes på at laserkirurgi er forbundet med protrahert sårheling (24). All bruk av laserkirurgi fordrer strenge HMS-rutiner som inkluderer vernebriller for riktig bølgelengde og et behandlingsrom uten refleksive overflater.
Kjemoterapi og elektrokjemoterapi
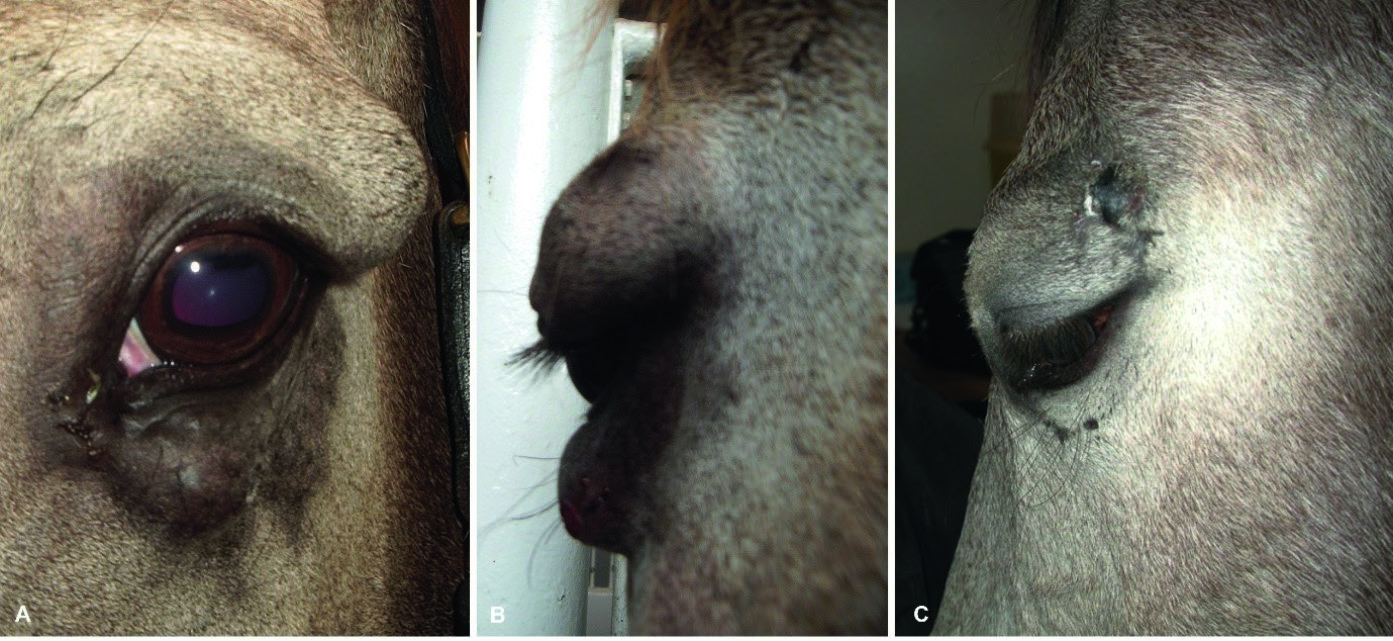
Figur 4. A og B. Varmblods ridehest vallak, 7 år, med nodulære ekvine sarkoider lokalisert i øvre og nedre øyelokk til venstre øye. Lesjonene var faste ved palpasjon, hadde tiltatt raskt i størrelse den siste tiden, og var dekket av normal behåret hud. På grunn av lokalisasjonen av lesjonene ble intralesjonal kjemoterapi brukt som enebehandling da kirurgisk eksisjon er problematisk i dette området. C. Samme hest som i A og B etter tumorremisjon. Hesten var tumorfri 7 år seinere.
Foto: Cathrine Fjordbakk
Som for melanomer kan intralesjonal kjemoterapi med platinoler være en effektiv behandling for sarkoider (Figur 4). Brukt alene resulterte denne behandlingsformen i en respons på svulstnivå på 94 % uten residiv i en oppfølgingsperiode på 3 år. Kombinert med kirurgi for å redusere svulstvolumet, økte responsraten til 98 % (17). Dette kommer av at behandlingseffekten av cytostatika er inverst korrelert med tumorstørrelse. Jo mindre svulstvolumet er ved oppstart av behandlingen, jo bedre respons. Intralesjonal kjemoterapi av sarkoider gjøres etter tilsvarende prosedyre (minimum 4 behandlinger med 2 ukers mellomrom) og platinol dosering (1 mg/cm3) som angitt for melanomer i Del 1 av denne artikkelserien. Strenge HMS-rutiner må implementeres ved all bruk av kjemoterapi. Bivirkninger dreier seg i hovedsak om lokal inflammasjon og irritasjon på injeksjonsstedet. Respons på behandling sees som at svulstene krymper i volum, men ulcerasjon og avstøtning kan også skje. Den resulterende sårhulen må da avhele sekundært, og kan bli infisert spesielt om den er lokalisert på et sted som lett kontamineres fra miljøet. Intralesjonal injeksjon av en annen type cytostatika, mitomycin-C, kan være effektivt i behandlingen av sarkoider og kan brukes dersom effekten av platinoler uteblir (14). Alvorlige bivirkninger i form av utbredte hudnekroser rundt injeksjonsstedet kan imidlertid oppstå slik at mitomycin-C reserveres til lesjoner som viser dårlig respons på behandling med platinoler (14).
Elektrokjemoterapi med platinoler har også vist seg effektiv for behandling av sarkoider. Brukt alene resulterte dette i en 91 % respons på svulstnivå uten residiv over en oppfølgingsperiode på 4 år, mens responsraten økte til 100 % da elektrokjemoterapi ble brukt i kombinasjon med kirurgi (25).
Kryoterapi
Kryoterapi fryser tumorvevet slik at det nekrotiserer. Flytende nitrogen eller CO2 påføres vevet enten via spray eller en probe slik at tumorvevet oppnår en temperatur på -20 °C til -30 °C. En studie av kommersielt tilgjengelige NO og CO2 systemer for kryoterapi avslørte imidlertid at flere av systemene ikke resulterte i adekvat temperatur i målvevet (26). For å sikre effektiv behandling med denne metoden må dermed temperaturen i målvevet overvåkes ved hjelp av termoelement som settes inn i tumorvevet (13).
Selv om det optimale antallet fryse-tine-sykluser for å oppnå effektiv respons ikke er kjent, gir flere sykluser økt grad av tumornekrose. Kombinert med kirurgisk fjerning resulterte 2 til 3 fryse-tine-sykluser i 42 % - 78 % tumorrespons uten residiv i minimum 6 måneder (3,19). Brukt alene ga kryoterapi imidlertid kun 9 % responsrate (16). Det fryste vevet vil som nevnt nekrotisere og avstøtes etter 2 til 4 uker. Gjentatte behandlinger kan være nødvendig. Komplikasjoner i form av alvorlig arrvevskontraksjon kan forekomme slik at denne behandlingsformen forbeholdes svulster på lokalisasjoner der dette ikke vil bli et problem. På større klinikker og hospital har elektro – eller laserkirurgi i all hovedsak erstattet kryoterapi (14).
Topikal behandling

Figur 5. Okkult periokulært sarkoid hos en Fjordhest vallak, 6 år. Sarkoidet sees som et hårløst område med skorpedannelser og huden i området palperes fortykket. Okkulte sarkoider responderer som regel godt på topikal behandling med imiquimod. På grunn av nærheten til øyet ble imidlertid intralesjonal kjemoterapi anbefalt, da topikal behandling gir større risiko for øyeskader.
Foto: Cathrine Fjordbakk
Mange ulike preparater har gjennom tidene blitt brukt til topikal behandling, spesielt av okkulte sarkoider. Tumorlokalisasjon spiller inn på hvorvidt topikal behandling kan anvendes eller ikke. Generelt frarådes slik behandling for periokulære lesjoner siden risikoen for skade på okulære strukturer er stor. Selv om topikal behandling som oftest er enkel å påføre, kan preparatet smitte over på omkringliggende frisk hud og skape utilsiktede effekter samtidig som effekten i tumorvevet reduseres på grunn av lavere legemiddelkonsentrasjon. Gjentatte behandlinger er ofte nødvendig, og hesten kan etter hvert motsette seg dette på grunn av lokal irritasjon og ubehag. Sedasjon og eventuelt analgesi i form av NSAIDs kan være nødvendig for å gjennomføre en behandlingskur.
Imiquimod er det virkestoffet til topikal bruk som har best rapportert respons på svulstnivå (15); 77 % av lesjonene responderte uten residiv i en oppfølgingsperiode på minimum 3 måneder (27). Imiquimod (Aldara krem) er en immunstimulerende krem med antitumor og antivirale egenskaper registrert til topikal behandling av kjønnsvorter og basalcellekreft hos mennesker. En vanlig brukt protokoll for behandling av sarkoider er å påføre kremen tre ganger ukentlig (man-ons-fre) til respons; en behandlingslengde på 4 til 45 uker er rapportert (27). For å oppnå best mulig effekt skal huden vaskes med fettløselig såpe før hver påføring. Kremen er ikke irriterende i seg selv, men virkestoffet trigger en til dels kraftig immunreaksjon på behandlingsstedet som resulterer i lokal irritasjon og ubehag. Immunreaksjonen er assosiert med den farmakologiske virkningen av virkestoffet og er følgelig ønskelig da den er et tegn på at preparatet har effekt. Hansker skal brukes ved all håndtering og påføring av kremen, og en kan forsøke å beskytte omkringliggende hud rundt behandlingsstedet ved bruk av barrierekrem.
5-fluoruracil (5-FU) er et cytostatikum som har blitt brukt til topikal behandling av periokulære og okkulte sarkoider. I en tidlig studie resulterte behandling av små, periokulære lesjoner med 5-FU i en responsrate på 67 % (16), mens senere studier ikke har vist like gode resultater. Brukt alene resulterte daglig påføring i 10 dager i respons kun i 26,7 % av lesjonene, mens kombinert med oppfølgende behandling med et annet cytostatikum, bleomycin, økte responsraten til 77 % (28). Per i dag er en 4 % 4-FU krem registrert til topikal behandling av aktinisk keratose i humanmedisin. En 5 % 5-FU krem (Efudix) kan skaffes ved godkjenningsfritak. Som for imiquimod vil 5-FU kunne gi en lokal immunreaksjon på behandlingsstedet som er ønskelig da den er et tegn på at preparatet har effekt. Hansker skal brukes ved all håndtering og påføring av kremen.
Aciklovir er et antiviralt virkestoff utviklet for å behandle herpeslesjoner hos menneske og som finnes i flere ulike registrerte salver og kremer. Den antivirale effekten er avhengig av at virkestoffet fosforyleres av en spesifikk tymidinkinase som ikke finnes i BPV (29). I en randomisert, dobbeltblindet, placebokontrollert studie fant man ingen effekt av topikal behandling av okkulte og verrukøse sarkoider ved to ganger daglig påføring av en 5 % aciklovir krem i en periode på 6 måneder (4).
AW3, AW4 og AW5 er ulike formuleringer av en kjemoterapeutisk krem som er mye brukt til behandling av sarkoider i Storbritannia, til tross for manglede dokumentasjon både når det gjelder ingredienser og sammensetning av disse, behandlingsprotokoll og responsrater (14). I tillegg til andre ikke oppgitte toksiske substanser, inneholder disse kremene blant annet tungmetaller, steroider, thiouracil og 5-FU. Hansker må brukes ved all håndtering. Den eneste studien som sier noe om respons på behandling rapporterte en responsrate på 35 % ved bruk at AW3 på periokulære sarkoider (16). Kremene er svært etsende, og ekstensiv øyelokksnekrose med tap av selve øyet har forekommet (16). Per i dag frarådes disse kremene til bruk på periokulære lesjoner og lesjoner over n. facialis (30). Store hudnekroser som følge av behandling med AW5 har imidlertid også blitt rapportert på andre lokalisasjoner. En nylig publisert kasuistikk beskrev en 15 cm gjennomgående bukveggsnekrose med påfølgende tarmfremfall hos en 18 år gammel engelsk fullblods vallak som følge av behandling med AW5 (30). Siste behandling ble gitt 6 uker før tarmfremfallet oppstod. Forfatterne av denne kasuistikken rapporterte også et tilfelle av septisk artritt etter bruk av AW5 for et sarkoid lokalisert over dorsale aspekt av et kodeledd (30).
Xxterra® og Dermequin er kommersielt tilgjengelige salver formulert av ekstrakt fra kanadisk blodurt (Sanguinarua canadensis) kombinert med sinkklorid. Også for disse formuleringene er evidensgrunnlaget svært tynt med få publiserte studier. Pettersson et al. (2020) (27) fant en responsrate på 53,6 % ved bruk av Xxterra®, med behandlingslengder varierende fra 4 til 38 uker.
Immunterapi
Bacillus Calmette-Guérin (BCG), et levende men svekket derivat av Mycobacterium bovis, antas å stimulere en lokal cellemediert immunrespons og har vært brukt til behandling av sarkoider siden 1970-tallet. BCG har således ingen direkte cytotoksisk eller antitumor effekt, men kan trigge det lokale immunforsvaret til å initiere en forsinket hypersensitivitetsreaksjon som også nærmest i forbifarten dreper tumorcellene. Denne effekten er imidlertid avhengig av nærkontakt mellom BCG-antigen og tumorcellene, og fordrer at legemiddelet administreres intralesjonalt. Hver enkelt lesjon må følgelig behandles. Et anbefalt behandlingsregime er intralesjonale injeksjoner hver 2. til 4. uke inntil regresjon; 67 % av hestene responderte på dette regimet i en studie som hovedsakelig inkluderte periokulære lesjoner (3). Behandlingen er imidlertid ikke risikofri. Ved bruk av levende vaksine er det risiko for fatalt anafylaktisk sjokk ved oppfølgingsinjeksjoner. Langt vanligere er likevel lokal inflammasjon på injeksjonsstedet, karakterisert av en smertefull hevelse, granulomatøse reaksjoner og eksudasjon. Ulcerasjon og purulent eksudasjon kan ses 2-10 dager etter hver injeksjon.
Autologe vaksiner produseres fra sarkoidvev som deles opp i små biter, fryses i flytende nitrogen, og implanteres subkutant tilbake igjen i pasienten med det formål å re-lære pasientens immunsystem til å gjenkjenne og bekjempe BPV-1/2-infeksjon og dermed bekjempe sarkoidene (31). Selv om 80 % av behandlede hester responderte uten residiv i minimum 6 måneder (31), er dette en svært kontroversiell form for behandling på grunn av flere rapporter om alvorlige og aggressive nydannelser av sarkoider på vaksinestedet (32).
Det foregår en intens forskningsaktivitet for å etablere en sikker og effektiv vaksine mot sarkoider; både en rekombinant IL-2 kanarikoppevirusvaksine registrert til behandling av fibrosarkom hos katt (33) og en rekombinant influensavirusmediert vaksine (1) har blitt testet på hest og funnet sikre i bruk. IL-2 stimulerer antitumor immunitet og har vist seg effektiv i behandling av flere ulike neoplasier. To intralesjonale injeksjoner gitt med en ukes mellomrom resulterte imidlertid i fullstendig respons hos kun 40 % av hestene over en oppfølgingsperiode på cirka 2 år. Optimalisering av doser og behandlingsintervall kan muligens øke klinisk respons og slik kunnskap er nødvendig før denne type vaksiner kan tas i klinisk bruk (33). Den rekombinante influensavirusmedierte vaksinen kan eliminere BPV-infeksjon ved å trigge en cellulærmediert immunrespons hos hester med sarkoider. I en preliminær studie resulterte intralesjonal injeksjon av vaksinen i fullstendig remisjon av sarkoider hos 48 % av hestene, og partiell respons hos 14 % i løpet av en studietid på 13 måneder. Hester med multiple verrukøse sarkoider viste imidlertid ingen respons. Denne forskergruppen er nå i gang med en større klinisk studie på 120 hester der vaksineringen kombineres med kirurgi. Hestene vaksineres intralesjonalt på dag 0, deretter fjernes alle lesjoner kirurgisk på dag 14 før hestene gis en intramuskulær boostervaksine på dag 28 og 56. Foreløpige resultater fra denne studien er svært lovende og representerer kanskje fremtidens behandling for ekvint sarkoid (34).
Konklusjon
Frem til en effektiv vaksine blir tilgjengelig representerer fremdeles behandling av ekvint sarkoid en utfordring. Som for mange andre neoplasier er tidlig diagnostikk og behandling med effektive metoder på et tidlig stadium nøkkelen til suksess. Både tumorstørrelse og tidligere mislykkede behandlinger er inverst korrelert med respons på behandling. Flere behandlingsmetoder brukt i klinisk praksis bygger på et svært tynt evidensgrunnlag med rapporterte responsrater angitt kun for et fåtall individer eller med for kort oppfølgingstid til å kunne vurdere risiko for residiv. Dette betyr med andre ord at en kun får én sjanse til effektiv behandling, og en multimodal behandlingsstrategi, for eksempel en kombinasjon av kirurgisk fjerning og intralesjonal kjemoterapi eller elektrokjemoterapi anbefales i mange tilfeller.
Sammendrag
Ekvint sarkoid er den hyppigst forekommende hudsvulsten hos hovdyr og har mange ulike kliniske presentasjoner: okkult, nodulær, verrukøs, fibroblastisk, blandet og malign. Hos genetisk disponerte hester oppstår svulstene som følge av virusinfeksjon med bovint papillomavirus (BPV). Hester kan også være friske smittebærere av BPV, og hos disse individene vil sår og andre hudtraumer disponere for svulstutvikling. BPV kan overføres med insektsvektorer mellom hester, og i enda større grad fra storfe til hest, slik at sambeiting med storfe frarådes. Svulstene kan oppstå hvor som helst på kroppen, men er vanligst forekommende på tynnhudede steder. Tilsynelatende stabile lesjoner kan plutselig bli aggressive om de utsettes for biopsier eller utilstrekkelig behandling. Diagnosen stilles dermed basert på kliniske funn, som til tross for sarkoidenes ulike presentasjoner ofte er svært karakteristiske. Selv om sarkoider ikke metastaserer til indre organer, utgjør denne svulsttypens lokale invasivitet og aggressivitet et alvorlig helsemessig problem hos rammede hester. Dersom svulstene forblir ubehandlet, eller dersom forsøk på behandling mislykkes, kan svulstene bli så store og til så mye plage at dyrene avlives av dyrevelferdsmessige hensyn. Som for mange andre neoplasier er tidlig diagnostikk og behandling med effektive metoder på et tidlig stadium nøkkelen til suksess. Både tumorstørrelse og tidligere mislykkede behandlinger er inverst korrelert med respons på behandling. Små, flate (okkulte) lesjoner kan la seg behandle med imiquimod som er et topikal immunstimulerende preparat. En multimodal behandling som kombinerer elektro– eller laserkirurgi med intralesjonal kjemoterapi, kan være effektivt for større svulster. Reseksjonsmarginer på > 20 mm er likevel anbefalt for å redusere risikoen for residiv.
Summary
Equine sarcoid is the most common skin neoplasia in equids, and clinical presentation is classified in occult, nodular, verrucose, fibroblastic, mixed, and malignant lesions. In genetically predisposed equids, infection with bovine papillomavirus (BPV) leads to sarcoid formation. Horses may also be asymptomatic BPV carriers, in which skin trauma may trigger sarcoid development. BPV is transmitted between horses, and even more so from cattle infected with BPV to horses, by insect vectors. Although sarcoids may occur at any location on the body, they are commonly seen in thin-skinned areas. Presumed stable or quiescent lesions may become aggressive when biopsied or exposed to failed treatment attempts. Thus, the diagnosis is based on characteristic clinical findings. The local invasiveness and aggressive behavior of sarcoids represent a very serious health problem in equids, even in the absence of a metastatic potential. Untreated lesions, or failed treatment attempts, may render tumors of an incurable size and in which the degree of morbidity necessitates euthanasia. As for other types of skin neoplasia, the key to success is early diagnosis and effective treatment as tumor size and failed treatment attempts are inversely correlated to treatment response. Small and occult lesions may respond to topical treatment with imiquimod, which is a local immune stimulating cream. For large lesions, a multimodal treatment approach combining electro – or laser surgery with intralesional chemotherapy may be effective. However, wide resection margins >20 mm are recommended to reduce the risk of recurrence.
Referanser
Jindra C, Hainisch EK, Brandt S. Immunotherapy of equine sarcoids: from early approaches to innovative vaccines. Vaccines 2023;11:769.
Hartl B, Hainisch EK, Shafti-Keramat S, Kirnbauer R, Corteggio A, Borzacchiello G et al. Inoculation of young horses with bovine papillomavirus type 1 virions leads to early infection of PBMCs prior to pseudo-sarcoid formation. J Gen Virol 2011;92: 2437–45.
Martens A, De Moor A, Vlaminck L, Pille F, Steenhaut M. Evaluation of excision, cryosurgery and local BCG vaccination for the treatment of equine sarcoids. Vet Rec 2001;149:665–9.
Haspeslagh M, Jordana Garcia M, Vlamnick LEM, Martens AM. Topical use of 5 % acyclovir cream for the treatment of occult and verrucous equine sarcoids: a double-blinded placebo-controlled study. BMC Vet Res 2017;13:296.
Jandova V, Klukowska-Rötzler J, Dolf G, Janda J, Roosje P, Marti E et al. Whole genome scan identifies several chromosomal regions linked to equine sarcoids. Schweiz Archiv Tierheilkd 2012;154:19–25.
Lazary S, Gerber H, Glatt PA, Straub R. Equine leucocyte antigens in sarcoid-affected horses. Equine Vet J 1985;17:283–6.
De Araujo Souza, PS, Villa LL. Genetic susceptibility to infection with human papillomavirus and development of cervical cancer in women in Brazil. Mutat Res 2003;544:375–83.
Bogaert L, Martens A, Van Poucke M, Ducatelle R, De Cock H, Dewulf J et al. High prevalence of bovine papillomaviral DNA in the normal skin of equine sarcoid-affected and healthy horses. Vet Microbiol 2008;129:58–68.
Finlay M, Yuan Z, Burden F, Trawford A, Morgan IM, Campo MS et al. The detection of bovine papillomavirus type 1 DNA in flies. Virus Res 2009;144:315–7.
Haspeslagh M, Vlaminck L, Martens A. The possible role of Stomoxys calcitrans in equine sarcoid transmission. Vet J 2018;231:8–12.
Taylor S, Haldorson G. A review of equine sarcoid. Equine Vet Educ 2013;25:210–6.
Martens A, De Moor A, Demeulemeester J, Ducatelle R. Histopathological characteristics of five clinical types of equine sarcoid. Res Vet Sci 2000;69:295–300.
Hewes CA, Sullins KE. Review of the treatment of equine cutaneous neoplasia. I: Proceedings of the 55th Annual Convention of the American Association of Equine Practitioners. Las Vegas, Nevada 2009:386–93.
Hollis AR. Management of equine sarcoids. Vet J 2023;291:105926
Offer KS, Dixon CE, Sutton DGM. Treatment of equine sarcoids: a systematic review. Equine Vet J 2023 https://doi.org/10.1111/evj.13935.
Knottenbelt DC, Kelly DF. The diagnosis and treatment of periorbital sarcoid in the horse: 445 cases from 1974 to 1999. Vet Ophthalmol 2000;3:169–91.
Théon AP, Galuppo LD, Snyder JR, Wilson WD. Intratumoral administration of cisplatin for treatment of sarcoids in 378 horses. I: Proceedings of the 52nd Annual Convention of the American Association of Equine Practitioners. San Antonio, Texas 2006:337–9.
Henson FMD, Dobson JM. Use of radiation therapy in the treatment of equine neoplasia. Equine Vet Educ 2004;16:315–8.
McConaghy FF, Davis RE, Reppas GP, Rawlinson RJ, McClintock SA, Hutchins DR et al. Management of equine sarcoids: 1975–93. N Z Vet J 1994;42:180–4.
Taylor SD, Toth B, Baseler LJ, Charney VA, Miller MA. Lack of correlation between papillomaviral DNA in surgical margins and recurrence of equine sarcoids. J Equine Vet Sci 2014;34:722–5.
Haspeslagh M, Vlaminck LE, Martens AM. Treatment of sarcoids in equids: 230 cases (2008–2013). J Am Vet Med Assoc 2016;249:311–8.
Martens A, De Moor A, Demeulemeester J, Peelman L. Polymerase chain reaction analysis of the surgical margins of equine sarcoids for bovine papilloma virus DNA. Vet Surg 2001;30:460–7.
McCauley CT, Hawkins JF, Adams SB, Fessler JF. Use of a carbon dioxide laser for surgical management of cutaneous masses in horses: 32 cases (1993 – 2000). J Am Vet Med Assoc 2002;220:1192–7.
Compston PC, Turner T, Wylie CE, Payne RJ. Laser surgery as a treatment for histologically confirmed sarcoids in the horse. Equine Vet J 2016;48:451–6.
Tamzali Y, Borde L, Rols MP, Golzio M, Lyazrhi F, Teissie J. Successful treatment of equine sarcoids with cisplatin electrochemotherapy: a retrospective study of 48 cases. Equine Vet J 2012;44:214–20.
Winkler JL, Jeronimo J, Singleton J, Janmohamed A, Santos C. Performance of cryotherapy devices using nitrous oxide and carbon dioxide. Int J Gynaecol Obstet 2010;111:73–7.
Pettersson CM, Broström H, Humblot P, Bergvall KE. Topical treatment of equine sarcoids with imiquimod 5 % cream or Sanguinaria canadensis and zinc chloride: an open prospective study. Vet Dermatol 2020;31:471–e126.
Knottenbelt DC, Watson AH, Hotchkiss JW, Chopra S, Higgins AJ. A pilot study on the use of ultra-deformable liposomes containing bleomycin in the treatment of equine sarcoid. Equine Vet Educ 2020;32:258–63.
Baker CC, Howley PM. Differential promoter utilization by the bovine papillomavirus in transformed cells and productively infected wart tissues. EMBO J 1987;6:1027–35.
Baldwin AJ, Mair TS, Busschers E. Eviceration in a Thoroughbred gelding following application of a topical chemotherapy agent for the treatment of sarcoids. Equine Vet Educ 2023;35:e475-e478.
Espy BMK. How to treat equine sarcoids by autologous implantation. I: Proceedings of the 54th Annual Convention of the American Association of Equine Practitioners. San Diego, California 2008:68–73.
Knottenbelt DC, Patterson-Kane JC, Snalune KL. Principles of oncological therapy. I: Clinical equine oncology. London: Elsevier, 2015:192–3.
Loschelder-Ostrowski J, Winter JC, Merle R, Klopfleisch R, Gehlen H. Treatment of equine sarcoids using recombinant poxviruses expressing feline interleukin-2. Vet Dermatol 2021;32:283–e77.
Hainisch EK, Jindra C, Wolschek M, Muster T, Brandt S. A potent immunotherapeutic vaccine for the treatment of equine sarcoids and underlying bovine papillomavirus infection. Vet Surg 2023;52(5):O6.