Galleblæresludge og galleblæremukocele hos hund
Galleblæresludge (GBS) er med ultralyd definert som ekkoisk innhold i galleblæren som ikke kaster skygge og som kan beveges (1). Galleblæremukocele (GBM) er beskrevet som en unormal akkumulasjon av mukøs, semisolid galle, som kan bre seg inn i den cystiske kanal og utførselsgallegangen. GBM er med ultralyd definert som funn av en ekkoisk, fin-granulert, organisert struktur, som ikke er bevegelig, som kan ligne på en stjerne, med en mer eller mindre veldefinert hypoekkoisk kant inn til galleblæreveggen (5). Dette resulterer i ulik grad av gallestase og progressiv ekspansjon av galleblæren, noe som igjen fører til galleblæreiskemi og nekrose. I verste fall kan galleblæren rupturere og lede til galleperitonitt og i ytterste konsekvens disseminert intravaskulær koagulasjon (2). Denne artikkelen presenterer resultatene av en litteraturstudie med søkelys på klassifisering, om disse to tilstandene er relatert eller helt avgrensede patologiske tilstander, og når disse pasientene bør opereres. Disse tilstandene belyses også med tre kasuistikker.
Spesialist i smådyrsykdommer – hund og katt,
Fyresdal Dyreklinikk
Spesialist i smådyrsykdommer – hund og katt,
Fredrikstad Dyrehospital
Innledning
Galleblæresludge (GBS) er et relativt vanlig funn på ultralyd, og er tidligere forbundet med usikkerhet rundt funnets kliniske relevans (1). I retrospektive studier har GBS en prevalens på 34,9-66,5 % i en generell populasjon (3,4). I en studie fra 1998 ble det konstatert at GBS var et funn uten klinisk betydning, og denne studien pekte også på at det ikke var noen signifikant forskjell på prevalensen av GBM hos friske og syke dyr (1). En studie rapporterer at 24 av 45 hunder med galleblæresykdom har GBS (5), og det er påvist at hunder med GBS har en redusert evne til å tømme galleblæren, på lik linje med hunder med GBM (6). Den samme studien hevder også at det er en signifikant økning i galleblærens volum, både før og etter mat, hos pasienter både med både GBS og GBM, sammenliknet med kontrollgruppen (6). Disse funnene viser at GBS er en unormal tilstand (6).
Galleblæremukocele (GBM) er en tilstand som har økt betraktelig de siste 10-15 årene der en unormal akkumulasjon av mukøs, semisolid galle utvider galleblæren (2,7). På ultralyd er GBM i eldre artikler beskrevet som ubevegelig ekkoisk galle, som ikke endrer posisjon, med stjerneformasjon eller «kiwi-liknende» utseende (7). Histologisk beskrives GBM med hyperplasi av mucinutskillende celler i galleblærens slimhinne (8). Det er en viktig diagnose da så mye som 60,9 % av opererte hunder hadde funn av galleblæreruptur intraoperativt (8), som er en alvorlig komplikasjon av ubehandlet GBM.
Etiologi
Etiologien bak GBS og GBM er dessverre ufullstendig og dårlig forstått. Det er stor usikkerhet rundt primære og sekundære forandringer, og det er trolig en multifaktoriell årsak til at hunder får GBS og GBM. Ejeksjonsfraksjonen i galleblæren er signifikant redusert hos pasienter med både GBS og GBM (6). Hypotesen er at redusert tømming fører til gallestase, og ifølge denne studien har dette trolig en rolle i utviklingen av GBM (6). I en retrospektiv analyse av gallen hos pasienter med både GBS og GBM, ble det påvist at hovedbestanddelen hos begge pasientgrupper var mucin, og det var ingen signifikant forskjell på innholdet mellom de to gruppene, noe som styrker hypotesen om at de har felles patogenese (8,9). Det er publisert en studie som viser at det er forskjell på konsentrasjonen av ulike gallesalter hos GBS og GBM pasienter, hvor det er funnet lavere konsentrasjoner av tauro-deoksykolsyre hos GBM-pasienter sammenliknet med friske kontrollhunder. Det er en relativt liten studie, og det er dermed knyttet stor usikkerhet til hvilken betydning dette eventuelt har for utviklingen av GBM (10). En annen hypotese er at hyperkortisolisme spiller en rolle i utviklingen av GBS og GBM (8,11). I en veldig liten studie fra 2011 blir det fremsatt en hypotese om at GBM ikke kan utvikle seg fra en helt normal anekkoisk galle, og at det trolig er et mellomstadium med mikropresipitat før det utvikler seg til GBM (12). I denne prospektive, randomiserte studien ble 12 beagler delt inn i to grupper, hvor den ene gruppen ble utsatt for iatrogen hyperkortisolisme. Denne studien fant ingen signifikant forskjell mellom de to gruppene hvordan GBS så ut på ultralydundersøkelsen. Alle hundene som ble behandlet i denne studien hadde sludge i galleblæren på dag 56, og 50 % av hundene som var i kontrollgruppen hadde også GBS på dag 56. Det er dessverre en altfor liten studie, utført over alt for kort tidsintervall, til å få en klar oversikt over om hyperkortisolisme har en relevans for utviklingen av GBS, og eventuelt en påvirkning på videre utvikling til GBM (12). En studie fra 2010 vurderte genetiske faktorer der de fant at 14 av 15 hunder av rasen Shetland sheepdog med GBM hadde en innsettingsmutasjon i ABCB4 genet (13). Hos hunder av rasen Shetland sheepdog uten GBM var det 20 av 21 hunder som ikke hadde denne mutasjonen. Mutasjon i dette genet fører til en endring i det beskyttende laget av fosfolipider i galleblæren, og med det endres også hva epitelcellene i galleblæren utsettes for. En slik mutasjon kan forklare hvorfor denne rasen er utsatt for utvikling av GBM, men flere og større studier bør gjennomføres for å få klarhet i betydningen av denne genetiske faktoren.
Mulig predisponerende faktorer
GBS og GBM er sykdommer som vanligvis opptrer hos små til mellomstore raser. Shetland sheepdog, cocker spaniel, toy-puddel, chihuahua, miniatyr schnauzer, border terrier, bichon frisé og beagle er overrepresenterte raser (2,5,7,8,10,11,14-19). Labrador retriever er en rase som er beskrevet som utsatt for GBS, men er ikke en rase som er predisponert for GBM (3,4,14). En studie fra England fra 2018 viser også at border terrier og affenpinschere er predisponert for GBM i den engelske populasjonen, noe som viser at det kan være geografiske forskjeller for hvilke raser som er predisponert (16). Aguirre et al. beskrev i 2007 at Shetland sheepdog har over syv ganger større risiko for å utvikle GBM sammenliknet med andre raser (11). Gjennomsnittsalder er ti år (1,2,4,5,8,11,14-20). Det finnes ingen studier som viser til kjønnsprevalens.
Det er mye som tyder på at pasienter med hyperadrenokortisisme (HAC) (18,21), hypotyreose (HT) (18) og hyperlipidemi (17,22) har signifikant høyere odds for å utvikle GBM. En studie fra 2009 fant en tydelig korrelasjon mellom HAC og GBM, og oddsen for å påvise GBM hos pasienter med HAC var 29 ganger høyere enn pasienter uten HAC. I denne studien var det også en sterk korrelasjon hos pasienter med HT, men de hadde kun tre ganger så høy risiko for å ha GBM sammenliknet med hunder uten HT (18). En studie fra 2015 så på koblingen mellom ulike legemidler og histologisk diagnostisert GBM (21). Denne studien viste at hunder med GBM hadde over dobbelt så høy sannsynlighet for å ha blitt behandlet med tyroksin, 3,6 ganger høyere sannsynlighet for å ha blitt behandlet for HAC og 2,3 ganger høyere sannsynlighet for å ha blitt behandlet med imidakloprid (21). Da de spesifikt så på Shetland sheepdog med GBM så var det 9,3 ganger høyere sannsynlighet for å ha rapportert bruk av imidakloprid. Da de i 2016 så på 200 pasienter med GBS, så var det ingen forskjell på prevalensen for endokrinopatier (HAC, HT eller diabetes melitus (DM)) mellom hunder med mild GBS (grad 1-2) sammenliknet med mer alvorlig grad av GBS (grad 3-5). I denne studien ble det likevel beskrevet at hunder med HAC eller HT hadde en høyere sannsynlighet for å ha mer alvorlig grad av GBS, enn hunder uten HAC/HT (4). Det rapporteres at mellom 8-23,3 % av pasienter med GBM har HAC, mens cirka 6-26 % har HT (4,11,17,18,23).
Kliniske tegn
Kliniske tegn på GBS og GBM er ofte uspesifikke (8,17,24,25), og henholdsvis 12,5 % og 17,6 % av pasienter med GBS og GBM viser ingen kliniske sykdomstegn (14,17). I en studie fra 2014 hadde 44 % av hunder med GBM ingen kliniske tegn forenlig med hepatobiliær sykdom (7). Mange hunder har uspesifikke kliniske tegn som oppkast fra tid til annen, letargi, eller milde uforklarlige økninger i leverenzymer (5).
Når det kommer til klinisk presentasjon så varierer det avhengig av hvor akutt tilstanden er. En del pasienter kommer med lengre sykdomshistorikk, mens andre kan komme akutt grunnet galleblæreruptur (5). Oppkast er det vanligste kliniske tegnet hos disse pasientene og er til stede hos 40-80 % av alle pasienter (5,11,17,19). Andre kliniske tegn er letargi (46-73 %), anoreksi (46-71 %), abdominale smerter (16-44 %), diaré (18,3-28,9 %) og ikterus (9,8-46 %) (5,16,17,19). Hos pasienter med galleblæreruptur så er det så mange som 64,2 % som presenterer med ikterus (8).
Diagnostiske undersøkelser
Blodanalyser
Hematologiske og biokjemiske analyser hos disse pasientene viser svært varierende resultater. I en studie fra 2019 hadde så mange som 26 % av pasientene hematologiske og biokjemiske analyseresultater innenfor referanseintervallene, til tross for påvist GBM (17). De vanligste endringene er leukocytose (40-80 %), nøytrofili (48-75 %), monocytose (51 %), lymfopeni (41 %), eosinofili (35 %) og trombocytose (29 %) (5,16). En studie beskriver at kun 10 av 40 hunder hadde toksiske forandringer i de sirkulerende nøytrofile granulocyttene, og alle av disse hadde histologisk galleblærenekrose, hvorav fem hadde galleblæreruptur (5). Hos Shetland sheepdog med leukocytose og nøytrofili var det en signifikant økt risiko for mortalitet (11). Når det gjelder endringer i biokjemiske analyser er de vanligste funnene forenlig med leverpatologi. Økning i ALT, ALP, GGT og bilirubin er relativt vanlig, men det er ikke en direkte korrelasjon med alvorlighetsgraden av GBS eller GBM (4,26). Økning i kolesterol og triglyserider er også relativt vanlige avvik hos disse pasientene. De vanligste endringene er økt ALP (90,9-97,0 %), økning i ALT (74-91 %), økning i GGT (60,5-85 %), hyperbilirubinemi (52,0-88,4 %), hyperkolesterolemi (47,3-93,0 %), hypertriglyseridemi (27-66 %) og hypoalbuminemi (15-48 %) (5,11,16,17,27,28). En studie viser til at økning i bilirubin er assosiert med økt mortalitet (17,28). Økningen i bilirubin hos pasientene i denne studien var i snitt 3,2 ganger høyere enn øvre referansegrense. En cut-off verdi på 4,3 ganger øvre referansegrense for bilirubin hadde en sensitivitet på 61 % og en spesifisitet på 63 % for mortalitet hos hospitaliserte pasienter (17). Det er nærliggende å tro at hyperbilirubinemi hos pasienter med GBM representerer tilfeller der det dreier seg om mer alvorlig grad av sykdom, og mulige komplikasjoner som gallestase og rupturert galleblære. Hyperbilirubinemi kan derfor vurderes som en negativ prognostisk faktor (17). Flere studier beskriver at pasienter med rupturert galleblære oftere har økning i leverenzymene, og 12 av 14 pasienter med ruptur hadde hyperbilirubinemi (8,17). Det er en positiv korrelasjon mellom økning i totalt antall leukocytter og antall nøytrofile granulocytter hos pasienter med rupturert galleblære (5,7).
Ultralydundersøkelser
Bildediagnostikk er et av de viktigste verktøyene til å avdekke GBS og GBM, og definisjonen av de to tilstandene er under utvikling. Definisjonen av GBS er funn av bevegelig ekkoisk materiale i galleblæren som ikke skaper skygge (26). GBM er på ultralydundersøkelse definert som funn av en ekkoisk, fingranulert, organisert struktur, som ikke er bevegelig, som kan likne på en stjerne med en mer eller mindre veldefinert hypoekkoisk kant inn til galleblæreveggen (5). Ultralydundersøkelser brukes også for å kartlegge andre endringer som galleblæreveggens tykkelse, om det er fri væske rundt galleblæren, om ultralydsignalet fra leveren er sammenliknbart med nyrebark, om det er tegn til dilatasjon av galleganger og utførselsgang, og om det er funn av galleblæreruptur (5). Det er i senere tid publisert ulike klassifiseringssystemer både for GBS (Tabell 1 og 2) og GBM (Tabell 3) (4,7,26).
I Tabell 1, 2 og 3 er det mye som går igjen i beskrivelsen av de mest alvorlige gradene av GBS og den mildeste graden av GBM. I en studie fra 2022 blir nettopp det at det er vanskelig å skille disse to ulike tilstandene diskutert, og studien angir at pasienter med GBS har en risiko for å utvikle GBM (29). I en stor studie fra 2018 ble 20 % (44/218) av pasientene med histologisk verifisert GBM ikke identifisert med GBM på ultralyd (15). Dette sier noe om hvor vanskelig det er å vurdere dette på ultralyd. En usikkerhet i klassifiseringssystemet til Choi et al (Tabell 3) er at det ikke er noen beskrivelse av hvor mye av galleblærens volum som må være fylt for å bli klassifisert som type 1, og det er derfor vanskelig å være sikker på hvor GBS slutter og GBM begynner (14). Om klassifiseringene i Tabell 2 og 3 sammenlignes, så er det ulike grader som beskriver sludge som ikke bevegelig, og disse gradene er beskrevet som «nongravity-dependent biliary sludge» (NDBS). Det er flere hypoteser om at dette stadiet er et mellomstadium mellom GBS og GBM (14,29). Det er viktig å huske at alle mønstrene som ses på ultralyd kan bli funnet hos både pasienter med og uten kliniske tegn. Grad 2 GBM var den vanligste graden hos pasienter med galleblæreruptur, sammenlignet med de uten ruptur (7). En studie fra 2022 undersøkte de ulike typene av GBM og sammenheng med kliniske tegn. Den viser at det er større sannsynlighet for å vise tegn til sykdom assosiert med hepatobiliær patologi ved type 5 og type 6, sammenliknet med type 1 til 3 (30).
Utover å klassifisere funn i galleblæren, brukes ultralyd også til å vurdere andre parametere som størrelsen på galleblæren, galleblæreveggens tykkelse, eventuell galleblæreruptur, samt vurdering av levervev og gallestase. Hos pasienter med både GBS og GBM er det dokumentert en økning i galleblærevolum (6). Cook et al beskriver ulike grader av GBS basert på volum okkupert av sludge. I den studien er det signifikant forskjell på volumet i galleblæren hos pasienter med grad 1-2, sammenliknet med grad 3-5 (4). Galleblæreveggen blir ansett som fortykket når den måler mer enn 3 mm (7). Galleblæreruptur er en alvorlig komplikasjon av ubehandlet GBM, og øker risikoen for mortalitet betraktelig (15). Det er derfor viktig med gode diagnostiske verktøy for å vurdere om galleblæren er rupturert. Abdominal ultralydundersøkelse hadde kun 56 % sensitivitet, men hele 91,7 % spesifisitet for å identifisere rupturert galleblære i en studie fra 2018 (15). Tidligere studier har rapporter sensitivitet for vurdering av galleblæreruptur til å være så høy som 78,6-85,7 % (7,8).
Gradering |
Beskrivelse |
|---|---|
1 |
Gallen er helt hypoekkoisk, ingen sedimentering |
2 |
1-25 % av gallen er hyperekkoisk, bevegelig |
3 |
26-50 % av gallen er hyperekkoisk, bevegelig |
4 |
51-75 % av gallen er hyperekkoisk, bevegelig |
5 |
> 75 % av gallen er hyperekkoisk |
GBM |
Solid, hypereekkoisk, ikke bevegelig masse med hyperekkoiske streker |
Gradering |
Beskriver % av galleblærens volum som er fylt med sludge |
|---|---|
0 |
0 % |
1 (mild) |
0,01-24,4 % |
2 (moderat) |
24,5-49,4 % |
3 (moderat til alvorlig) |
49,5-74,4 % |
4 (alvorlig) |
74,5-100 % |
Gradering |
Beskriver hvordan det ekkoiske innholdet beveger seg |
0 |
Bevegelig sludge |
1 |
Blanding av ikke-bevegelig og bevegelig sludge. Sitter fast mot galleblæreveggen |
2 |
Ikke bevegelig sludge |
3 |
Bevegelig og suspendert sludge |
4 |
Suspendert sludge som ikke er tilknyttet galleblæreveggen |
5 |
Suspendert, bevegelig og ikke bevegelig sludge |
Type |
Beskrivelse |
|---|---|
Type 1 |
Ubevegelig ekkogen galle (non-gravity dependent biliary slush, NDBS) |
Type 2 |
Ufullstendig stjernemønster |
Type 3 |
Typisk stjernemønster |
Type 4 |
Kombinasjon av kiwimønster og stjernemønster |
Type 5 |
Kiwilignende mønster med gjenværende ekkogen galle i midten |
Type 6 |
Kiwimønster |
Histologi
I 2015 ble det lagt frem en definisjon av GBM basert på histologisk vurdering (21). Histologisk vurdering ansees i dag som gullstandarden for å diagnostisere GBM. I 2015 ble GBM beskrevet som tilstedeværelsen av store akkumulasjoner av tykt gelatinøst slim som fyller og utvider galleblærens lumen. Det er lange tynne forgreininger av veldifferensiert galleblæreepitel inn i det gelatinøse slimet. Cellene er moderat utvidet og inneholder klart cytoplasma fylt med mucin (21). Tidligere studier beskriver at GBM er bekreftet ved histologi dersom det er hyperplasi av mucinkjertlene i slimhinnen og unormal akkumulasjon av mucin i galleblærens lumen (8,11).
I en studie fra 2020 er det utført histologi på 16 galleblærer fra pasienter kun med type 1 GBM/NDBS. Det ble utført kolecystektomi ved > 50 % innhold, mens hos pasienter med < 50 % innhold ble det vurdert tilleggskriterier før kolecystektomi ble gjennomført (14). Det var patologiske forandringer i alle galleblærene som ble vurdert. Det ble påvist kolecystitt hos 86 %, hvor hovedandelen var lymfoplasmacytær. Hos 64 % (9/14) var det cystisk mukøs hyperplasi. Av disse ble to funnet hos pasienter som hadde mindre enn 50 % av galleblærens volum fylt opp, mens fem ble funnet hos pasienter med mer enn 50 % av galleblæren fylt. To av prøvene hadde kun slimhinnehyperplasi uten mucincyster. Den histologiske beskrivelsen fra 2015 ble ikke påvist hos noen av pasientene i denne studien. Denne studien presiserer at det ikke bare er på ultralyd det er vanskelig å vurdere overgangen fra GBS til GBM, og at det trolig er en progresjon fra bevegelig GBS til immobil GBS til GBM (14). Det er også beskrevet i 2022 at det er utvikling fra NDBS til GBM over tid på ultralydundersøkelse (29). I denne studien fra 2022 ble en gruppe på 154 hunder med GBS fulgt opp med ultralydundersøkelser over mer enn 12 måneder. Det ble brukt en modifisering av de ulike klassifiseringssystemene, og de så på hvordan gradene av sludge utviklet seg over tid. 40,3 % av pasientene hadde ingen endring i graden av GBS, 41 % hadde en økt grad av GBS og 18,7 % hadde redusert grad av GBS på slutten av studieperioden. I løpet av studieperioden utviklet 20 hunder (13 %) GBM, og gjennomsnittlig tid fra diagnose av GBS til utviklingen av GBM var 19 måneder (7-36 måneder) (29). Studien konkluderte med at det ikke var en signifikant forskjell på graden av sludge når studien startet sammenliknet med når den sluttet, men det var en økt risiko for at pasienten utviklet GBM dersom den hadde en høy grad av GBS ved studiestart (29). Denne studien sammen med en enkel kasusrapport på en miniatyr schnauzer (31), er de eneste rapportene per nå som beskriver utvikling av GBS til GBM.
Behandlingsalternativer
Behandlingsalternativene avhenger av hvilken grad av GBS eller GBM som påvises, kliniske tegn og hematologiske og biokjemiske avvik. Medisinsk behandling av disse pasientene innebærer behandling med ursodeoksykolsyre 10-15 mg/kg per os daglig med eller uten S-adenosyl-L-metionin (SAMe) tilskudd (32). Det beskrives oppfølging med ultralyd hver tredje måned i en studie fra 2016, men ellers er det ikke beskrevet en anbefaling på hvor ofte ultralydundersøkelser bør gjennomføres etter at medisinsk behandling er startet. Det er vanlig med medisinsk behandling av GBS eller milde typer av GBM.
Kolecystektomi er den vanligste behandlingen for GBM. I en studie fra 2019 av overlevelsestid på medisinsk vs. kirurgisk behandling ble det konkludert med at kolecystektomi er det beste alternativet for langtidsoverlevelse. Kolecystektomi er fra tidligere assosiert med mortalitetsrate så høy som 32-40 % (2,25), men dette er små studier fra tidlig 2000-tallet. Nyere studier viser en betydelig lavere mortalitet postoperativt, 16,7-23 % (15,19,20,27). Det som er interessant med studien fra 2021 er at det er stor forskjell på mortaliteten hos de pasientene som blir operert som en elektiv prosedyre (6 %), sammenliknet med de pasientene som opereres som en non-elektiv prosedyre (23 %) (19).
Prognose
Galleblæreruptur, og påfølgende galleblæreperitonitt, er en komplikasjon av ubehandlet GBM, og er som tidligere beskrevet vanskelig å avdekke på ultralydundersøkelse. Det er i tidligere studier rapportert at så mange som 42,9-60,9 % har rupturert galleblære på det tidspunktet de blir operert (5,8). Studier fra 2014 viser at 26 % har rupturert galleblære, mens studier fra 2021 rapporterer 20 % rupturert galleblære oppdaget under operasjon. Til tross for at det er studier som forfekter at det ikke er økt risiko for mortalitet ved galleblæreruptur (8,25), så er det flere studier av nyere dato som tydelig viser økt risiko for mortalitet etter rupturert galleblære (15,19). En studie viser til 33 % mortalitet ved rupturert galleblære (19), to studier viser nesten tre ganger høyere risiko for mortalitet ved funn av rupturert galleblære (15,20).
Kasuistikker
De tre hundene som beskrives i Kasuistikk 1-3 var alle pasienter ved Dyreklinikken Sør. For alle 3 kasusene ble det brukt Idexx Procyte (Idexx Laboratories, Inc. Westbrook, Main, USA) for de hematologiske analysene og Idexx Catalyst (Idexx Laboratories, Inc. Westbrook, Main, USA) for de biokjemiske analysene. Ultralydmaskinen som ble brukt i alle undersøkelsene var en GE Healthcare Vivid Vet E90. Ultralydundersøkelsene ble utført av en smådyrveterinær med 10 års erfaring.
Kasuistikk 1
Signalement og anamnese
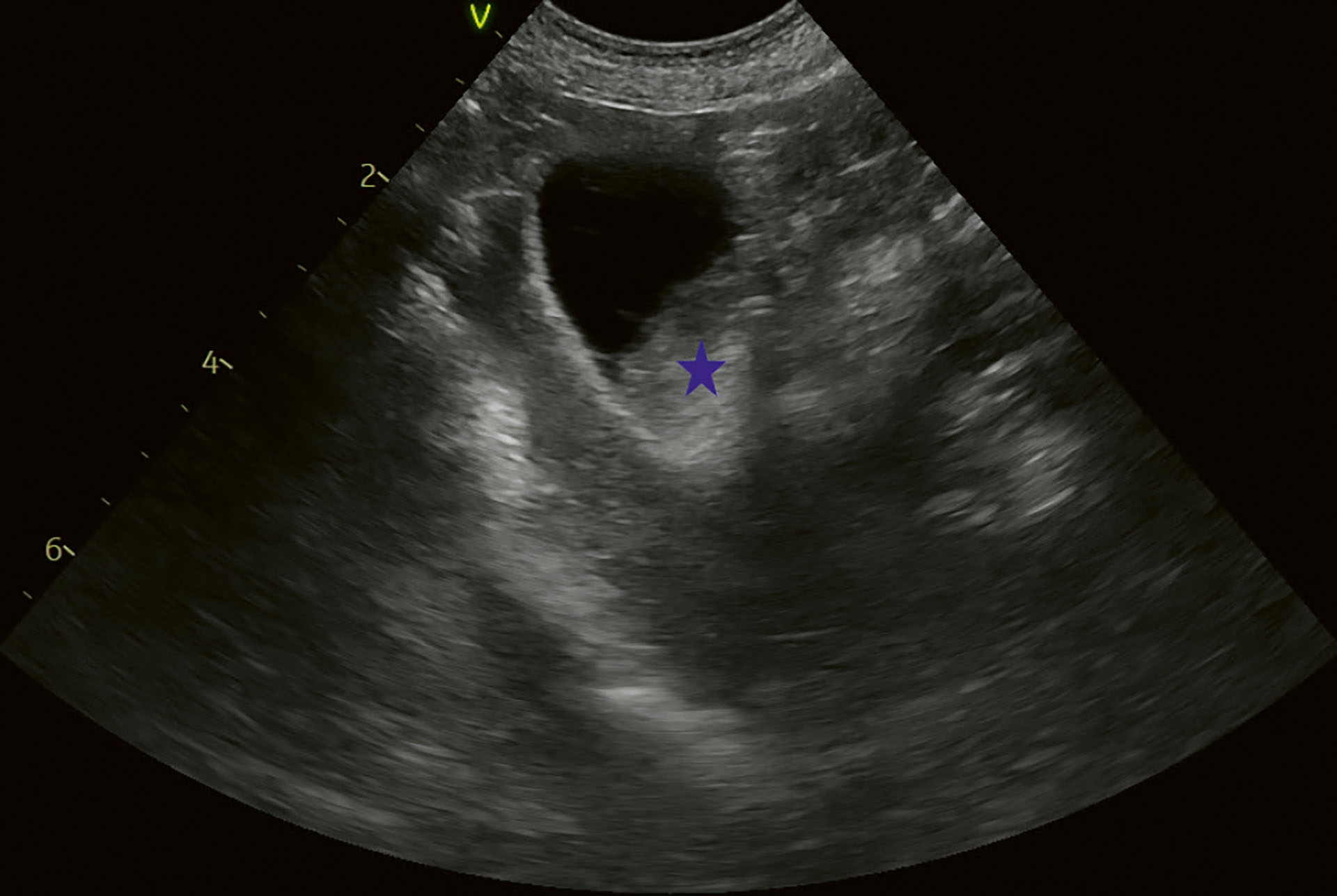
Figur 1. Kasus 1. Første ultralydundersøkelse i 2020. Galleblære med ekkoisk innhold i nedre del. Blå stjerne indikerer gallesludge.
Foto: Anja B. Pedersen
Shetland sheepdog, kastrert tispe, 11,5 år, cirka 8 kg. Ultralydundersøkelsen ble første gang utført når hunden var 8 år, som en screening da to hunder i samme tispelinje hadde fått påvist galleblæremukocele (Figur 1). Det ble påvist GBS grad 3 (4), og hunden ble igangsatt på konservativ behandling med 12,5 mg/kg ursodeoksykolsyre (Ursofalk® Mikstur 50 mg/mL, Dr. Falk Pharma GmbH Tyskland) SID per os. Hunden viste veldig lite kliniske tegn forenlig med GBS, men den ble monitorert jevnlig med både ultralyd (Figur 2 og 3) og blodprøver. Ved siste presentasjon hadde hunden vært litt nedstemt den siste måneden, og hadde begynt å kaste opp de siste 12 timene. Eier var generelt bekymret. Det var 3 måneder siden siste undersøkelse av galleblæren, og den ble da vurdert som GBS grad 3, uten tegn til utvidet galleblærevolum.
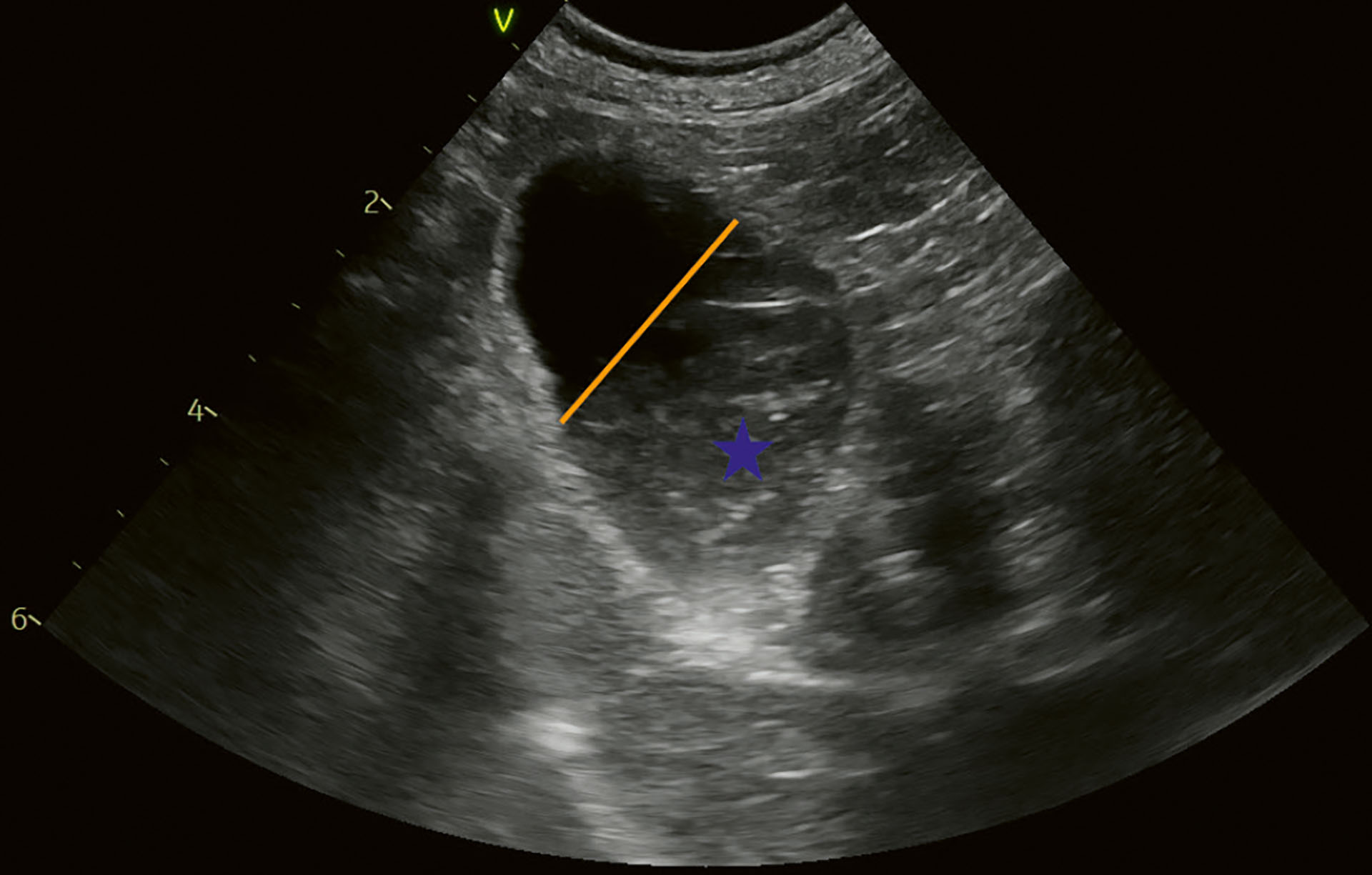
Figur 2. Kasus 1. Årlig oppfølging 2022. Galleblæren er noe større enn tidligere, men innholdet var fortsatt bevegelig og dekket mellom 25-50 % av galleblærens volum. Blå stjerne indikerer gallesludge. Orange linje indikerer innhold cirka 25-33 %.
Foto: Anja B. Pedersen
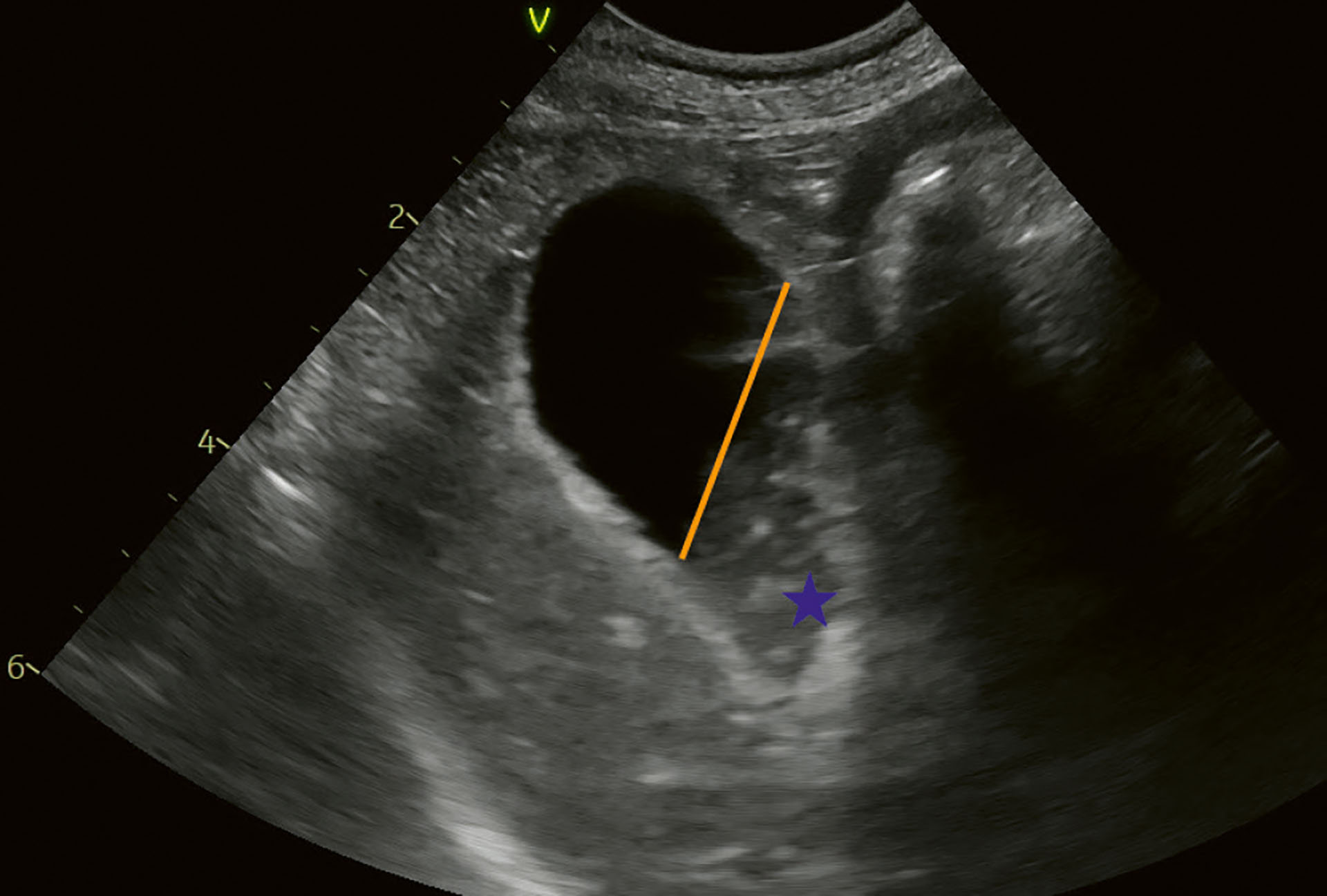
Figur 3. Kasus 1. Oppfølging våren 2023. Galleblæren er noe større enn ved første undersøkelse, men innholdet var fortsatt bevegelig, og dekket mellom 25-50 % av galleblærens volum. Blå stjerne indikerer gallesludge. Orange linje indikerer innhold cirka 50 %.
Foto: Anja B. Pedersen
Klinisk undersøkelse
Hunden var stille, virket nedstemt og mildt smertepåvirket. Auskultasjon av hjerte og lunger var uten anmerkning, puls var 110/minutt, respirasjon var overfladisk 12/minutt. Hunden hadde fuktige, normalt rosa slimhinner med kapillær fyllingstid på 2 sekunder. Buken var tydelig stinn og palpasjonsøm kranialt. Rektal temperatur var 38,7 °C.
Diagnostiske undersøkelser
Hematologisk analyse viste en mild, non-regenerativ, anemi som eneste avvik. Biokjemiske analyser viste mild økning av ALT, ellers ingen avvik. Det ble ikke utført cCRP måling.
På ultralyd ble galleblærens volum målt til 5 cm lang, 4,5 cm høy og 4 cm bred, og ble vurdert til å være svært forstørret (Figur 4). Den var fylt med ekkoisk innhold som var ubevegelig. Det var en kant mellom galleblærens innhold og veggen med anekkoisk innhold (Figur 5). Det var også flere områder med hyperekkoiske partikler. Galleblæreveggen var fortykket og gallegangene ble vurdert som mildt dilaterte. Området rundt galleblæren var vanskelig å vurdere, og omliggende levervev var hyperekkoisk.
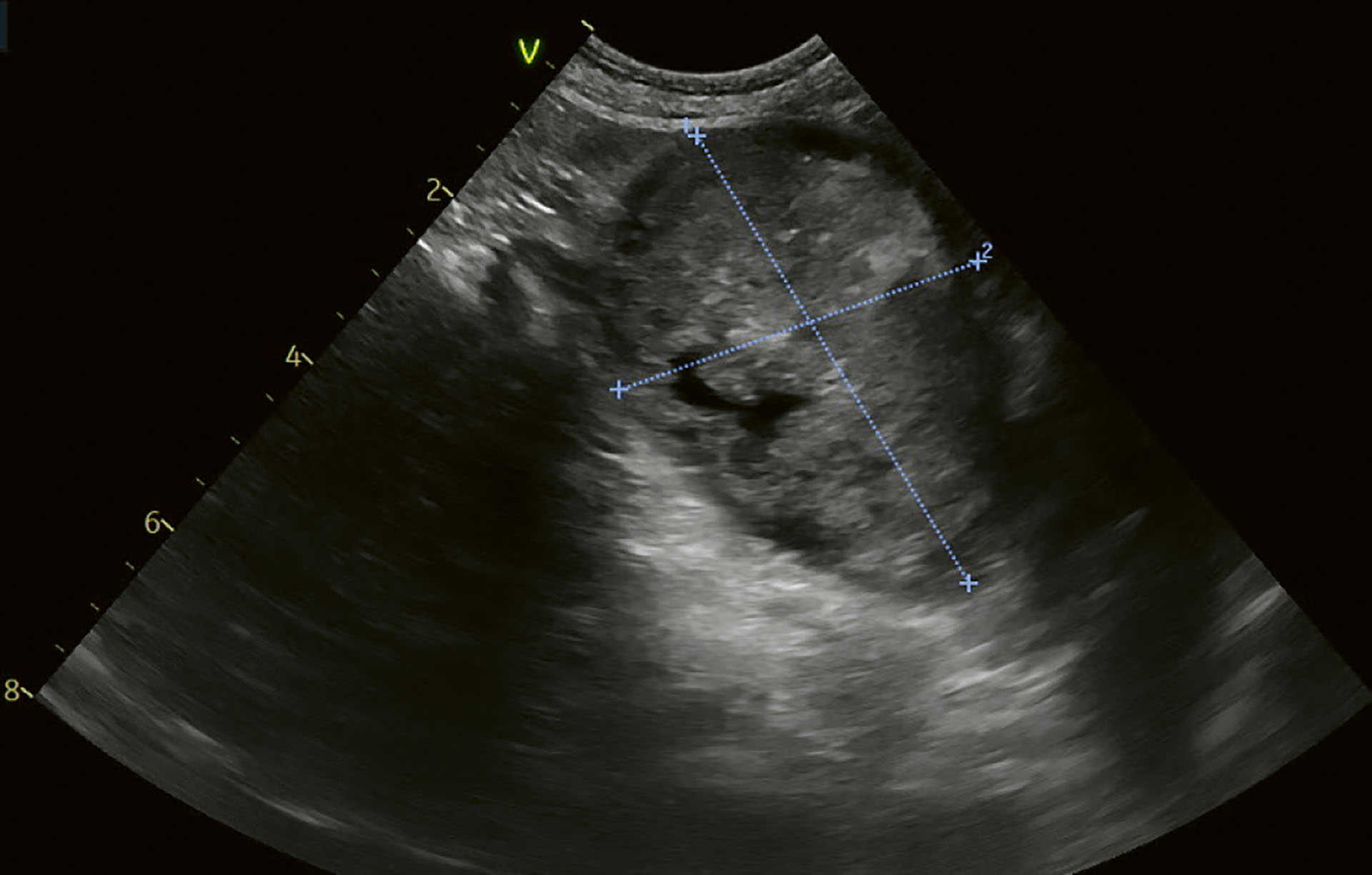
Figur 4. Kasus 1. Oppfølging sommeren 2023. Galleblæren var helt fylt med ekkoisk innhold. Innholdet var ikke bevegelig. Det var flere hyperekkoiske områder og det var en åpenbart forstørret galleblære (Bredde 4 cm, lengde 5 cm, høyde 4,5 cm). Omliggende levervev var hyperekkogent.
Foto: Anja B. Pedersen
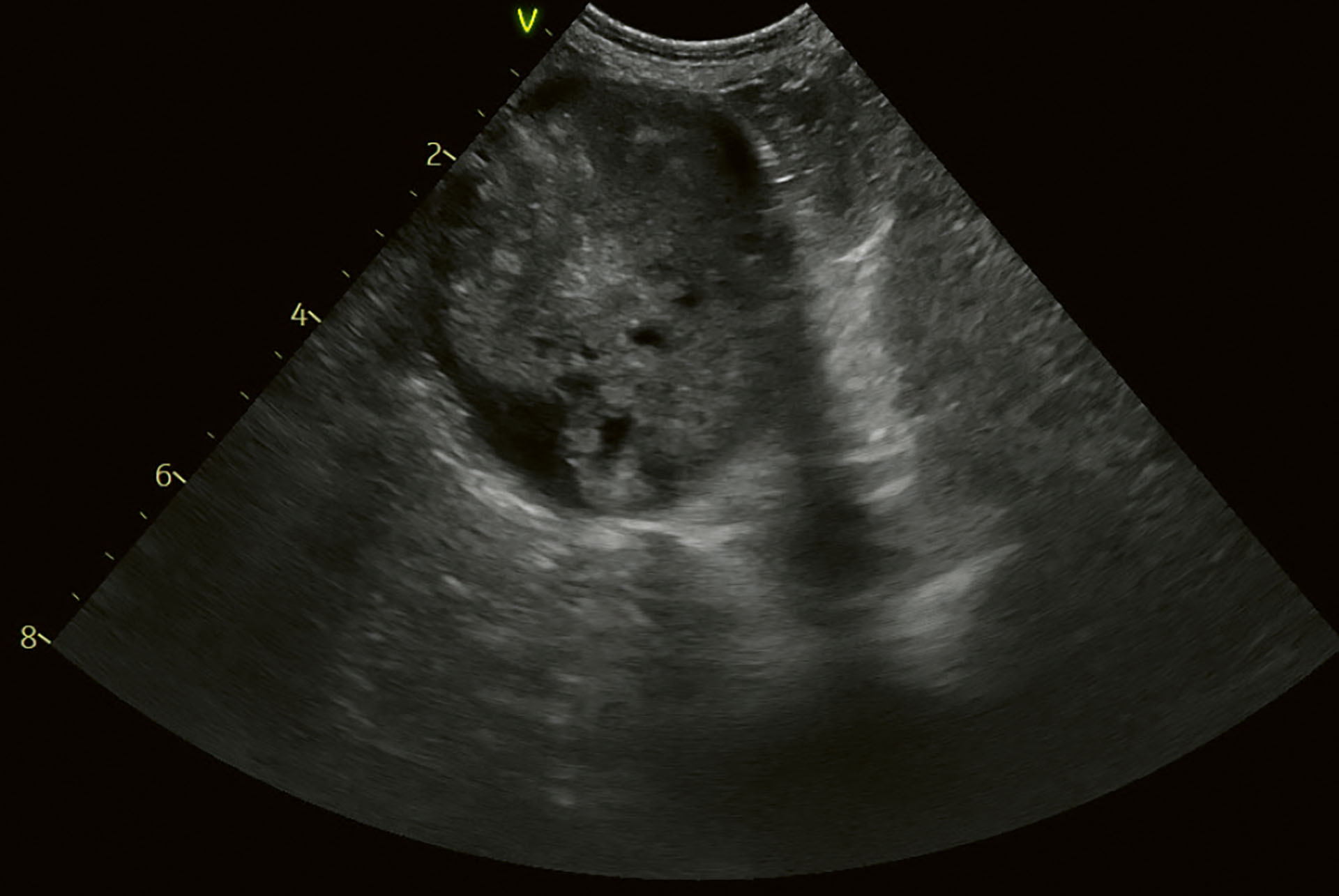
Figur 5. Kasus 1. Undersøkelse samtidig som Figur 4. Tverrsnitt. Forstørret galleblære med en ekkoisk masse som ikke var bevegelig. Innholdet så ikke ut til å være adherent til veggen.
Foto: Anja B. Pedersen
Konklusjon
Det var mistanke om galleblæreruptur grunnet tap av skillet mellom galleblæreveggen og levervevet. Denne pasienten hadde blitt fulgt opp over nesten 4 år, noe som er en svært lang periode. I denne perioden holdt den seg stabil lenge, og det var ingen store endringer mellom undersøkelsene som ble gjennomført hver 3-6 måned. Det ble gjort en samlet vurdering av hundens helsetilstand, og det ble bestemt at hunden skulle avlives av dyrevernmessige hensyn. Begrunnelsen var store endringer på den siste ultralydundersøkelsen, risiko for at galleblæren hadde rupturert, høy komplikasjonsrate på operasjon og eiers ønske.
Obduksjon
Det ble utført en begrenset obduksjon av hunden. Galleblærens overflate var stram og hard ved palpasjon og hadde tydelige petekiale blødninger i serosa, samt unormale sammenvoksinger mellom leverlapper og galleblæren. Det ble forsøkt å trekke vekk galleblæren fra lever, men det var ikke mulig å separere de to (Figur 6 og 7). Det var ingen lekkasje fra galleblæren. Med unntak av leverlappen rundt galleblæren, hadde resten av leveren et normalt utseende med en glatt overflate og skarpe kanter. Leverens tekstur kjentes normal ut. Det var ikke tegn til blokkering av gallegangsutløpskanal, det kom ut tyktflytende galle med små svarte partikler. Da galleblæren ble åpnet var innholdet tydelig unormalt, en stor grønn-svart gelatinøs masse som hang fast i galleblærens vegg. Resten av abdomen var uten makroskopiske funn. Det ble tatt vevsprøver til histopatologisk undersøkelse fra makroskopisk normalt levervev, fra den delen av galleblæren som var festet til leverlappen og en prøve av galleblæren. Galleblærens innhold ble sendt til bakteriologisk vurdering og cytologisk analyse.
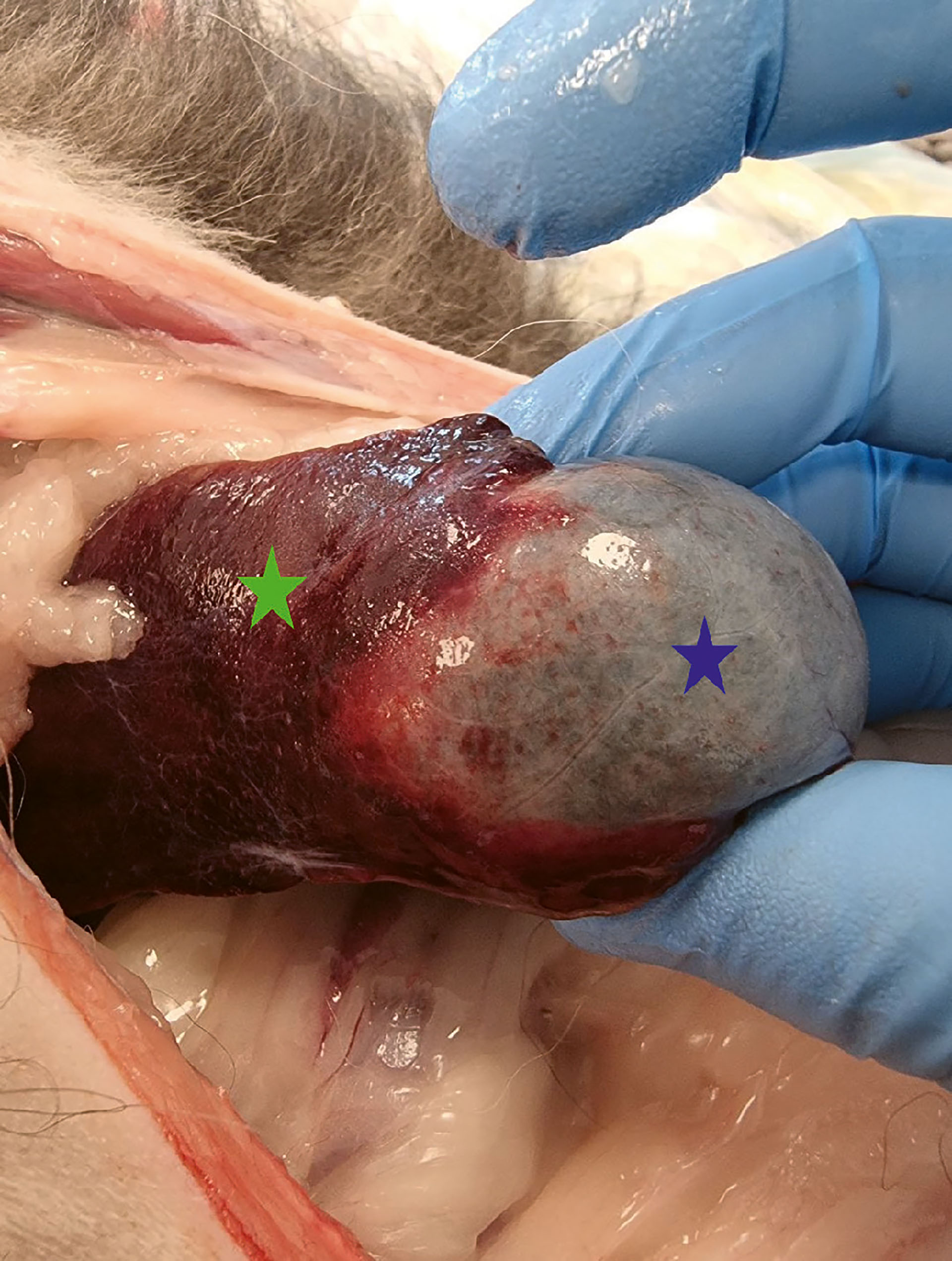
Figur 6. Kasus 1. Ved åpning av buk og visualisering av galleblære og lever ble det funnet makroskopisk patologiske forandringer på lever og galleblære. Det var tydelige petekkiale blødninger på galleblærens serosa. Leveren var helt sammenvokst med galleblæren. Blå stjerne indikerer galleblære. Grønn stjerne indikerer levervev.
Foto: Anja B. Pedersen
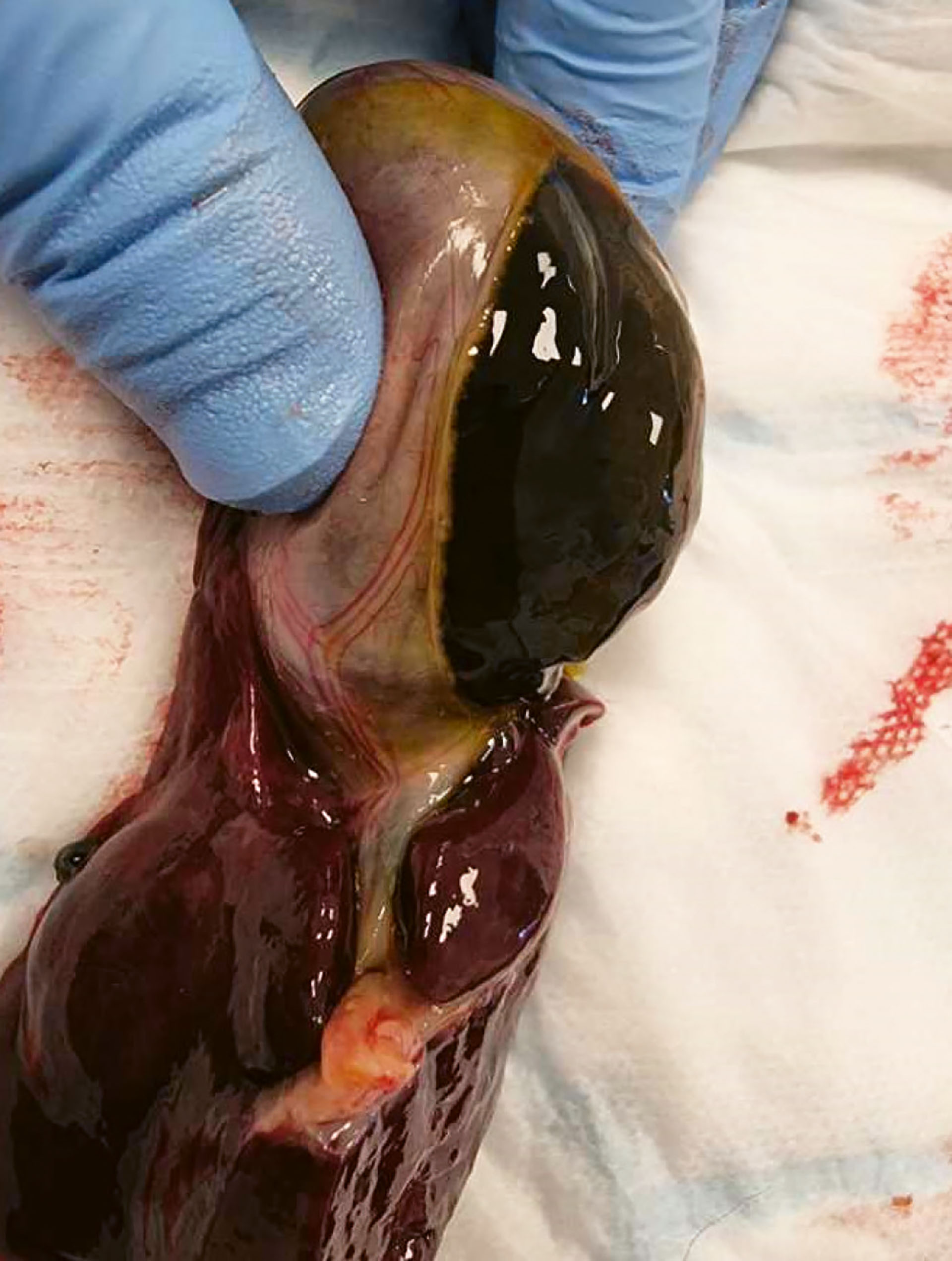
Figur 7. Kasus 1. Åpning av galleblæren viste et unormalt innhold. Innholdet var gelatinøst og vanskelig å løsne fra galleblæreveggen.
Foto: Anja B. Pedersen
Histologisk og cytologisk post mortem diagnose
Det var ingen unormale funn på undersøkelse av levervevet. Det ble funnet en kraftig fortykkelse i galleblærens vegg, og det ble påvist en kronisk hyperplastisk lymfoplasmacyttær kolecystitt. Det ble også påvist høy andel mucin i galleblærens innhold, og innholdet ble klassifisert som forenlig med GBM.
Kasustikk 2
Signalement og anamnese
Miniatyr bullterrier, kastrert hannhund, 6 år, vekt 16 kg. Episoder med oppkast hadde lenge blitt antatt å være forårsaket av allergi og fôrintoleranse. Episodene ble hyppigere, og en utredning av andre mulige årsaker var ønskelig.
Klinisk undersøkelse
Hunden var kvikk og alert. Hunden hadde fuktige, rosa slimhinner med kapillær fyllingstid på < 2 sekunder. Auskultasjon av hjerte og lunger var uten anmerkning. Puls var 120/minutt og respirasjon 20/minutt. Hunden var afebril (Rektal temperatur var 38,2 °C), og det var ingen tegn til palpasjonsømhet i kraniale buk.
Diagnostiske undersøkelser
Det ble tatt blodprøver for hematologiske og biokjemiske analyser uten avvikende resultater. Ultralyd av buk viste at leveren hadde et homogent utseende. Det var ingen endring i ekkogenisitet i levervevet rundt galleblæren. Galleblæren hadde en hyperekkoisk masse som var lite bevegelig og som dekket mer enn 75 % av galleblærens volum. Galleblærens vegg hadde normalt utseende, med en tynn hyperekkoisk linje, uten tegn til fortykkelse. Galleblærens volum ble vurdert til å være forstørret. Den hyperekkoiske massen innerst mot galleblærens vegg var ubevegelig (Figur 8). Ultralyd av øvrige bukorganer var uten anmerkning.
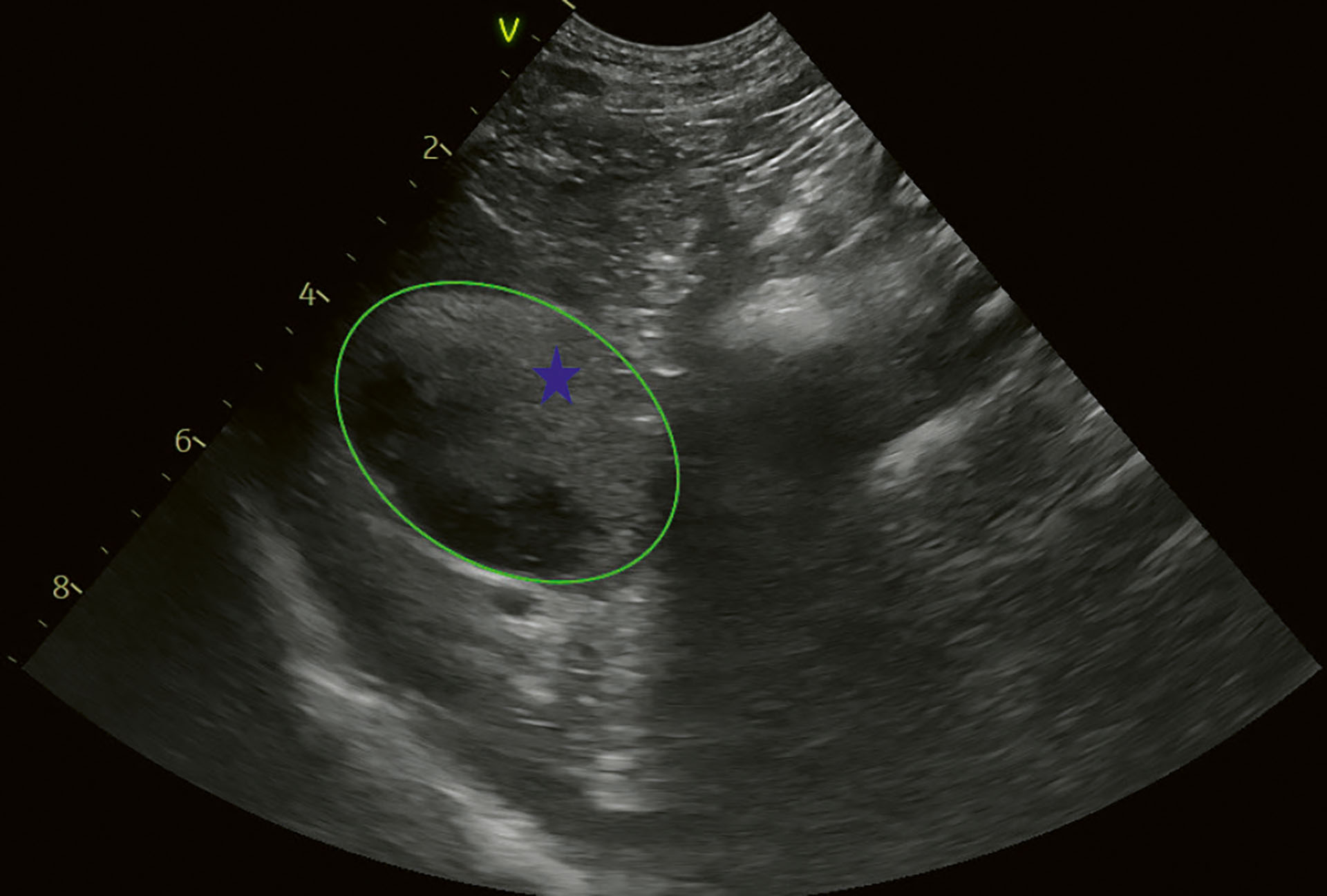
Figur 8. Kasus 2. Tverrsnitt av galleblære. Det er mer enn 75 % av galleblærens volum som er dekket av ekkoisk innhold. Det er delvis mobilt, men innholdet nærmest veggen kunne ikke beveges. Blå stjerne indikerer ekkoisk innhold. Grønn ring indikerer galleblærens kant.
Foto: Anja B. Pedersen
Diagnose basert på ultralyd
Basert på funnene ved ultralydundersøkelsen ble pasienten diagnostisert med GBM grad 1 (7).
Behandling
Denne pasienten ble, basert på funn på ultralyd, gitt ursodeoksykolsyre 12,5 mg/kg SID per os. Oppfølging ble avtalt etter 14 dager.
Videre forløp
Etter 14 dager var det lite endring på hundens allmenntilstand. Den kastet fortsatt opp annenhver dag, og ifølge eier var ikke hunden seg selv. Det var lite endringer å se på ultralydundersøkelsen (Figur 9), og det ble bestemt at hunden skulle henvises til Fredrikstad Dyrehospital for kolecystektomi.
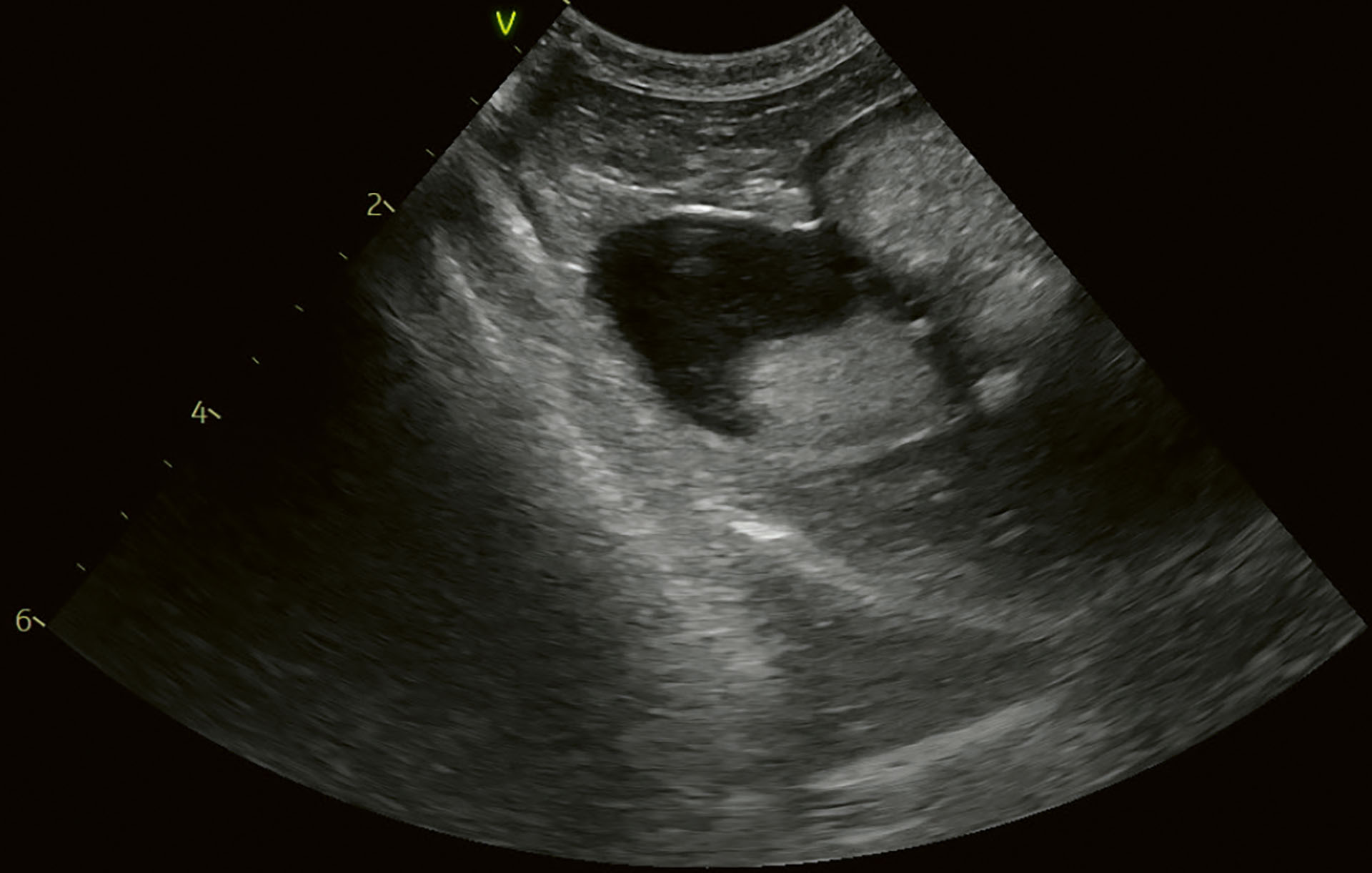
Figur 9. Kasus 2. Lengdesnitt på kontroll etter 14 dager med medisinsk behandling. Innholdet dekket fortsatt store deler av galleblæren, og det var mindre bevegelig.
Foto: Anja B. Pedersen
Operasjon
Hunden ble premedisinert med acepromazin (Plegicil vet inj, 10 mg/mL), metadon (10 mg/mL), Midazolam (0,6 mL midazolam 5 mg/mL injeksjonsvæske Accord Healthcare B.V.). Anestesien ble indusert med propofol 2 mg/kg (Propo vet multidose 10 mg/mL, Zoetis Animal Health ApS). Hunden ble intubert med endotrakealtube, koblet til oksygen og sevofluran på sirkelsystem med oksygen. Anestesien forløp uten anmerkning.
Kolecystektomi ble utført via incisjon i midtlinjen. Deretter ble ligamentum falciforme fjernet og det ble foretatt eksplorativ laparotomi. Det ble ikke gjort funn annet enn forandret galleblære. Adheranser mellom galleblære og lever ble løsnet og galleblæren ble dissekert fri fra lever ved kombinert bruk av fuktet sterile q-tip, metzenbaumsaks og operasjonssug. Ductus cysticus ble identifisert og ligert med bruk av kirurgiske klips. Det ble inspisert etter blødninger og lekkasje av galle før rutinemessig lukking av bukhulen.
Postoperativt forløp var ukomplisert. Det ble gitt 1 mg/kg maropitant (Prevomax injeksjonsvæske 10 mg/mL Dechra Regulatory B.V.) subkutant og paracetamol 10 mg/kg (Paracet 500 mg tablett Karo Pharma AS) per os da pasienten var våken.
Oppfølging og konklusjon
Hunden hadde kort rekonvalesens etter operasjonen, og ved stingfjerning 12 dager postoperativt var hunden tilbake til sitt vante selv. Den hadde ikke hatt oppkast siden operasjonen. Operasjonssåret var tørt og ingen tegn til irritasjon, stingene ble fjernet og eier fikk en opptreningsplan med gradvis økning i aktivitet. Bakteriologisk undersøkelse var negativ. Histopatologisk ble det stilt diagnosen GBM, med en mild kronisk lymfoplasmacytær kolecystitt. Det ble også påvist milde fibrotiske forandringer i veggen og små grus/steiner i galleblærens innhold.
Kasuistikk 3
Signalement og anamnese
Chihuahua, intakt tispe, 7 år, vekt 2,7 kg. Hunden presenterte med anorektiske episoder og sporadisk oppkast. Hunden var generelt småspist, og eier var bekymret når den ikke spiste flere dager i strekk. Den hadde også gått cirka 300 g ned i vekt.
Klinisk undersøkelse
Hunden var kvikk og alert på sine omgivelser. Slimhinnene var blekrosa, normalt fuktige med kapillær fyllingstid på 2 sekunder. Auskultasjon av hjertet var uten anmerkning, og respirasjonen var uanstrengt. Hunden var ikke bukøm ved palpasjon, rektaltemperatur var 38,9 °C.
Diagnostiske undersøkelser
Det ble tatt blodprøver for hematologiske og biokjemiske analyser uten avvikende resultater. På ultralydundersøkelse av bukhulen ble det påvist en galleblære med ekkoisk innhold som var bevegelig, og som lå i den ventrale delen av galleblæren. Ved å bevege pasienten var det tydelig at innholdet også beveget seg. Det var ingen tegn til fortykket galleblærevegg, og det var ingen tegn til forstørret galleblærevolum (Figur 10).
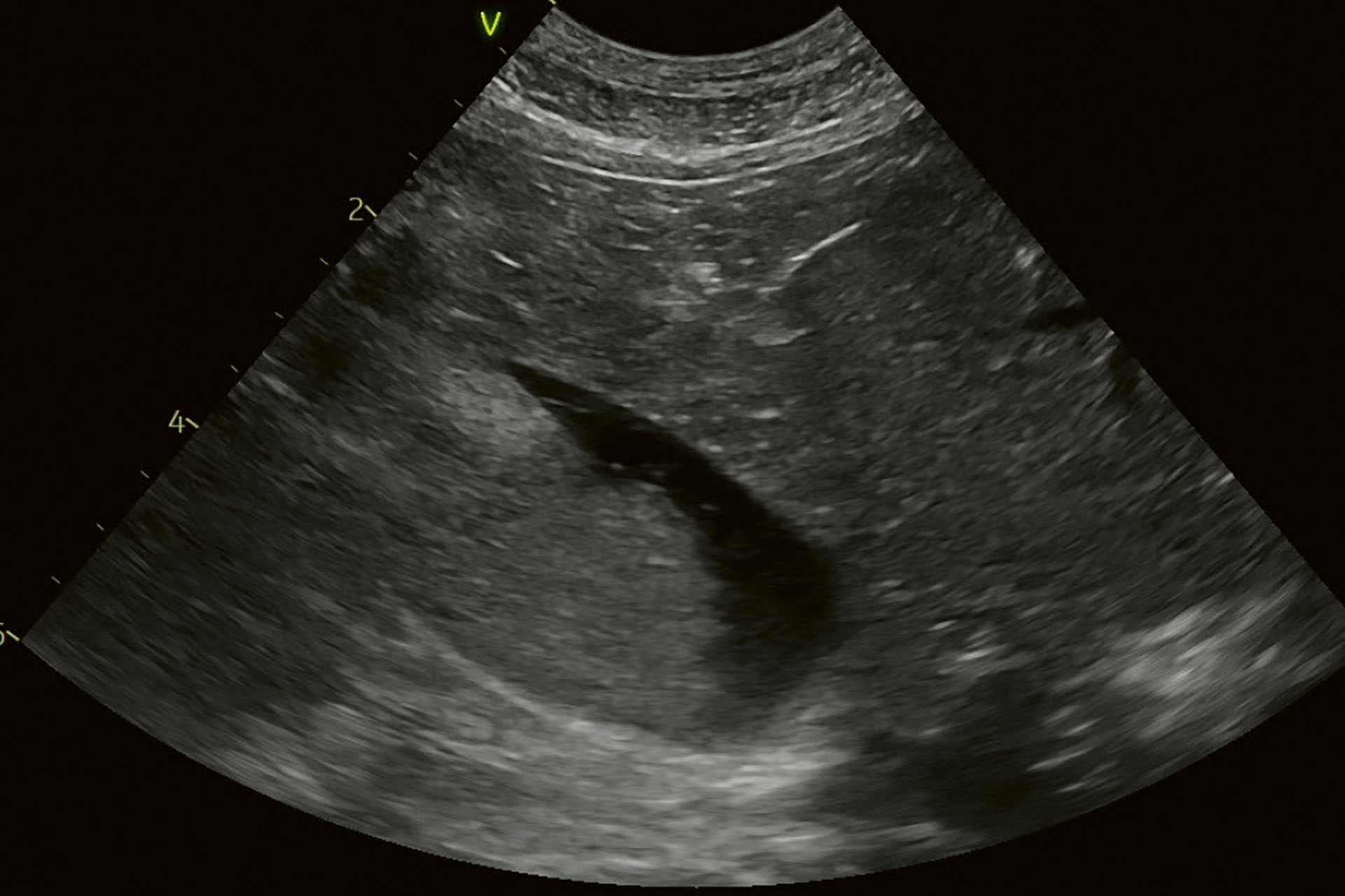
Figur 10. Kasus 3. Galleblære med ekkoisk innhold. Når pasienten ble rotert beveget innholdet seg.
Foto: Anja B. Pedersen
Diagnose basert på ultralyd
GBS, grad 2.
Behandling
Hunden ble satt på Royal Canine gastrointestinal våtfôr og tørrfôr, samt 12,5 mg/kg ursodeoksykolsyre SID per os. Kontroll ble avtalt etter tre måneder.
Videre forløp
På kontroll etter tre måneder var hundens allmenntilstand bedre ifølge eier. Hunden spiste bedre, den hadde økt vekten med 200 g og hadde sluttet å kaste opp. Klinisk undersøkelse viste ingen avvik. Ultralydundersøkelsen viste ingen endringer fra sist (Figur 11). Det ble avtalt videre kontroller hver sjette måned.
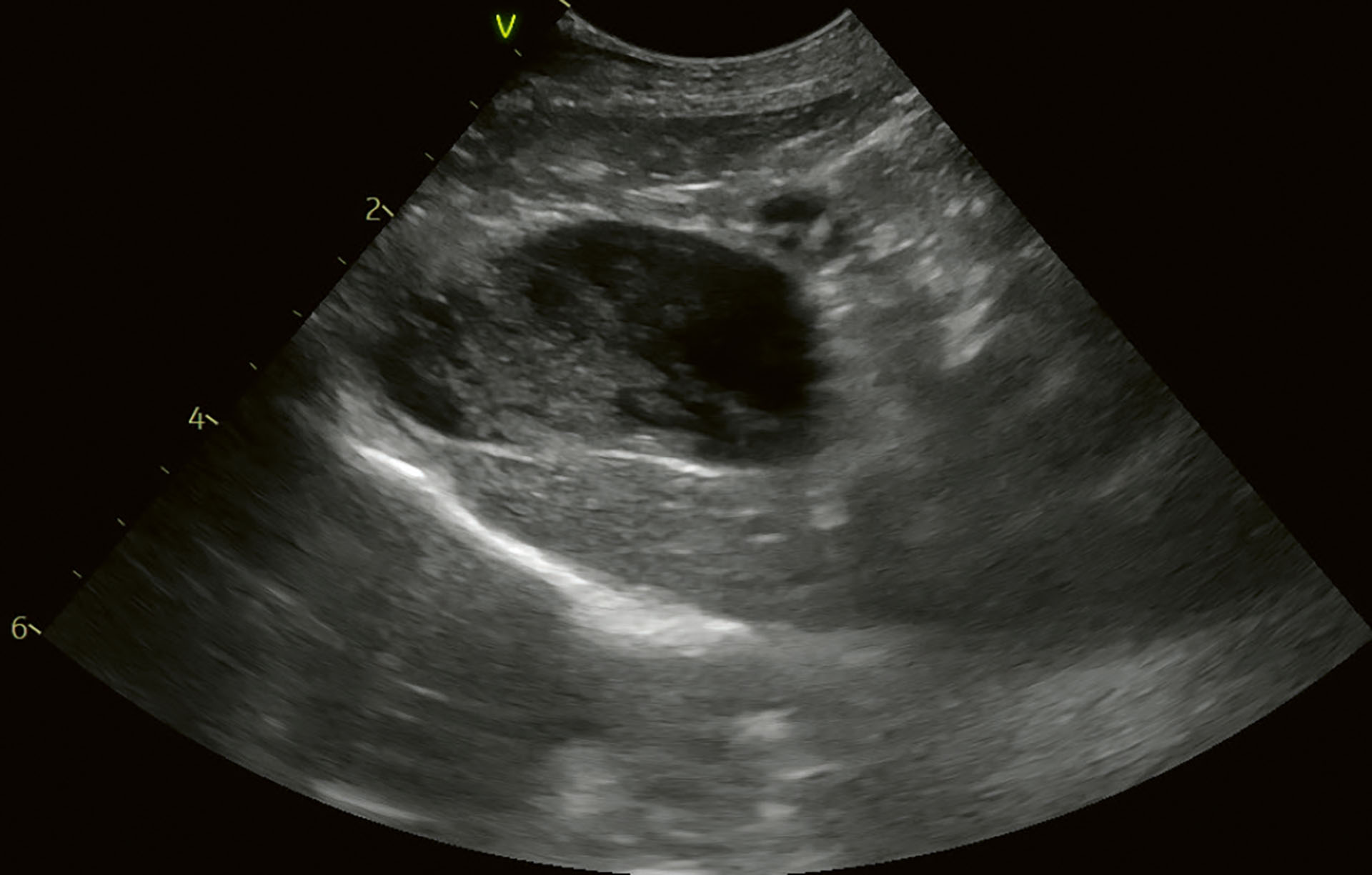
Figur 11. Kasus 3. Kontroll etter tre måneder med medisinsk behandling viste ingen endringer. Innholdet endret posisjon avhengig av hvordan pasienten ble rotert.
Foto: Anja B. Pedersen
Oppfølging og konklusjon
Hunden kom ikke tilbake på kontroll før etter 2 år. Da hadde den igjen gått ned i vekt, og eier var bekymret da hun syntes de kliniske sykdomstegnene var kommet tilbake. Hunden fikk fortsatt 12,5 mg ursodeoksykolsyre (Ursofalk mikstur 50 mg/mL, Dr. Falk Pharma GmbH) SID, og den spiste det samme fôret som før. Hunden hadde på denne presentasjonen moderat mengde tannstein, ellers var den kliniske undersøkelsen uten anmerkninger. Det ble utført hematologiske og biokjemiske analyser uten avvikende resultater. Ultralydundersøkelse av galleblæren på denne presentasjonen var betydelig endret siden sist. Galleblæren virket nå forstørret sammenliknet med tidligere bilder. Sludgen i galleblæren hadde også samlet seg mer, og virket nå mer solid og var mer hyperekkoisk. Den solide massen var fortsatt bevegelig, men endret lite fasong når pasienten ble rotert. Pasienten ble nå diagnostisert med GBS, grad 2 på volum (24,5-49,4 %) og grad 4 på bevegelighet (suspendert sludge) (26). Det ble planlagt oppfølging om to måneder, og dersom tilstanden var lik med uendrete kliniske tegn ble det anbefalt å fjerne galleblæren. Per november 2024 har denne pasienten tilfredsstillende allmenntilstand med medisinsk behandling og eier ønsket ikke operasjon.
Diskusjon
Rasene på de tre kasusene som er beskrevet her samstemmer med raser som er beskrevet predisponert for lidelsen. Alder er litt sprikende. Felles for alle tre var minimalt med kliniske sykdomstegn ved presentasjon og små eller ingen avvik på laboratorieanalyser, noe som stemmer godt overens med beskrivelser i litteraturen (5,7,8,17,24,25). Alle pasientene hadde en historikk med å være «småspist» til tider, og episoder med oppkast som var selvbegrensende. Ingen av pasientene hadde endokrinopatier eller dyslipidemi, noe som er beskrevet for relativt mange av pasientene med GBM (18,22,23).
Kasus 1 ble fulgt opp i nesten 4 år, noe som er en svært lang periode. I denne perioden holdt den seg veldig stabil lenge, og det var ingen store endringer mellom undersøkelsene som ble gjennomført hver 3-6 måned. På siste konsultasjon var det 3 måneder siden siste undersøkelse, og endringene på ultralyd var betydelig. Det er tidligere presentert studier hvor GBS-pasienter er fulgt over 12 måneder, hvor det ikke er funnet bevis for utvikling fra GBS til GBM (26). Det er en annen studie hvor det er beskrevet utvikling fra NDBS til GBM, og her hevdes det at denne prosessen hadde tatt alt fra syv til 36 måneder (29). Dette stemmer godt med denne pasienten, og en mulig grunn til lite bevis for utvikling fra GBS til GBM kan være at studiene er av for kort varighet. I den samme studien fant de også at Shetland sheepdog hadde 40 ganger høyere sannsynlighet for å utvikle GBM enn andre raser i den samme studien. Dette sammen med alt annet som er beskrevet om Shetland sheepdog og denne sykdommen gjør at denne rasen bør monitoreres nøye når først GBS blir oppdaget (11,30).
Diagnosen til kasus 2 ble GBM grad 1 etter klassifiseringen til Choi et al. (7), men kunne like gjerne blitt vurdert til GBS grad 3-4 med bevegelighetsgrad 1 etter klassifiseringen til DeMonaco et al. (26). Det er beskrevet at det er en tvetydig sone mellom siste stadiet av GBS og første grad av GBM (29), og det er et vanskelig skille å vurdere med ultralyd. Kasus 2 hadde en klar GBM diagnose på histopatologi, og de få kliniske tegnene hunden hadde ble borte etter kolecystektomi. Denne pasienten var relativt ung sammenliknet med hva som er beskrevet i litteraturen, og er ikke en rase som er predisponert (1,2,5,8,29,30). Den hadde likevel en velutviklet GBM, med kliniske tegn forenlige med galleblærens patologi. Siden økt alvorlighetsgrad av GBM er assosiert med økt dødelighet (27), så er det desto viktigere å få diagnostisert og laget en behandlingsplan for disse pasientene så tidlig som mulig. Denne pasienten hadde lite kliniske tegn, ingen avvik på standard hematologiske og biokjemiske analyser, men hadde signifikante histopatologiske forandringer i galleblæra, noe som støtter viktigheten av kirurgisk behandling av disse fulle galleblærene på et tidlig tidspunkt.
Kasus 3 var en relativt ung chihuahua da den fikk diagnosen GBS, og det tok i overkant av to år før galleblæren hos denne pasienten ble signifikant endret relatert til sludgets bevegelighet og tetthet og galleblærens totale volum. Denne pasienten illustrerte også en viktig utvikling over de årene pasienten har levd med sykdommen, og den blir derfor fulgt opp tett for å fortløpende vurdere kirurgisk behandling.
Ingen av de tre kasusene som ble presentert her hadde galleblæreruptur, og den ene med kirurgisk behandling hadde ingen komplikasjoner i etterkant av operasjonen. Dette samsvarer godt med beskrivelse av elektive kolecystektomier fra litteraturen (28).
Konklusjon
GBS og GBM medfører få spesifikke kliniske tegn, og lite spesifikke funn, utover ultralydforandringer i galleblæren. GBS er ingen normaltilstand og bør tas alvorlig når det påvises på ultralydundersøkelse. Vi mangler fortsatt studier på dette, men det er mye som tyder på at GBS, via et mellomstadium av NDBS, utvikler seg til GBM over tid, og disse pasientene bør derfor monitores. Med et større søkelys på GBM er det viktig å vurdere tidlig kirurgisk behandling av disse pasientene. Det er flere studier som indikerer lavere mortalitet ved elektiv eller tidlig intervensjon, noe vi bør være tydelig på i kommunikasjonen med eierne. Shetland sheepdog er en rase med stor risiko for å utvikle GBM, og disse pasientene bør følges tett opp.
Sammendrag
GBS er ikke normal variasjon, men en sykdom. Predisponerte raser bør monitorers jevnlig. Endringer i galleblærens volum, veggtykkelse eller bevegelighet bør tas alvorlig, spesielt på rasen Shetland sheepdog, hvor det er stor risiko for utvikling til GBM. Det er en gråsone mellom GBS og GBM som kan være vanskelig å definere på ultralyd. Tidlig kirurgisk behandling av siste stadiet av GBS, eller tidlig GBM, gir bedre overlevelse på lang sikt.
Summary
Biliary sludge is now considered as a disease of the gallbladder and no longer assumed to be a normal variation on ultrasonographic examination. Predisposed breeds should be monitored closely. Changes in gallbladder volume, wall thickness and how the sludges respond to gravity should be taken very seriously, especially in Shetland sheepdogs predisposed for GBM. Early surgical intervention, at late stages of biliary sludge or GBM type 1, gives a better long-term survival.
Referanser
Brömel C, Barthez PY, Léveillé R, Scrivani PV. Prevalence of gallbladder sludge in dogs as assessed by ultrasonography. Vet Radiol Ultrasound 1998;39:206-10.
Besso JG, Wrigley RH, Gliatto JM, Webster CRL. Ultrasonographic appearance and clinical findings in 14 dogs with gallbladder mucocele. Vet Radiol Ultrasound 2000;41:261-71.
Secchi P, Pöppl AG, Ilha A, Kunert Filho HC, Lima FE, García AB et al. Precvalence, risk factors, and biochemical markers in dogs with ultrasound-diagnosed biliary sludge. Res Vet Sci 2012;93:1185-9.
Cook AK, Jambhekar AV, Dylewski AM. Gallbladder sludge in dogs: ultrasonographic and clinical findings in 200 patients. J Am Anim Hosp Assoc 2016;52:125-31.
Crews LJ, Feeney DA, Jessen CR, Rose ND, Matise I. Clinical, ultrasonographic, and laboratory findings associated with gallbladder disease and rupture in dogs: 45 cases (1997-2007). J Am Vet Med Assoc 2009;234:359-66.
Tsukagoshi T, Ohno K, Tsukamoto A, Fukushima K, Takahashi M, Nakashima K et al. Decreased gallbladder emptying in dogs with biliary sludge or gallbladder mucocele. Vet Radiol Ultrasound 2012;53:84-91.
Choi J, Kim A, Keh S, Oh J, Kim H, Yoon J. Comparison between ultrasonographic and clinical findings in 43 dogs with gallbladder mucoceles. Vet Radiol Ultrasound 2014;55:202-7.
Pike FS, Berg J, King NW, Penninck DG, Webster CRL. Gallbladder mucocele in dogs: 30 cases (2000-2002). J Am Vet Med Assoc 2004;224:1615-22.
Mizutani S, Torisu S, Kaneko Y, Yamamoto S, Fujimoto S, Ong BH et al. Retrospective analysis of canine gallbladder contents in biliary sludge and gallbladder mucoceles. J Vet Med Sci 2017;79:366-74.
Kakimoto T, Kanemoto H, Fukushima K, Ohno K, Tsujimoto H. Bile acid composition of gallbladder contents in dogs with gallbladder mucocele and biliary sludge. Am J Vet Res 2017;78:223-9.
Aguirre AL, Center SA, Randolph JF, Yeager AE, Keegan AM, Harvey HJ et al. Gallbladder disease in Shetland Sheepdogs: 38 cases (1995-2005). J Am Vet Med Assoc 2007;231:79-88.
Kook PH, Schellenberg S, Rentsch KM, Reusch CE, Glaus TM. Effects of iatrogenic hypercortisolism on gallbladder sludge formation and biochemical bile constituents in dogs. Vet J 2012;191:225-30.
Mealey KL, Minch JD, White SN, Snekvik KR, Mattoon JS. An insertion mutation in ABCB4 is associated with gallbladder mucocele formation in dogs. Comp Hepatol 2010;9:6.
Viljoen AD, Tamborini A, Watson PJ, Bexfield NH. Clinical characteristics and histology of cholecystectomised dogs with nongravity-dependent biliary sludge: 16 cases (2014-2019). J Small Anim Pract 2021;62:478-88.
Jaffey JA, Graham A, VanEerde E, Hostnik E, Alvarez W, Arango J et al. Gallbladder mucocele: variables associated with outcome and the utility of ultrasonography to identify gallbladder rupture in 219 dogs (2007-2016). J Vet Intern Med 2018;32:195-200.
Allerton F, Swinbourne F, Barker L, Black V, Kathrani A, Tivers M et al. Gall bladder mucoceles in Border terriers. J Vet Intern Med 2018;32:1618-28.
Jaffey JA, Pavlick M, Webster CR, Moore GE, McDaniel KA, Blois SL et al. Effect of clinical signs, endocrinopathies, timing of surgery, hyperlipidemia, and hyperbilirubinemia on outcome in dogs with gallbladder mucocele. Vet J 2019;251:105350.
Mesich MLL, Mayhew PD, Paek M, Holt DE, Brown DC. Gall bladder mucoceles and their association with endocrinopathies in dogs: a retrospective case-control study. J Small Anim Pract 2009;50:630-5.
Friesen SL, Upchurch DA, Hollenbeck DL, Roush JK. Clinical findings for dogs undergoing elective and nonelective cholecystectomies for gall bladder mucoceles. J Small Anim Pract 2021:62:547-53.
Galley M, Lang J, Mitchell M, Fletcher J. Factors affecting survival in 516 dogs that underwent cholecystectomy for the treatment of gallbladder mucocele. Can Vet J 2022;63:63-6.
Gookin JL, Correa MT, Peters A, Malueg A, Mathews KG, Cullen J et al. Association of gallbladder mucocele histologic diagnosis with selected drug use in dogs: a matched case-control study. J Vet Intern Med 2015;29:1464-72.
Kutsunai M, Kanemoto H, Fukushima K, Fujino Y, Ohno K, Tsujimoto H. The association between gall bladder mucoceles and hyperlipidaemia in dogs: a retrospective case control study. Vet J 2014;199:76-9.
Aicher KM, Cullen JM, Seiler GS, Lunn KF, Mathews KG, Gookin JL. Investigation of adrenal and thyroid gland dysfunction in dogs with ultrasonographic diagnosis of gallbladder mucocele formation. PLoS One 2019;14:e0212638.
Malek S, Sinclair E, Hosgood G, Moens NMM, Baily T, Boston SE. Clinical findings and prognostic factors for dogs undergoing cholecystectomy for gall bladder mucocele. Vet Surg 2013;42;418-26.
Worley DR, Hottinger HA, Lawrence HJ. Surgical management of gallbladder mucoceles in dogs: 22 cases (1999-2003). J Am Vet Med Assoc 2004;225:1418-22.
DeMonaco SM, Grant DC, Larson MM, Panciera DL, Leib MS. Spontaneous course of biliary sludge over 12 months in dogs with ultrasonographically identified biliary sludge. J Vet Intern Med 2016;30:771-8.
Parkanzky M, Grimes J, Schmiedt C, Secrest S, Bugbee A. Long-term survival of dogs treated for gallbladder mucocele by cholecystectomy, medical management, or both. J Vet Intern Med 2019;33:2057-66.
Youn G, Waschak MJ, Kunkel KAR, Gerard PD. Outcome of elective cholecystectomy for the treatment of gallbladder disease in dogs. J Am Vet Med Assoc 2018;252:970-5.
Butler T, Bexfield N, Dor C, Fantaconi N, Heinsoo I, Kelly D et al. A multicenter retrospective study assessing progression of biliary sludge in dogs using ultrasonography. J Vet Intern Med 2022;36:976-85.
Jaffey JA, Kreisler R, Shumway K, Lee YJ, Lin CH, Durocher-Babek LL et al. Ultrasonographic patterns, clinical findings, and prognostic variables in dogs from Asia with gallbladder mucocele. J Vet Intern Med 2022;36:565-75.
Saunders H, Thornton LA, Burchell R. Medical and surgical management of gallbladder sludge and mucocoele development in a Miniature Schnauzer. Int J Vet Sci Med 2017;5:75-80.
Ettinger SJ, Feldman EC, Côte E. Textbook of veterinary internal medicine: diseases of the dog and the cat. 8th ed. St.Louis, Missouri: Elsevier, 2017:280,1622.