Lymfoproliferativ sykdom hos katt – plasmacelletumor i blinkhinnen
Sykdomsgruppen lymfoproliferativ sykdom inkluderer lymfoproliferative inflammasjoner og neoplastiske forandringer som lymfom og plasmacytom, men også ikke-neoplastiske lymfoproliferative lesjoner. Til tross for forskjellig prognose kan de ulike diagnosene fremstå svært like ved klinisk, cytologisk og histologisk undersøkelse. Formålet med denne artikkelen er å belyse de kliniske utfordringene som ofte finnes og belyse hvilke nyere diagnostiske muligheter som kan benyttes. Problemstillingen illustreres av et kasus, der flere av de aktuelle diagnostiske metodene ble brukt.
Veterinær. Spesialist i smådyr-sykdommer, hund og katt.
AniCura Dyresykehuset Bergen Sør
Forfatteren har fylt ut ICMJE-skjemaet og oppgir ingen interessekonflikter.
e-post: stina.torvik-pedersen@anicura.no
Veterinær. Spesialist i smådyrsykdommer, hund og katt
Autorisert øyelyser
AniCura Dyresykehuset Bergen Sør
Forfatteren har fylt ut ICMJE-skjemaet og oppgir ingen interessekonflikter.
Veterinær. Spesialist i smådyrsykdommer, hund og katt
Autorisert øyelyser
AniCura Dyresykehuset Bergen Sør
Forfatteren har fylt ut ICMJE-skjemaet og oppgir ingen interessekonflikter.
Veterinær. DipECVP
Idexx Laboratories
Forfatteren har fylt ut ICMJE-skjemaet og oppgir ingen interessekonflikter.
Innledning
Lymfom er en av de vanligste maligne svulstene hos katt (1). I likhet med den humane varianten, er dette en sykdom med varierende symptomer og prognose (2). Sykdommen klassifiseres på forskjellige måter. Histologisk graderes lymfom som høygradig, intermediært eller lavgradig (1). Høy- eller lavgradig lymfom kalles også for stor- eller småcellelymfom og beskriver celledifferensiering.
Anatomisk lokalisering gir også grunnlag for klassifisering. De store gruppene er multisentrisk, mediastinalt, alimentært og ekstranodulært lymfom. Multisentrisk lymfom, som er vanlig forekommende på hund, forekommer også på katt, men er mindre vanlig hos denne arten (3). Immunofenotyping beskriver cellelinjen basert på molekyler uttrykt på cellemembranen. Her er B- og T-celle lymfom de store gruppene. Både prognose og behandling er basert på denne klassifiseringen.
Plasmacytom eller myelomrelatert sykdom, er en annen undergruppe av lymfoproliferativ sykdom (4). Plasmaceller er fullt differensierte B-celler som produserer og utskiller antistoffer. Hos hund og katt grupperes plasmacytomer i 5 grupper: 1) multiple myelomer, 2) kutant og 3) ikke-kutant ekstramedullært plasmacytom, 4) solitært plasmacytom i ben og 5) ekstramedullært plasmacytom (EMP). Diagnostiske kriterier inkluderer hyperglobulinemi, osteolytiske lesjoner, Bence-Jones proteinuri, paraproteinemi og høy andel plasmaceller i benmargen (over 20 %). Hos hund skal minst to av disse kriteriene være til stede for at diagnosen kan stilles. Hos katt kan ikke alltid diagnosen stilles med samme kriterier og osteolytiske lesjoner er uvanlig (5). Den neoplastiske transformasjonen hos hund sitter ofte i beinmargen, men nyere studier på katt (6) viser at primær ekstramedullær neoplastisk transformasjon er vanligere.
Lymfoproliferativ inflammasjon er en ikke-neoplastisk forandring. I motsetning til de neoplastiske sykdommene er prognosen ofte god.
Diagnostikk
Diagnostikk av lymfoproliferativ sykdom har tradisjonelt vært basert på morfologiske karakteristika identifisert ved cytologi og histologi. Den senere tid har supplerende analysemetoder som PARR (PCR for Antigen Receptor Rearrangements), IHC/ICC (Immunohistochemistry/immunocytochemistry) og FC (Flowcytometri) blitt tilgjengelig. Alene eller i kombinasjon kan de gi verdifull informasjon om diagnose, fenotype og prognose.
Cytologi
Cytologi er lite invasivt, kostnadseffektivt og informativt. Ulempen, sammenlignet med histologi, er mangel på informasjon om vevets struktur. Lymfeceller bedømmes ut ifra kriterier basert på cellestørrelse, nukleus og cytoplasma. Typisk cytologisk presentasjon av ikke-reaktive lymfeceller er små, veldifferensierte lymfocytter. Nukleus er rund, og størrelsen på cellen er 1-1,5 x størrelsen av en erytrocytt. Kromatinet i nukleus er tettpakket og nukleoler er ikke synlige. Nukleus/cytoplasma ratioen er høy, med en smal kant med basofilt cytoplasma. Større umodne lymfeceller, lymfoblaster, er til stede i friskt og reaktivt lymfevev. De har en nukleus som er 1,5-3 x størrelsen av en erytrocytt og en total størrelse fra 1 x størrelsen av en nøytrofil granulocytt til 4 x størrelsen av en erytrocytt. Kromatinet er mindre tettpakket og nukleoler er ofte synlige. Cytoplasmaet er lyseblått og inntar større volum sammenlignet med små lymfocytter (4).
Å skille reaktiv hyperplasi fra lymfom kan være utfordrende, spesielt hos katt. Typisk karakteristikk for lymfom hos hund er en monomorf cellepopulasjon uten den heterogene cellepopulasjonen vi vanligvis ser i reaktivt lymfevev(4).
Lymfom hos katt har derimot ofte en heterogen populasjon med store og små lymfocytter, plasmaceller og makrofager, og kan derfor lett forveksles med reaktiv hyperplasi. En annen faktor som kompliserer diagnostikken hos katt er at lymfom ofte rammer indre organer som mage/tarm, nyre, thymus og lever. Dette gjør prøvetakingen til cytologi mer utfordrende enn hos hund hvor lymfom oftere finnes i perifere lymfeknuter.
Histologi
Mange av de samme kriteriene blir undersøkt som ved cytologi, men histologi har fordelen av at også vevets struktur og cellefordeling kan visualiseres og vurderes.
PARR
For at lymfocytter skal gjenkjenne kroppsfremmede stoffer, må de utvikle antigenreseptorer (AgR) som kan reagere på en stor variasjon av antigener. For T-celler er dette T-celle reseptorer (TCR), og for B-celler er dette immunglobulin reseptorer. Genene som koder for cellenes AgR er delt opp i mindre sekvenser. Disse kombineres til celleunike varianter og lager et molekylært «fingeravtrykk». Dette skjer under modningsprosessen i beinmarg eller thymus for B- og T-celler respektivt, og kalles for antigenreseptor omorganisering.
Når en lymfocytt gjennomgår normal mitotisk aktivitet, blir dattercellene kloner med identisk gensammensetning og med samme AgR som morcellen. Hos et friskt individ er det relativt få kloner i en cellepopulasjon, mens ved malign lymfoid sykdom finner man en patologisk økning i antall kloner. PARR benytter seg av primere som binder seg til cellenes unike overflatemolekyl, slik at kloner kan bli identifisert. En fordel med PARR er at metoden kan brukes på væsker, blod, fargede- og ikkefargede cytologiske utstryk og formalinfikserte vevsprøver og er derfor en praktisk løsning ettersom ferske prøver ikke alltid er tilgjengelig (7). Ulempen er sensitiviteten til markørene. Ideelt sett hadde primere kjent igjen alle mulige kombinasjoner av gensekvenser slik at alle typer av kloner kunne fanges opp, men dette er dessverre ikke realiteten. Hos hund oppdager PARR 75-80 % av lymfom- og leukemidiagnoser, mens andelen hos katt ligger på 60-65 % (2). Dette er nok en faktor som kompliserer diagnostikken hos katt. Falske positive forekommer som resultat av oligo- eller monoklonale lymfocyttpopulasjoner og kan skyldes kroniske infeksjoner som for eksempel ehrlichiose. Av denne grunn bør PARR alltid vurderes sammen med anamnese, kliniske symptomer, cytologi/histologi og i noen tilfeller, resultater fra IHC/ICC og FC (2).
IHC/ICC
IHC baserer seg på antistoffer som bindes til unike antigener på cellemembranen i vevsprøver. Både ferske, frosne og formalinfikserte vevsprøver kan brukes. En studie fra 2005 (8) viste at IHC avkreftet lymfomdiagnosen hos 5 katter som tidligere hadde fått diagnosen basert på histologisk vurdering.
ICC baserer seg på antistoffer som er festet til en markør som synliggjør cellene med korrelerende antigener i cytologiske utstryk. En slik markør kan være et enzym eller fluorescerende molekyler. Det er mulig å bruke både ufargede og fargede cytologiske utstryk.
FC
Flowcytometri (FC) baseres på antistoffer som bindes til lymfocyttenes unike «cluster of differentiation» (CD) molekyl. Dette molekylet er en markør på et overflateprotein og danner et fenotypisk system for klassifisering. FC utføres i sin enkleste form som en del av en hematologisk analyse, der cellene passerer gjennom en laserstråle og størrelsen registreres basert på reflektert lys. Mer kompleks FC kan også registrere cellenes CD-molekyler og dermed bidra til fenotyping. Det benyttes antistoffer konjugert med fluorescerende molekyler som bindes til CD-molekylet. Når komplekset passerer laserstrålen, øker energinivået i det fluorescerende molekylet og lys avgis. Dette registres, slik at cellene som antistoffene er festet til telles, og gir en kvantitativ analyse av de patologiske cellene. For å kunne utføre FC behøves levende celler i væske, følgelig kan både blod og andre kroppsvæsker analyseres, samt celler fra finnålsaspirat (FNA) så lenge de transporters i et egnet transportmedium. Siden FNA gir nok materiale for analyse, er dette en metode som er rask, sikker og lite invasiv (9). Prøven skal være kald, men ikke frossen. Lang tid mellom prøvetaking og analyse resulterer i nedbrytning av celler og frafall av markører, derfor er 3 dager en grense for lagringstid før analyse. Studier på hund har vist at FC er en mer sensitiv analyse enn PARR og IHC for lymfom (10). En studie fra 2016, støtter at dette også er tilfelle hos katt (11).
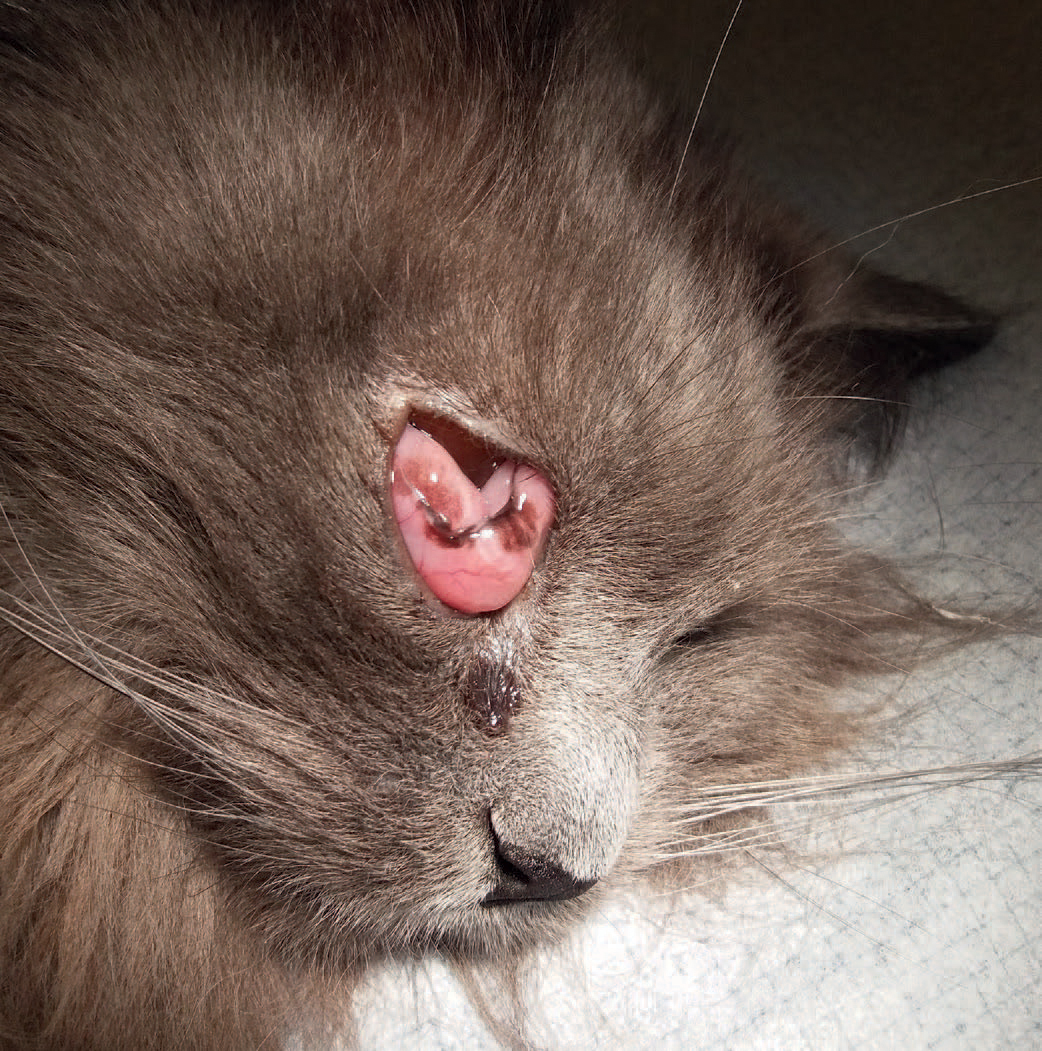
Figur 1. Blinkhinnen ble fjernet kirurgisk under operasjonsmikroskop
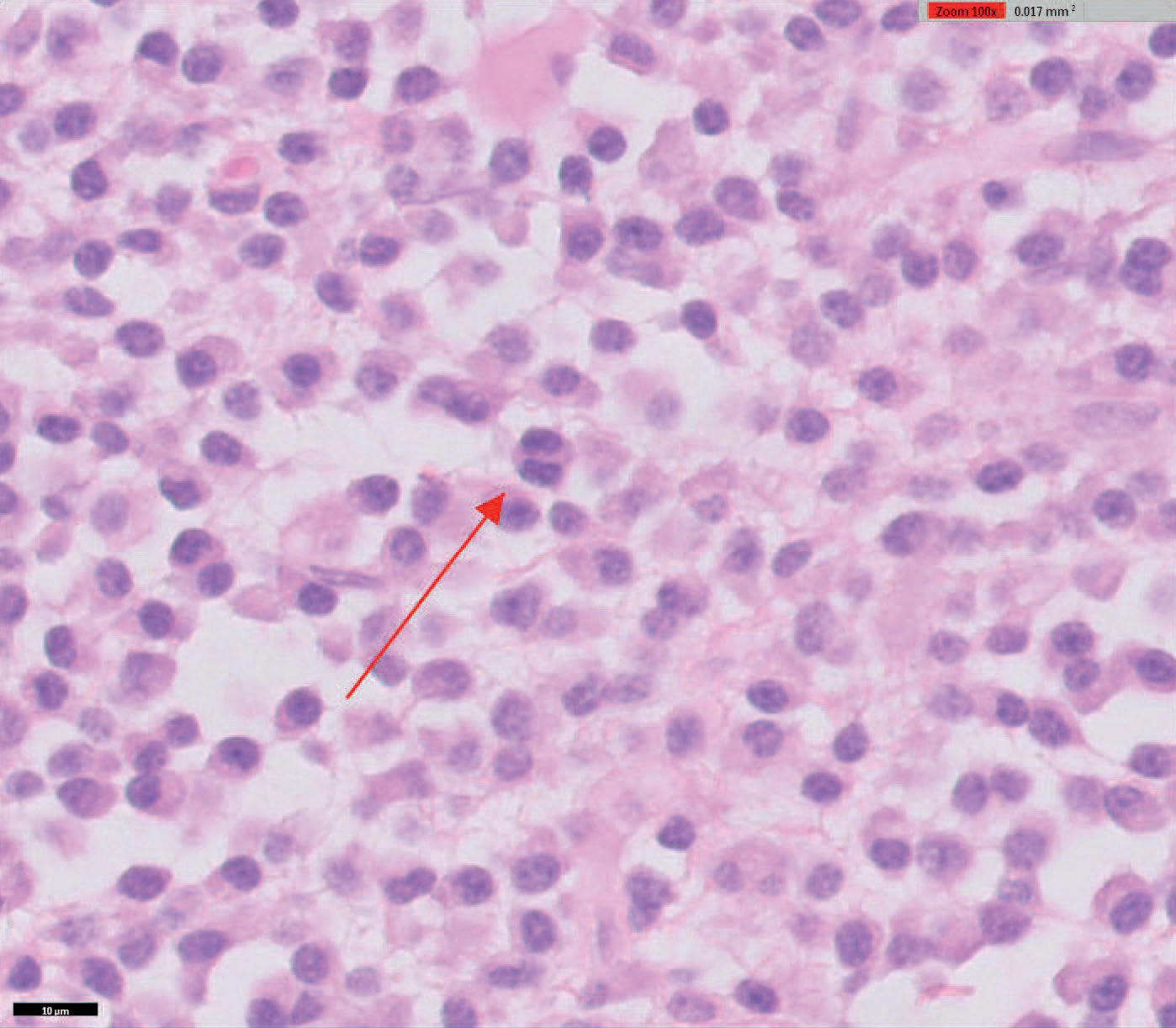
Figur 2 Histologisk analyse viste en monomorf rundcellepopulasjon med kollagenrikt stroma. Neoplastiske runde celler viste moderat til høy nukleus- til cytoplasmatisk ratio. Små mengder blekt, granulært cytoplasma, runde hyperkromatiske kjerner med en diameter på cirka 1,5 x diameteren til en rød blodcelle. Sparsomt med mitotisk aktivitet.
Kasuistikk
Anamnese
En 11 år gammel huskatt ble henvist til videre utredning grunnet en persisterende prolabert blinkhinne. Eier hadde observert symptomet under flere måneder. Finnålsaspirat til cytologi hadde blitt tatt på henvisende klinikk, og denne hadde vist en lymfoproliferativ reaksjon. Monoterapi i form av topikal fusidinsyre, kloramfenikol, deksametason og ciklosporin hadde blitt gitt respektivt, med behandlingsvarighet fra 7 til 14 dager, uten effekt. Katten hadde 3 år tidligere blitt diagnostisert med FIV.
Klinisk undersøkelse
Ved klinisk undersøkelse var katten i god allmenntilstand. Øyeundersøkelse viste fremfall, hevelse og erytem på begge sider av høyre blinkhinne og en noe ujevn overflate. Cornea og sclera var uten patologiske funn. Det ble avtalt å utføre histologisk undersøkelse, da hevelsen i blinkhinnen hadde vokst til tross for medisinsk behandling. Hematologiske og standard biokjemiske analyser i blodet var innenfor normale referanseintervaller.
Kirurgisk fjerning av blinkhinnen
Blinkhinnen ble fjernet kirurgisk under operasjonsmikroskop (Figur 1).
Inngrepet ble utført under generell anestesi uten komplikasjoner. Blinkhinnen ble i sin helhet lagt i formalin og sendt til histologisk analyse hos IDEXX Laboratories Inc. Tre måneder postoperativt var pasientens allmenntilstand god uten tegn til residiv.
Diagnostikk
Histologisk undersøkelse av blinkhinneforandringene viste en tett cellulær, monomorf, neoplastisk populasjon med rundceller. Sammensatt av tettpakkete lag, separert av tynt kollagen med fibrovaskulært stroma. Nukleus/cytoplasma ratio ble beskrevet som høy, med liten mengde eosinofilt granulært cytoplasma. Hyperkromatiske kjerner, som hadde en diameter på 1,5 x av en rød blodcelle (RBC). Mild til moderat anisocytose/anisokaryose. De neoplastiske cellene fortsatte forbi den fargede marginen og komplett fjerning kunne derfor ikke garanteres.
Den histologiske diagnosen ble vurdert til monomorf, rundcelle-populasjon, med antydning av lymfo-proliferativ lesjon, mulig lymfom (Figur 2). For å verifisere diagnosen ble det ordinert en PARR analyse. PARR viste polyklonal BCR (B celle reseptor) genomorganisering og oligoklonal TCR (T celle reseptor) genomorganisering ikke forenlig med neoplasi. IHC ble rekvirert for å bekrefte den tentative diagnosen, lymfoproliferativ inflammasjon. Denne viste en plasmacelle dominant populasjon, med ektramedullært plasmacytom som en mulig diagnose. Pasienten viste fortsatt god allmenntilstand og videre behandling var ikke indisert (Figur 3).
Diskusjon
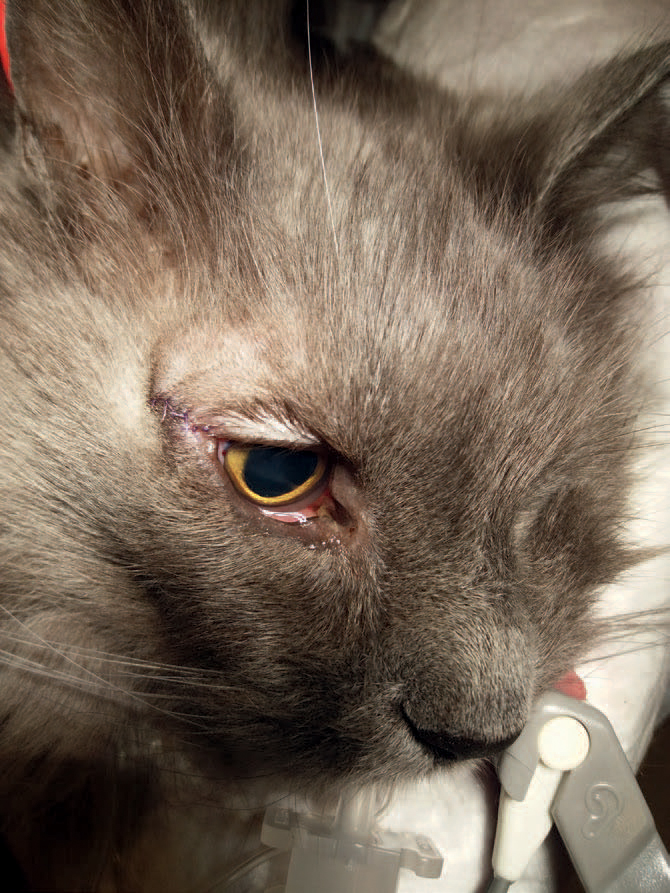
Figur 3. Postoperativt viste katten god allmenntilstand
I dette tilfellet ble biopsien analysert med både histologisk, PARR og IHC analyse. Dette ble gjort for å se om samme svulst ble vurdert forskjellig med de ulike metodene. Med kun histologi hadde sannsynligvis konklusjonen blitt «mulig lymfom». Hvordan en mulig kreftdiagnose hadde påvirket eiers ønske om videre behandling ved eventuelle fremtidige helseplager kan man kun spekulere i, men det hadde neppe vært en positiv faktor. I verste fall hadde det kunnet resultere i en forhastet eutanasi. I en studie (8) fikk 5 av 32 katter avkreftet sin histologisk bestemte lymfomdiagnose med IHC. Lymfom diagnose skal derfor alltid vurderes sammen med det helhetlige kliniske bildet og gjerne med flere analysemetoder.
Til tross for omfattende diagnostikk i dette tilfellet, var det fortsatt usikkerhet ved diagnosen. Det naturlige spørsmålet blir derfor om vi hadde kunnet gjøre noe annerledes for å sikre diagnosen. Et alternativ kunne vært aspirasjon av celler fra blinkhinnen analysert med FC. FC ville gitt supplerende informasjon. Andre metoder som kunne vært benyttet er bildediagnostikk i form av røntgen, CT og MR for å visualisere mulige metastaser og invasiv vekst. Eier fikk tilbud om dette, men ønsket ikke videre undersøkelse da kattens allmenntilstand var god.
Utfordringene vi hadde i dette tilfellet kan sammenlignes med IBD (Inflammatory Bowel Disease)/LGAL (low grade alimentary lymphoma) hos katt. Også her kan den histologiske undersøkelsen være utilstrekkelig. En interessant forskjell er at IBD og LGAL har en lignende klinisk presentasjon, prognose og behandling, noe som ikke er tilfelle her. Lymfom i blinkhinnen, som var mistanken for dette kasuset, er en uvanlig sykdom hos katt (12). Studier på mennesker har vist at konjunktivalt lymfom har bedre prognose enn andre okulære lymfomer, hvor 31 % av de rammede utvikler systemisk lymfom (13). EMP hos katt sees ofte i gastrointestinal kanalen med en overrepresentasjon kolorektalt. Også milt, lever, lunge og øsofagus kan rammes. Tradisjonelt har det blitt antatt at plasmacelletumor hos katt følger samme modell som hos mennesker (5), basert på antagelsen om at plasmaceller gjennomgår neoplastisk transformasjon primært i beinmargen og at de deretter metastaserer til ekstramedullært vev. Studier på katt (6) viser imidlertid at primær ekstramedulær neoplastisk transformasjon er vanligere, noe som kan være tilfelle hos denne pasienten.
FIV-diagnosen hos denne pasienten var en faktor som rettet mistanken mot en lymfomdiagnose ettersom retrovirus (FeLV og i mindre grad FIV) er en kjent predisponerende faktor. Lymfom som utvikles hos FeLV positive katter, sees som regel hos yngre individer og er ofte lokaliserte til mediastinum og CNS (1). I land hvor vaksine mot FeLV er vanlig, har denne typen blitt mindre frekvent de senere årene (14). Til tross for dette har prevalensen av lymfom fortsatt vært høy, noe som delvis kan skyldes FIV (15). SCAL (Small Cell Alimentary Lymphoma) er den vanligst forekommende typen i den FeLV-negative gruppen, og sees mest hos eldre dyr. Den kliniske presentasjonen varierer, men ofte er symptomene generelle, som anoreksi, vekttap og apati.
Plasmocytom i blinkhinnen er en uvanlig diagnose. På hund er dette beskrevet (16), men forfatterne er ikke kjent med at dette er dokumentert på katt. Siden diagnosen først ble satt etter at prøven ble analysert med histologi, PARR og IHC, kan det spekuleres i om det er en underdiagnostisert sykdom.
Sannsynligvis tar det tid innen de diagnostiske testene ved lymfoproliferativ sykdom hos katt blir så bra at sikre svar kan gis i alle tilfeller. Frem til da må man vurdere det helhetlige bildet og tolke prøvesvar med varsomhet.
Sammendrag
Lymfoproliferative sykdommer omfatter inflammatoriske og neoplastiske prosesser utgått fra lymfocytter og plasmaceller. Sykdommene kan være vanskelige å skille basert på klinisk bilde og diagnostiske metoder som cytologi og histologi. Behandling og prognose er forskjellige, og en korrekt diagnose er derfor viktig. De siste årene har det kommet flere nye teknikker som kan bidra til forbedret diagnostikk. Denne artikkelen gir først en kort innføring i og klassifisering av de forskjellige lymfoproliferative sykdommene hos katt og deretter en presentasjon av aktuelle diagnostiske hjelpemidler som cytologi, histologi, PARR (polymerase chain reaction for antigen reseptor omorganisering), IHC (immunhistokjemi) og FC (flowcytometri). Deretter presenteres et kasus av en katt med plasmacytom i blinkhinnen som illustrerer hvor vanskelig det kan være å stille en nøyaktig diagnose av lymfoproliferativ sykdom selv ved bruk av flere av de overnevnte diagnostiske metodene.
Summary
Lymphoproliferative diseases include inflammatory and neoplastic processes arising from lymphocytes and plasma cells. Based on the clinical presentation and traditional diagnostic methods such as cytology and histology, the differentiation between the different disease entities can be challenging. The treatment depends on the diagnosis and can affect the patients prognosis severely. Recently, several new techniques have been developed that can aid the diagnostic process. This article first gives an introduction to and classification of the lymphoproliferative diseases in domestic cats, and then a presentation of the diagnostic tests cytology, histology, polymerase chain reaction for antigen receptor rearrangement (PARR), Immunohistochemistry (IHC) and flow cytometry (FC). A case of a cat with plasmacytoma in the nictitating membrane then illustrates how challenging it can be to come to a definite diagnosis of lymphoproliferative diseases even when several of the mentioned diagnostic tests are utilized.
Referanser
Vail DM. Hematopoietic tumors. I: Ettinger SJ, Feldman EC, Côté E, eds. Textbook of veterinary internal medicine: diseases of the dog and cat. 8th ed. St. Louis, Missouri: Saunders Elsevier, 2016:2065-78.
Burkhard MJ, Bienzle D. Making sense of lymphoma diagnostics in small animal patients. Vet Clin North Am Small Anim Pract 2013;43: 1331-47.
Ettinger SN. Principles of treatment for feline lymphoma. Clin Tech Small Anim Pract 2003;18:98-102.
Jacocks K, Hoepp N, DeNicola DB. Round cells. I: Valenciano AC, Cowell RL, eds. Cowell and Tyler’s diagnostic cytology and hematology of the dog and cat. 5th ed. St. Louis, Missouri: Saunders Elsevier, 2020:65-74.
Mellor PJ, Haugland S, Murphy S, Smith KC, Holloway A, Archer J et al. Myeloma-related disorders in cats commonly present as extramedullary neoplasms in contrast to myeloma in human patients: 24 cases with clinical follow-up. J Vet Intern Med 2006;20:1376-83.
Mellor PJ, Haugland S, Smith KC, Powell RM, Archer J, Scase TJ et al. Histopathologic, immunohistochemical, and cytologic analysis of feline myeloma-related disorders: further evidence for primary extramedullary development in the cat. Vet Pathol 2008;45:159-73.
Moore PF, Vernau W, Leutenegger CM, Cornwell D. Molecular methods in lymphoid malignancies. I: Valenciano AC, Cowell RL, eds. Cowell and Tyler’s diagnostic cytology and hematology of the dog and cat. 5th ed. St. Louis, Missouri: Saunders Elsevier, 2020: 531-8.
Waly NE, Gruffydd-Jones TJ, Stokes CR, Day MJ. Immunohistochemical diagnosis of alimentary lymphomas and severe intestinal inflammation in cats. J Comp Pathol 2005;133:253-60.
Martini V, Bernardi S, Marelli P, Cozzi M, Comazzi S. Flow cytometry for feline lymphoma: a retrospective study regarding pre-analytical factors possibly affecting the quality of samples. J Feline Med Surg 2018;20:494-501.
Thalheim L, Williams LE, Borst LB, Folge JE, Suter SE. Lymphoma immunophenotype of dogs determined by immunohistochemistry, flow cytometry, and polymerase chain reaction for antigen receptor rearrangements. J Vet Intern Med 2013;27:1509-16.
Guzera M, Cian F, Leo C, Winnicka A, Archer J. The use of flow cytometry for immunophenotyping lymphoproliferative disorders in cats: a retrospective study of 19 cases. Vet Comp Oncol 2016;14(Suppl 1):40-51.
Radi ZA, Miller DL, Hines ME. B-cell conjunctival lymphoma in a cat. Vet Ophthalmol 2004;7:413-5.
Shields CL, Shields JA, Carvalho C, Rundle P, Smith AF. Conjunctival lymphoid tumors: clinical analysis of 117 cases and relationship to systemic lymphoma. Ophthalmology 2001;108:979-84.
Louwerens M, London CA, Pedersen NC, Lyons LA. Feline lymphoma in the post-feline leukemia virus era. J Vet Intern Med 2005;19:329-35.
Beatty J. Viral causes of feline lymphoma: retroviruses and beyond. Vet J 2014;201:174-80.
Perlmann E, Dagli MLZ, Martins MC, Siqueira SAC, Barros PSM. Extramedullary plasmacytoma of the third eyelid gland in a dog. Vet Ophthalmol 2009;12:102-5.