Mykobakteriose hos fisk
Veterinærpatolog ved Pharmaq Analytiq
Europeisk spesialist i veterinærpatologi, DipECVP
Veterinærpatolog ved Pharmaq Analytiq
Europeisk spesialist i veterinærpatologi, DipECVP
Veterinærpatolog ved Pharmaq Analytiq
Veterinærpatolog ved Pharmaq Analytiq
Innledning
Mykobakteriose hos fisk er en gruppe infeksiøse, systemiske sykdommer med et bredt spekter av mottakelige arter i ferskvann, brakkvann og saltvann. Sykdommen forårsakes av mykobakterier som er gram positive, syre-faste staver og naturlig forekommende nedbrytere i jord og vann (1). Det finnes minst 20 arter som gir sykdom hos fisk, men Mycobacterium marinum, M. chelonae, M. fortuitum, M. abscessus og M. salmoniphilum er de mest kjente fiskepatogene artene (1, 2). Forløpet er som regel kronisk med avmagring, hudlesjoner og granulomer i indre organer. Det er også beskrevet en akutt sykdomsform karakterisert av store bakterieansamlinger i blodkar og indre organer. Dødeligheten er varierende (3). Smitteveiene er ikke fullstendig forstått, men mest sannsynlig skjer smitten via kontaminert fôr, inntak av infisert død fisk eller bakterieholdige partikler i vannmassene, sår/skader i huden eller via ektoparasitter. Vertikal smitte er også beskrevet for noen arter av mykobakterier (3).
Patologi og diagnostikk
Tradisjonelt er slekten Mycobacterium delt inn i to hovedgrupper: Mycobacterium tuberculosis-komplekset som rommer arter som gir tuberkulose hos pattedyr, og ikke-tuberkuløse mykobakterier («non-tuberculous mycobacteria», NTM) hvor vi blant annet finner artene som kan gi sykdom hos fisk (3).
Infeksjon med mykobakterier hos pattedyr gir som regel en kronisk, granulomatøs betennelsesrespons dominert av histiocytære celler i ulike varianter: makrofager, epiteloide (aktiverte) makrofager og flerkjernede kjempeceller. I tillegg finnes ofte lymfocytter og plasmaceller.
Granulom er definert som et velavgrenset område med granulomatøs betennelse (4), og brukes hovedsakelig om knutene som dannes ved tuberkuloid type granulomatøs betennelse. Granulomer er ovale til runde og varierer i størrelse fra mikroskopiske til store, makroskopiske knuter. Histologisk ses ofte et sentralt nekrotisk område omgitt av makrofager, eventuelt fler-kjernede kjempeceller, lymfocytter og plasmaceller. Ytterst danner fibroblaster en fibrøs kapsel av kollagen og ekstracellulær matriks slik at avgrensing fra det øvrige vevet blir tydelig (5). Noen viktige eksempler på mykobakterieinfeksjoner kjent fra landdyr og mennesker er vist i Tabell 1.
Agens |
Sykdomsnavn |
Typisk manifestasjon |
Hovedvert |
|---|---|---|---|
Mycobacterium tuberculosis |
Tuberkulose |
Tuberkuloid |
Mennesker |
Mycobacterium leprae |
Lepra/spedalskhet |
Lepromatøs og tuberkuloid |
Mennesker |
Mycobacterium bovis |
Storfetuberkulose |
Tuberkuloid |
Storfe |
Mycobacterium avium ssp. paratuberkulosis |
Paratuberkulose |
Lepromatøs |
Drøvtyggere |
Th1-mediert immunrespons vs. Th2-mediert immunrespons
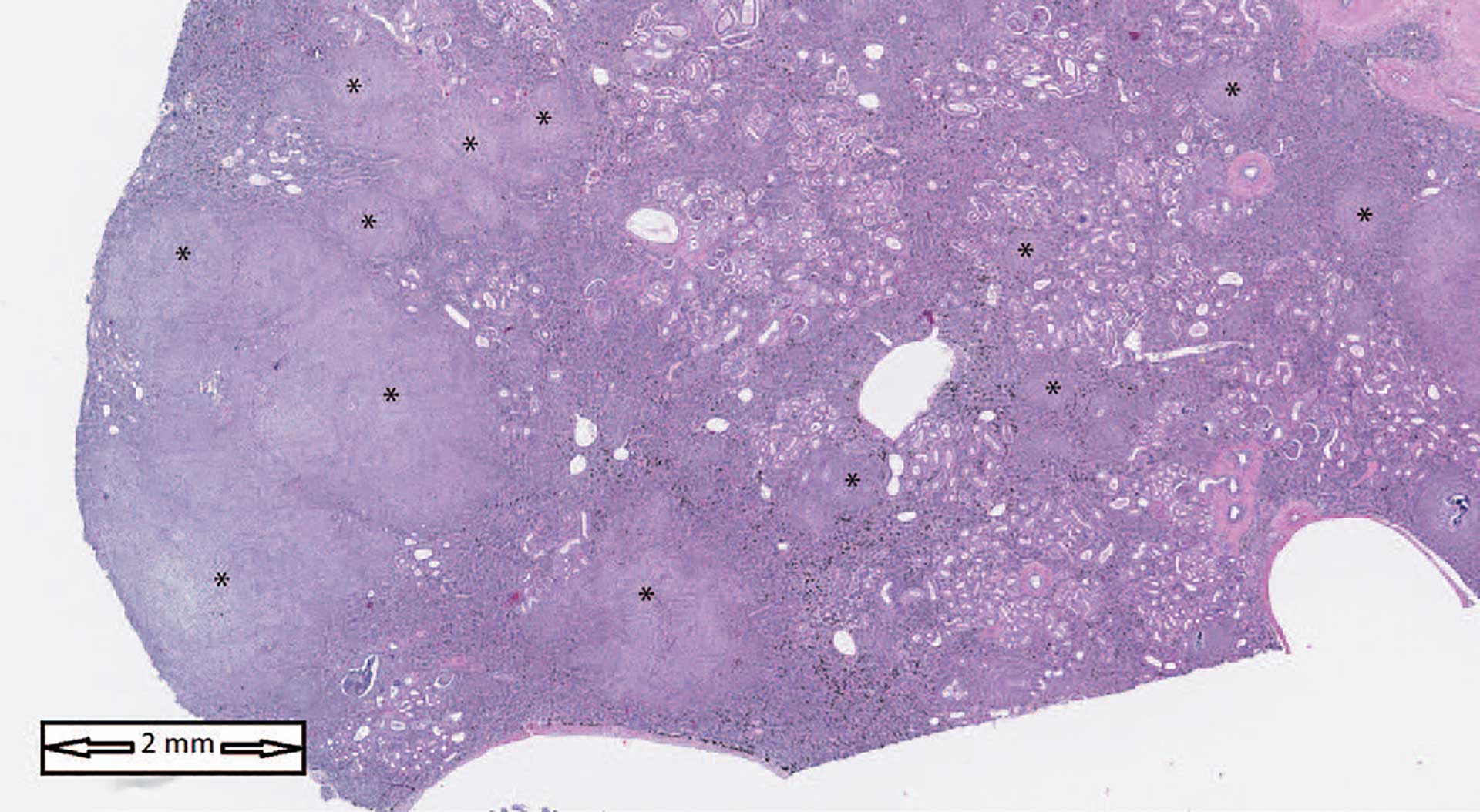
Figur 1a: Nyre. HE-farging. Oversiktsbilde som viser multifokal til konfluerende granulomatøs betennelse (stjerner).
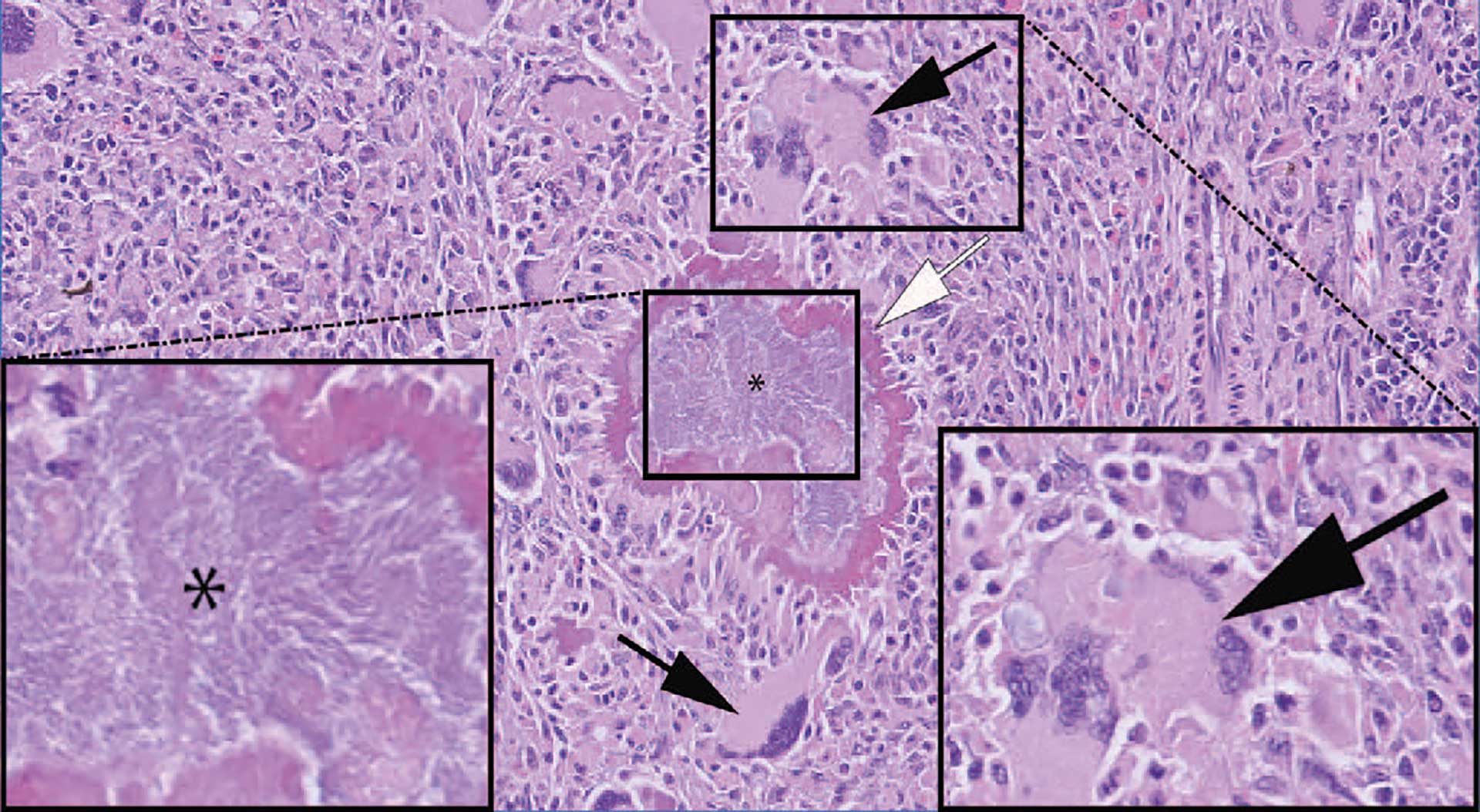
Figur 1b: Nyre. HE-farging. Granulomatøs betennelse med flerkjernede kjempeceller (svarte piler) og bakterier (stjerne) omgitt av Splendore Hoeppli-materiale (hvit pil).
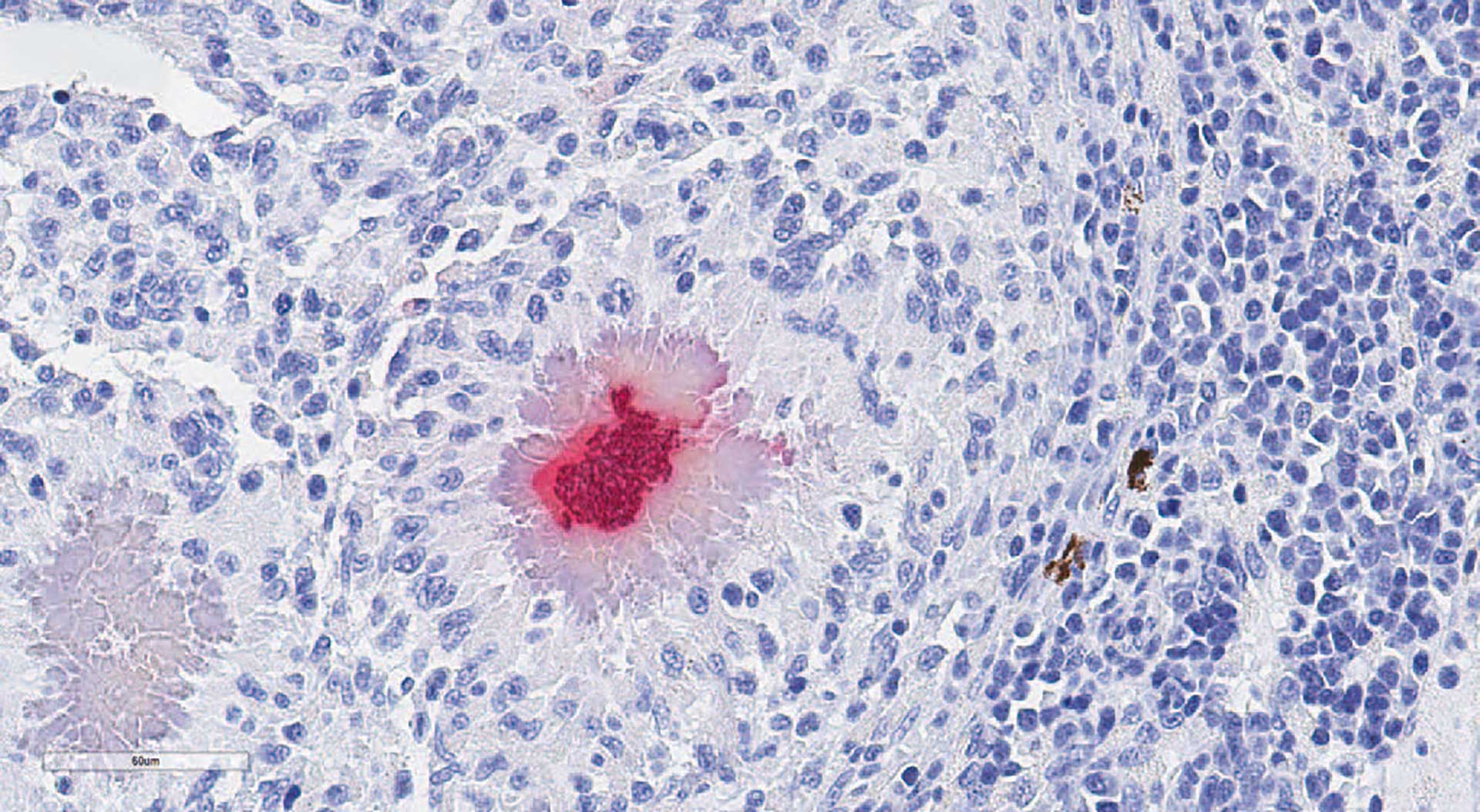
Figur 1c: Nyre. Immunhistokjemi med hensyn på Mycobacterium sp. Bildet viser et granulom med Mycobacterium sp. (rødfarget) sentralt i granulomet omgitt av Splendore Hoeppli-materiale.
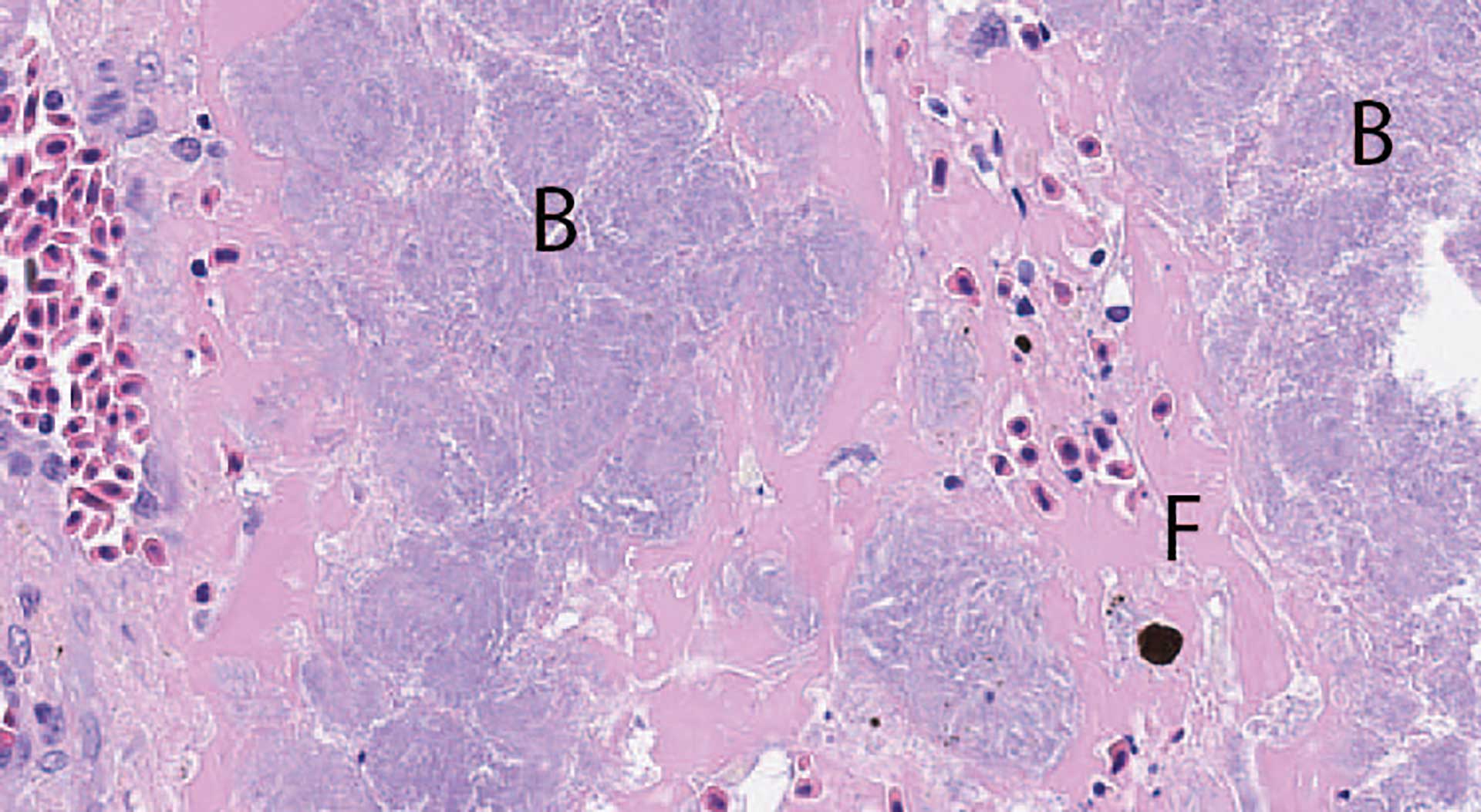
Figur 1d: Milt. HE-farging. Rikelig med fibrin (F) og bakterier (B) på overflaten av milten.
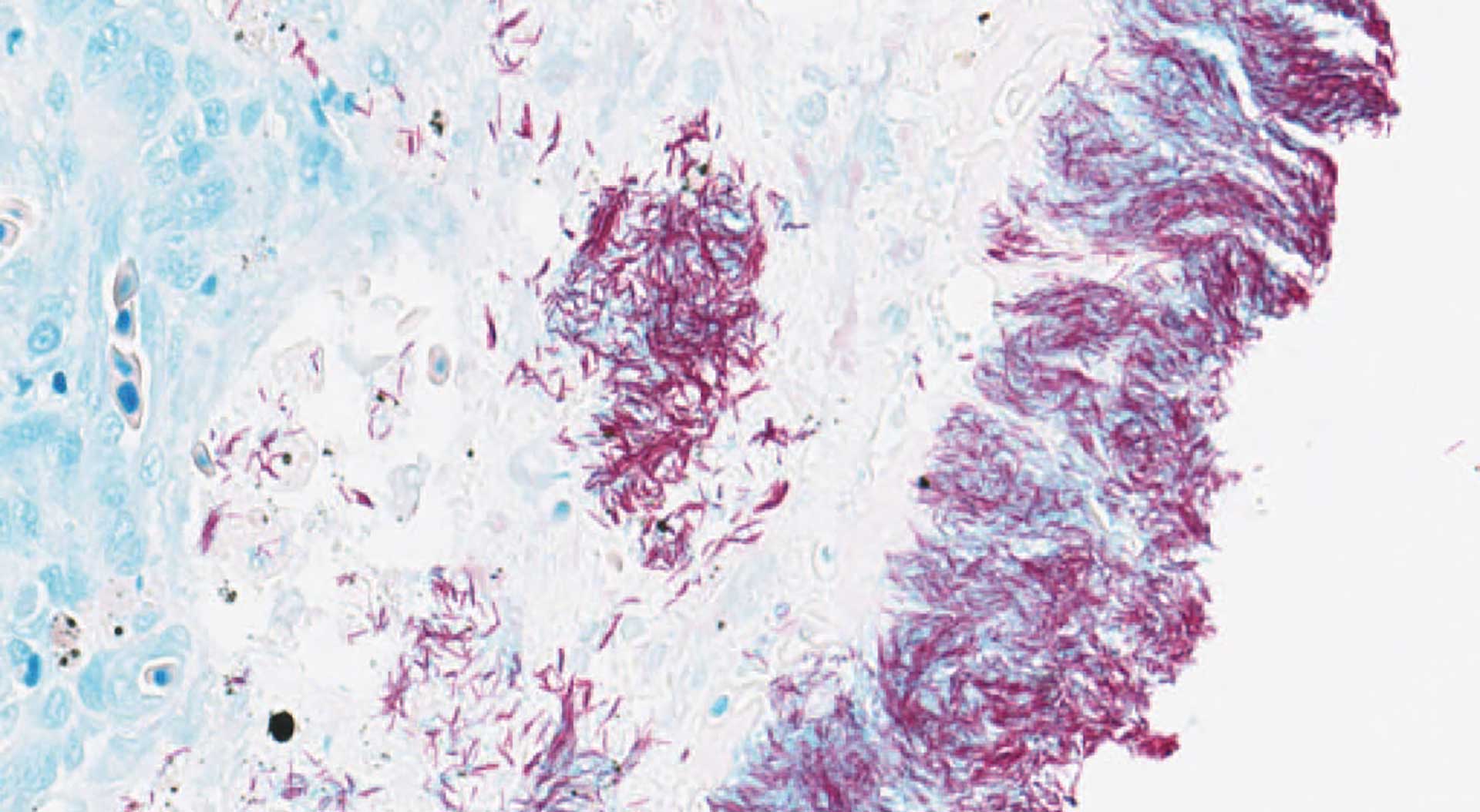
Figur 1e: Milt. Ziehl-Neelsens fargemetode. Rikelig med syrefaste stavbakterier (røde) på overflaten.
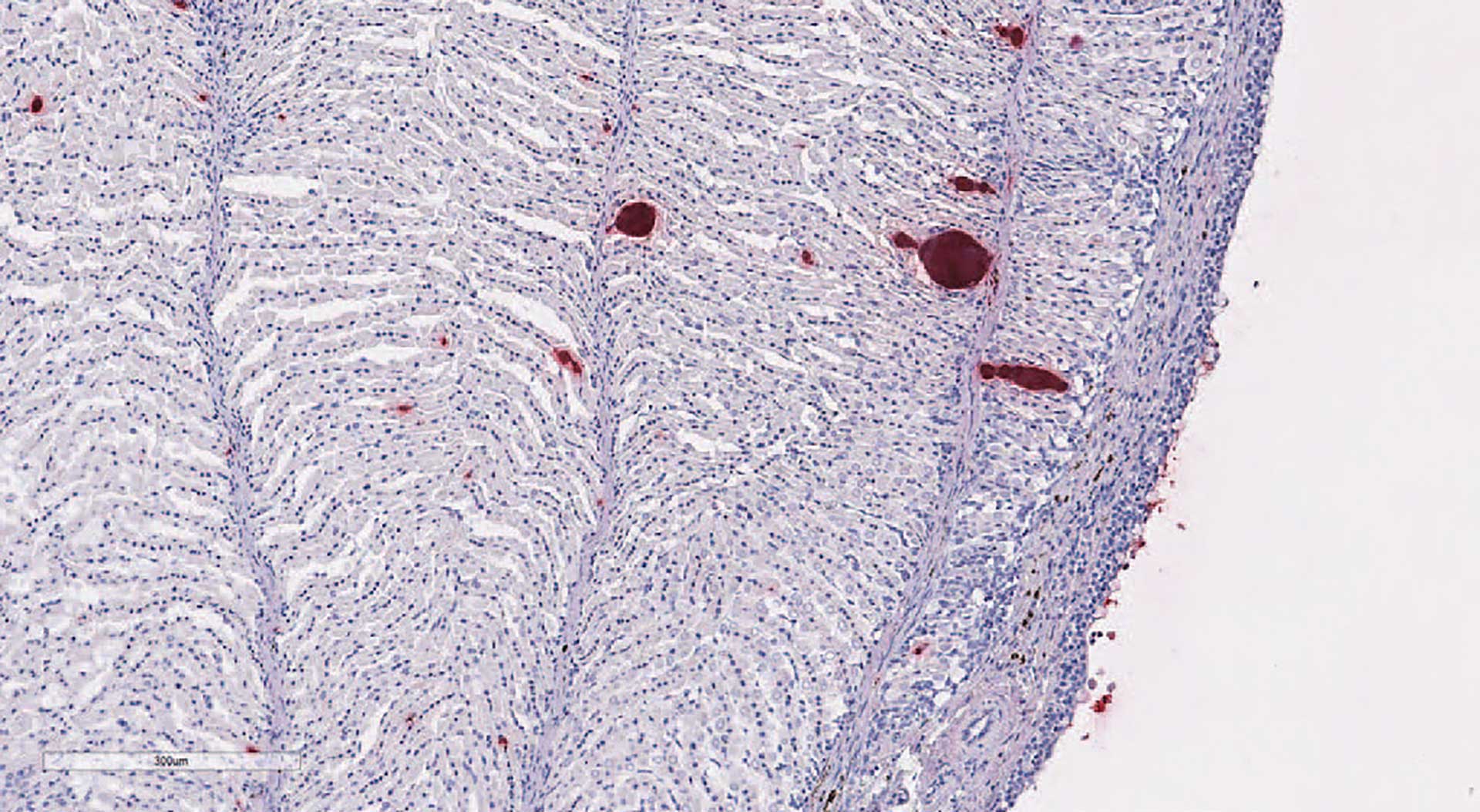
Figur 1f: Pseudobrankie. Immunhistokjemi mhp. Mycobacterium sp. Bildet viser Mycobacterium sp. i blodkar (rødfarget).
Mykobakterieinfeksjoner er karakterisert av to distinkte distribusjonsformer i vevet, og dette er grunnlaget for den morfologiske todelingen av granulomatøs betennelse i lepromatøs (diffus) type og tuberkuloid (nodulær) type. Lepromatøs type er en Th2-mediert immunologisk respons og tuberkuloid type er Th1-mediert (5).
Når fagocytterende celler tar opp mikrober vil de skille ut signalstoffer (cytokiner) som blant annet fremmer differensiering av naive T-celler til ulike populasjoner/typer T-hjelpeceller hvor de viktigste typene er Th1, Th2 og Th17. Hvilke T-hjelpeceller som dominerer immunresponsen bestemmes av sammensetningen av cytokiner som er blitt dannet i miljøet rundt fagocyttene etter opptak av mikrober, som igjen avhenger av hvilken type mikrobe som har blitt gjenkjent og fagocytert (6).
Th1-cellene skiller ut cytokinet interferon gamma som aktiverer makrofager til å drepe bakterier. Dette er kjent som klassisk makrofagaktivering. Th1-cellene skiller også ut andre cytokiner, deriblant TNF («Tumor necrosis factor») som rekrutterer monocytter fra blodet og inn i vevene (6).
Th2-celler dannes i et cytokinmiljø dominert av interleukin 4, typisk ved allergiske reaksjoner og i forsvar mot parasitter, men også i varierende grad ved mykobakterieinfeksjoner. Th2-celler skiller ut interleukiner 4, 5 og 13 som stimulerer B-celler til å produsere antistoffer, samt stimulerer makrofager til vevsreparasjon (en prosess kjent som alternativ makrofagaktivering) på bekostning av evnen til å drepe bakterier. Slik er Th2-responsen en demper for Th1-responsen (6). Dette er bakgrunnen for at bakteriene vil hope seg opp i store mengder inne i makrofager ved lepromatøs type granulomatøs betennelse, mens det i en tuberkuloid type granulomatøs betennelse som regel ses svært få bakterier (5).
Det vil være balansen mellom Th1- og Th2-aktiveringen som er bestemmende for sykdomsutvikling og utfall av infeksjonen. Fra mennesker er det kjent at en Th2-dominert respons på infeksjon med Mycobacterium leprae (som gir sykdommen lepra, kjent som spedalskhet på norsk) gir sykdomsformen lepromatøs lepra som har et destruktivt forløp med stor bakterievekst og høy dødelighet ubehandlet. Dette i kontrast til pasienter med en sterk Th1-respons mot samme bakterie som typisk får et mildt sykdomsforløp hvor de fleste bakterier blir destruert. Sistnevnte form kalles tuberkuloid lepra (6).
Mykobakterieinfeksjoner hos fisk
Hos fisk gir infeksjon med mykobakterier oftest kronisk sykdom med granulomdannelse i flere organer og vev (3). Granulomene ligner makro- og mikroskopisk på det som er kjent fra pattedyr, men det er beskrevet forskjeller i strukturen på molekylært nivå (7). I litteraturen finnes mest om den kroniske formen, men det har blitt dokumentert en akutt form for mykobakteriose, som i hovedsak er sett hos eksperimentelt smittet fisk (3). I 2017 beskrev Tuxbury og medarbeidere en akutt form for mykobakteriose hos eksperimentelt smittet fisk hvor det ble funnet et stort antall bakterier i blodkar og indre organer, betennelsesprosesser, trombosering, fibrinutsvedning og nekrose (8).
Kliniske tegn på mykobakteriose hos fisk er vage og inkluderer slapphet og nedsatt tilvekst. Noen utvikler hudsår- og blødninger, men noen viser ingen ytre sykdomstegn (3). Ved rutinemessig histopatologisk undersøkelse ses typisk granulomer i nyre, lever og milt ved kronisk sykdomsform (Figur 1a). I granulomene finnes ofte flerkjernede kjempeceller og Splendore Hoeppli-materiale (Figurer 1b og 1c). Bakterier er vanskelig å påvise ved standard HE-farging, men sparsom forekomst av syrefaste staver påvises ofte ved Ziehl-Neelsens fargemetode (Figurer 1d og 1e). Ved akutt form har vi ved histopatologisk undersøkelse sett fibrinøs peritonitt med bakterier langs bukhinne (Figur 1f), nekrose i indre organer og store mengder stavbakterier i blodkar og interstitium i hjerte, gjeller, lever, nyre, hud og muskulatur.
Påvises Gram-positive, syrefaste stavbakterier er det grunn til å mistenke mykobakterier. For verifisering av diagnosen brukes immunhistokjemi (IHK) og/eller mikrobiologisk undersøkelse. Sekvensering kan brukes for artsbestemmelse. Aktuelle differensialdiagnoser avhenger av fiskeart, men inkluderer infeksjon med Yersinia ruckeri, Francisella noatuensis, Piscirickettsia salmonis, Renibacterium salmoninarum, Nocardia sp., Rhodococcus sp. og sopp.
Forekomst i Norge
Mykobakteriose er ikke meldepliktig hos fisk, og derfor finnes det ingen samlet oversikt over antall utbrudd hos laksefisk i Norge. Ifølge Fiskehelserapporten 2021 ble det hos Veterinærinstituttet diagnostisert utbrudd på tre lokaliteter i 2018, syv i 2019 og fem i både 2020 og 2021 (9). I utbruddene hvor bakteriene ble artsbestemt var det i alle tilfeller M. salmoniphilum som ble identifisert. Tabell 2 gir en oversikt over diagnostisering av mykobakteriose hos Pharmaq Analytiq. Der ikke annet er oppgitt gjelder tallene lokaliteter med laks.
År |
Antall lokaliteter med påvist syrefaste staver |
Antall lokaliteter med påvist Mycobacterium sp. ved dyrkning og/eller immunhistokjemi |
Antall lokaliteter med påvist Mycobacterium salmoniphilumved sekvensering |
|---|---|---|---|
2018 |
2 |
2 |
1 |
2019 |
4 |
3 |
- |
2020 |
6 (5 lakselokaliteter, 1 sebrafiskfasilitet) |
4 |
3 |
2021 |
16 (15 lakselokaliteter, 1 leppefisklokalitet) |
13 (12 lakselokaliteter, 1 leppefisklokalitet) |
5 |
Diskusjon
I vårt diagnostiske materiale har antall saker med påvist mykobakteriose steget fra nivået i 2018-2019 med en markant økning fra 2020 til 2021. Mykobakterieinfeksjoner har blitt påvist i fisk fra både sjø- og landanlegg, og lokalitetene ligger i flere produksjonsområder hvorav de fleste tilfellene har vært fra produksjonsområdene Ryfylket (PO2) og Karmøy til Sotra (PO3).
Kriteriet for å mistenke mykobakteriose er et typisk histopatologisk bilde med granulomatøs betennelse og påvisning av syrefaste stavbakterier med Ziehl-Neelsens fargemetode.
Ved akutt form påvises syrefaste staver i organer og blodkar uten granulomdannelser. I de fleste tilfellene ble mistanken bekreftet med immunhistokjemisk undersøkelse med hensyn på Mycobacterium sp. I alle tilfeller hvor bakteriene ble identifisert på artsnivå (med sekvensering) ble det påvist Mycobacterium salmoniphilum.
Artsidentifisering ble kun utført på prøver fra laks.
Behandling og forvaltning
Det finnes ingen effektiv behandling mot mykobakteriose hos fisk per nå. Bakterienes cellevegg og dannelsen av granulomer vanskeliggjør effektiv behandling med antibiotika (9). Det finnes eksperimentelle vaksiner for Mycobacterium marinumutviklet til havabbor hvor feltstudier har vist at vaksine gir varierende grad av beskyttelse og redusert dødelighet (10), men kommersielle vaksiner er sannsynligvis ikke nært forestående. Mykobakteriose er ikke en listeført sykdom og ikke underlagt offentlig forvaltning.
Zoonotisk potensiale
Mycobacterium marinum og M. chelonae (som er nært beslektet med M. salmoniphilum) kan hos menneske gi hudlesjoner i form av overfladiske granulomer og sår, men infeksjonen kan spre seg til dypere vev hos immunsupprimerte pasienter. Selv om antall meldte tilfeller er lavt, kan håndtering av infisert fisk likevel representere en risiko hvis infisert materiale kommer i kontakt med skadet hud (3,11). Risikoen for å bli syk ved konsum av infisert fisk anses som lav da de fleste fiskepatogene mykobakterier ikke vokser ved 37 ˚C (11). Det er så vidt vi kjenner til ikke beskrevet sykdom hos menneske forårsaket av Mycobacterium salmoniphilum.
Etterskrift
Takk til ingeniørene i Pharmaq Analytiq for preparering av snitt til immunhistokjemi og til ingeniørene på Veterinærinstituttet for immun-histokjemisk farging.
Referanser
Aro L, Correa K, Martínez A, Ildefonso R, Yáñes JM. Characterization of Mycobacterium salmoniphilumas causal agent of mycobacteriosis in Atlantic salmon, Salmo salarL., from a freshwater recirculation system. J Fish Dis 2014;37:341–8.
Jacobs JM, Stine CB, Baya AM, Kent ML. A review of mycobacteriosis in marine fish. J Fish Dis 2009;32:119–30.
Spickler AR, Dvorak G. Piscine mycobacteriosis. 2020. https://www.cfsph.iastate.edu/Factsheets/pdfs/mycobacterium_marinum.pdf (11.03.2022).
Kryvi H, Poppe T. Fiskeanatomi. 2.utg. Bergen: Fagbokforlaget, 2021.
Zachary JF. Pathologic basis of veterinary disease. 6th ed. St. Louis, Missouri: Elsevier, 2017.
Abbas AK, Lichtman AH, Pillai S. Basic immunology: functions and disorders of the immune system. 5th ed. St. Louis, Missouri: Elsevier, 2016.
Gauthier DT, Rhodes MW. Mycobacteriosis in fishes: a review. Vet J 2009;180:33–47.
Tuxbury KA, Young SA, Bradway DS, Marola JL, Salfinger M, Garner MM. Acute disseminated mycobacteriosis in captive Atlantic guitarfish (Rhinobatos lentiginosus). J Vet Diagn Invest 2017;29:935–8.
Sommerset I, Walde CS, Jensen BB, Wiik-Nielsen J, Bornø G, Oliveira VHS et al. Fiskehelserapporten 2021. Oslo: Veterinærinstituttet, 2022. (Veterinærinstituttet rapportserie nr 2a/2022).
Miccoli A, Manni M, Picchietti S, Scapigliati G. State-of-the-art vaccine research for aquaculture use: the case of three economically relevant fish species. Vaccines 2021;9:140.
Veterinærinstituttet. Mykobakteriose hos fisk (Mycobacterium spp.). https://www.vetinst.no/sykdom-og-agens/mykobakteriose-hos-fisk-mycobacterium-spp (27.06.2022).