Forekomst av Aelurostrongylus abstrusus hos eide og eierløse katter i Bergensområdet med kliniske tegn fra luftveiene
Veterinær. Spesialist i smådyrsykdommer - hund og katt. AniCura Dyresykehuset Bergen Nord og AniCura Dyreklinikken Sotra
Veterinær, Spesialist i smådyrsykdommer - hund og katt. AniCura Dyresykehuset Bergen Nord
Veterinær. Seniorforsker mikrobiologi, Veterinærinstituttet
Veterinær. Veterinary Scientific Affairs Manager. Bayer AB Animal Health
Veterinær. Bergen Katteklinikk AS
Veterinær. Global Veterinary Scientific Affairs Manager. Bayer Animal Health GmbH
Veterinær. Specialist i hundens och kattens sjukdomar og specialist i invärtesmedicin och kardiologi, AniCura Albano Djursjukhus
Formålet med studien var å undersøke katter med kliniske tegn fra luftveiene i Bergensområdet, og ved hjelp av fecesprøver avgjøre hvor mange av disse kattene som var infisert med lungeormen Aelurostrongylus abstrusus. Inklusjonskriteriene for studien var tilstedeværelse av et eller flere av 4 kliniske tegn: økt respirasjonsrate, neseflod, økte lungelyder og hoste. Fecesprøvene ble analysert med Baermanns metode og positive prøver ble bekreftet av Veterinærinstituttet. Totalt 79 katter ble inkludert i studien.
Innledning
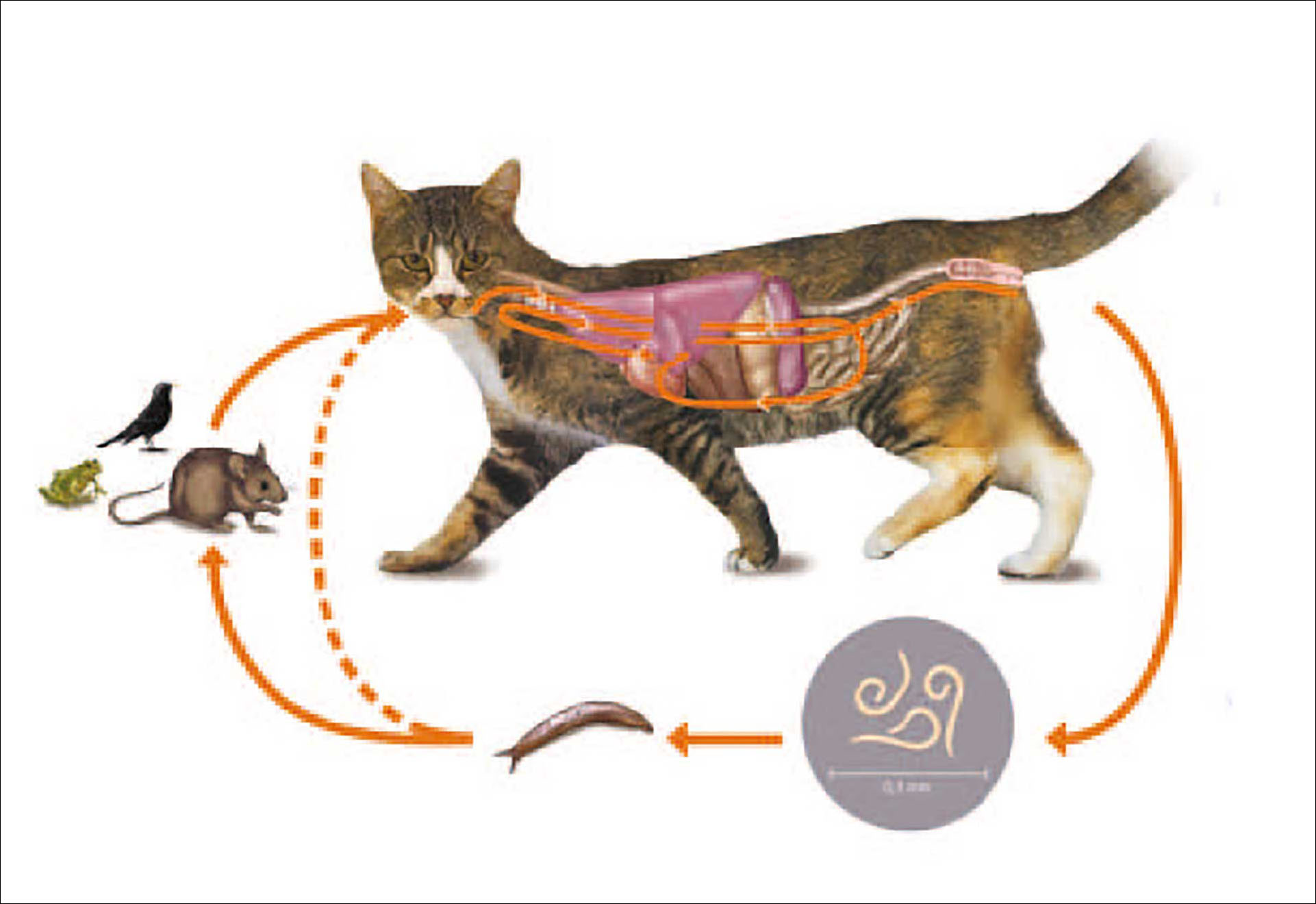
Figur 1. Livssyklusen til Aelurostrongylus abstrusus. Se teksten for detaljer.
Foto: Elanco

Figur 2. Katter kan bli infisert ved å få i seg L3 larver via en paratenisk vert (gnagere, katter, reptiler).
Foto: Ferny Evebø
Kattens lungeorm Aelurostrongylus abstrusus er en liten metastrongyloid nematode som infiserer de nedre luftveiene (1). Den anses som den mest prevalente lungeormen hos domestiserte katter og er påvist i mange europeiske land samt i Australia, Amerika og Afrika (2-8). A. abstrusus har en indirekte livssyklus med snegler som mellomvert (Figur 1) (9-12). Sneglene inntar førstestadiumslarvene (L1) når de kommer i kontakt med infisert kattefeces og parasitten utvikler seg her til tredjestadiumslarver (L3). Katter infiseres med L3 enten via mellomvert eller via en paratenisk vert (gnager, fugl, reptil) (Figur 2). De kan også infiseres ved å innta mat, vann eller gress som er kontaminert med slim fra en infisert mellomvert eller døde snegler (13). Vertikal overføring via placenta eller melken kan ikke utelukkes (14). Når L3 har kommet ned i tarmen migrerer larvene via lymfesystemet til lungene hvor de modnes til voksne ormer (9-11, 15). De lever i de terminale bronkiolene, alveolene og alveolegangene, og legger egg cirka fire uker etter infeksjon. Eggene klekkes i alveolene og L1 beveger seg oppover i luftveiene for så å bli hostet opp og deretter bli svelget. L1 skilles så ut i feces, og prepatenstiden kan variere fra fem til syv uker (15, 16). Utskillelsen av L1 i feces kan variere og vare i flere måneder (15). Både L3 i snegleslim og L1 kan overleve flere uker i miljøet avhengig av temperatur og luftfuktighet (17, 18).
Katter infisert med A. abstrusus kan være asymptomatiske eller ha milde til alvorlige kliniske tegn som for eksempel økte lungelyder, hoste, neseflod, økt respirasjonsfrekvens (RR) og dyspné (7, 16, 19-23). De kan også ha systemiske kliniske tegn som letargi og vekttap. Infeksjonen kan være fatal i alvorlige tilfeller, særlig hos unge katter med et umodent immunforsvar eller immunsupprimerte katter (7, 16, 23, 24). Lungeorm er også blitt beskrevet som en viktig årsak til narkoserelaterte dødsfall uavhengig av tilstedeværelse av kliniske tegn (2, 22). På grunn av inflammasjonen i de nedre luftveiene og de patologiske forandringene som oppstår, kan det ses forandringer på røntgen allerede under prepatensperioden (Figur 3) (16). Både de kliniske tegnene og røntgenforandringene er de samme som ses ved andre bronkopulmonære sykdommer hos katt. Lungeorm er dermed en viktig differensialdiagnose hos utendørskatter med kliniske tegn fra luftveiene i endemiske områder (19).
Formålet med denne studien var å vurdere forekomsten av A. abstrusus hos katter med kliniske tegn fra luftveiene i Bergensområdet.
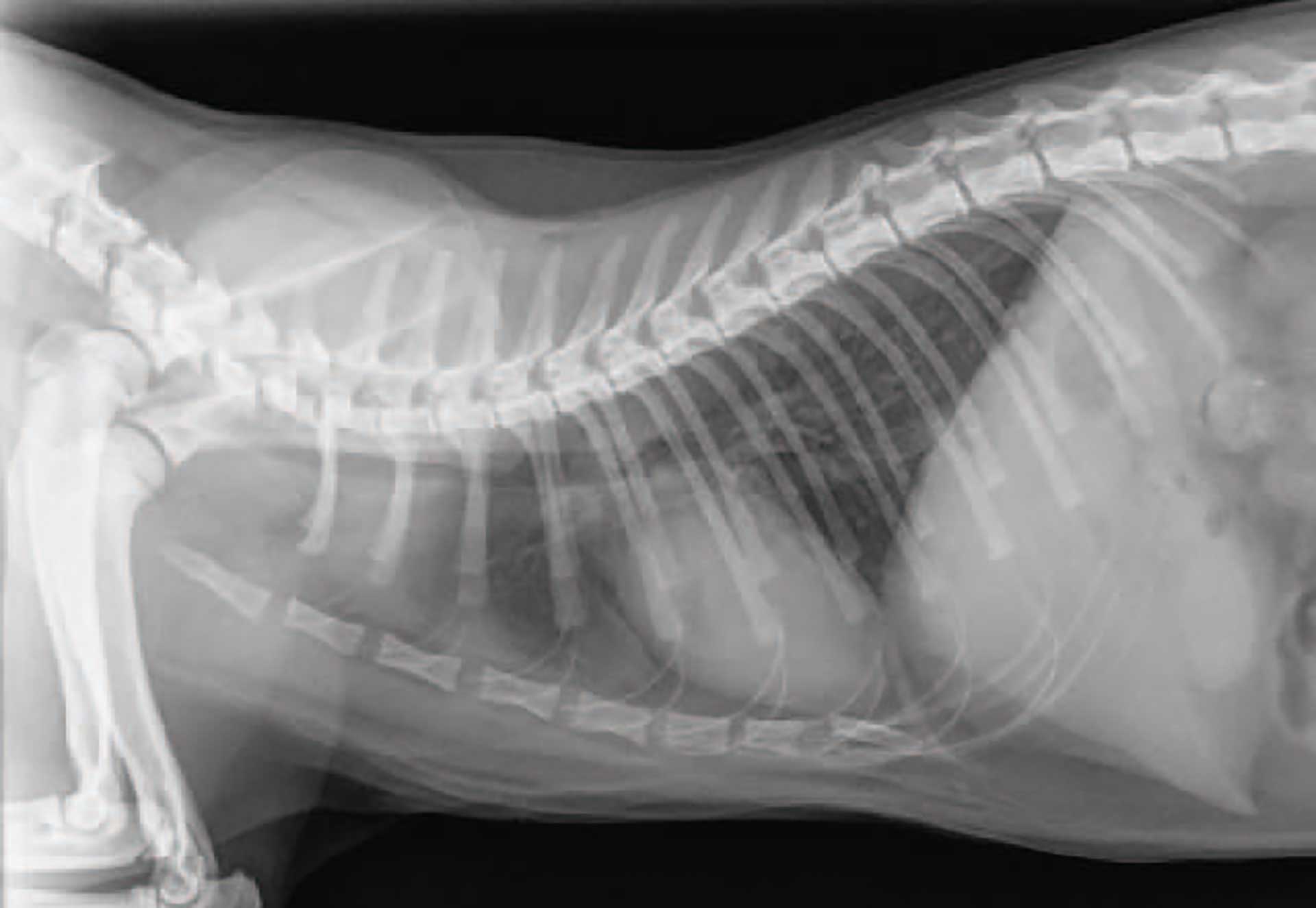
Figur 3. Høyre lateralt røntgenbilde av thorax hos katt med bekreftet Aelurostrongylus abstrusus infeksjon. Et bronko-interstitielt pulmonært mønster er typisk for en Aelurostrongylus abstrusus infeksjon. Forandringene er oftest til stede i hele lungefeltet.
Foto: Hilde Røssland
Materialer og metoder
Studiepopulasjon
Det ble inkludert 79 katter eldre enn fire måneder med tilgang til utendørsarealer som oppfylte ett eller flere av følgende inklusjonskriterier under den kliniske undersøkelsen: økte lungelyder påvist ved auskultasjon, hoste, neseflod og RR på over 30/minutt ved hvile. Totalt tre smådyrklinikker deltok i studiet. Kattene som ble inkludert i studien var enten privateide eller hjemløse fra en klinikk tilknyttet Dyrebeskyttelsen. Kattene var eldre enn fire måneder og måtte ha hatt tilgang til utendørsarealer. Kattene skulle ikke ha fått ormekur de siste to månedene før oppstart av studien. Kattenes signalement og kliniske tegn ble notert på individuelle observasjonsskjemaer laget for denne studien. De hjemløse kattene ble gitt en estimert alder ut fra generell undersøkelse, størrelse og tannstatus. Grunnet villkattstatus ble ikke alle kattene veid.
Fecesprøver
Fecesprøver ble samlet fra studiepopulasjonen av katter i perioden juli 2017 til mars 2020. Det ble tatt fecesprøver fra tre påfølgende dager fra hver katt.
Parasittologisk undersøkelse
Fecesprøvene ble først analysert av en erfaren veterinær på klinikkene med Baermanns metode (Figur 4) som regnes som «gullstandarden» for diagnostisering av A. abstrusus infeksjon hos katter (25). Dersom testen var positiv, ble fecesprøver fra tre dager, samt materialet fra den utførte testen på klinikkene fortynnet i 70 % etanol, og sendt til Veterinærinstituttet for bekreftelse og kvantifisering. Prøvene ble registrert som positive kun dersom funnet ble bekreftet av Veterinærinstituttet. Katter som hadde negativ test hos Veterinærinstituttet ble registrert som negative i studien.

Figur 4: Baermanns metode utført på klinikkene.
Foto: Hilde Røssland
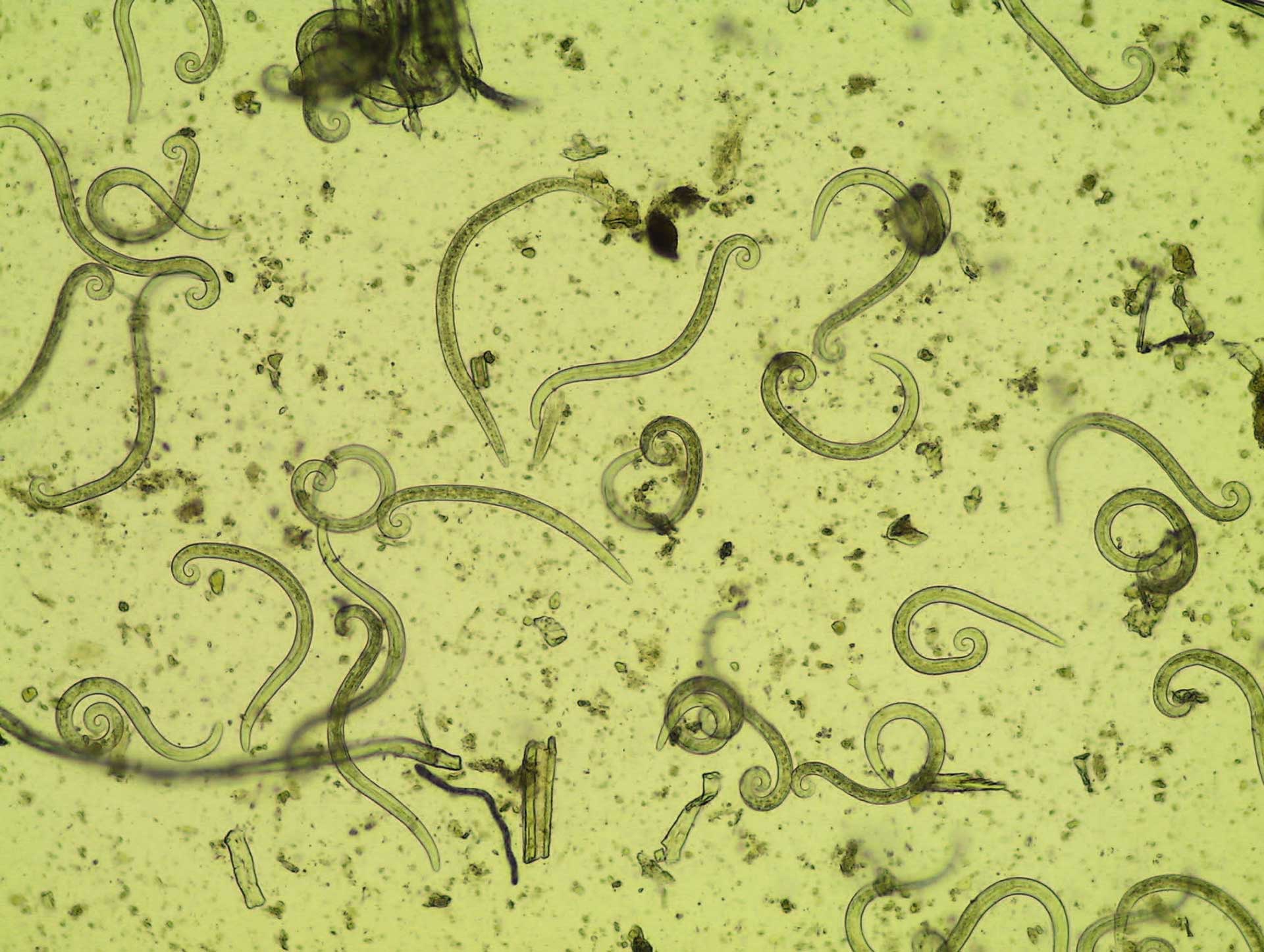
Figur 5. Første stadium larver av Aelurostrongylus abstrusus (10x).
Foto: Hilde Røssland
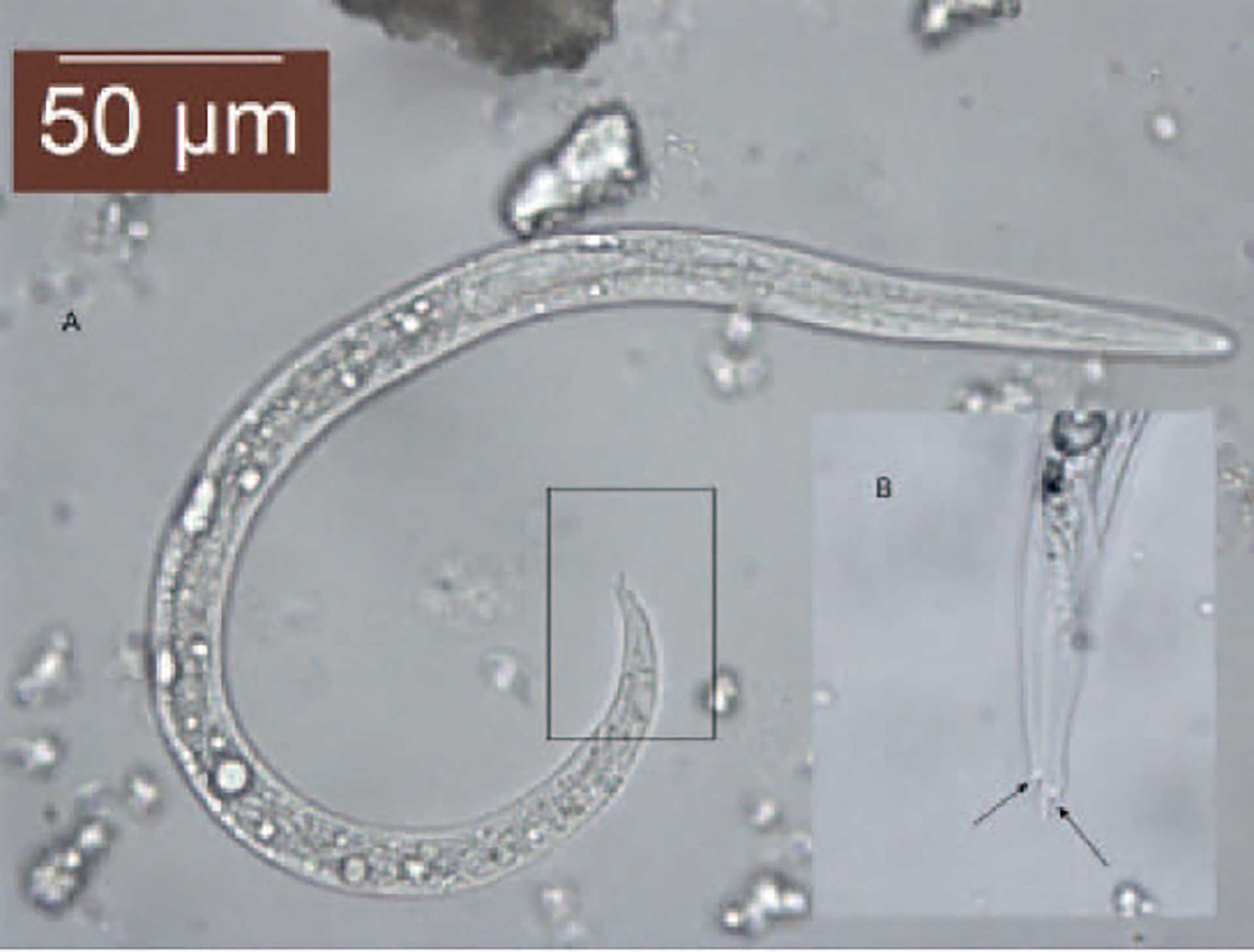
Figur 6. (A) Aelurostrongylus abstrusus L1 larve, (400x). (B) Detaljene på halen: S-formet hale med dorsal pigg.
Foto: Inger Sofie Hamnes
Fecesprøvene som ble sendt til Veterinærinstituttet, ble igjen undersøkt med Baermanns metode (25). Cirka 10 g feces ble pakket inn i 10x10 cm, tolaget kompress (Mölnlycke GauzeTM) og hengt i lunkent springvann over natten. Supernatanten ble så fjernet og sedimentet ble samlet i et 15 mL plastikkrør som fikk sedimentere i minst 15 minutter. Etter sedimenteringen ble supernatanten fjernet slik at sluttvolumet ble 2,0 mL. Prøven ble blandet på en vortex bordsentrifuge og en prøve på 200 µL ble overført til et objektglass. Dekkglass ble pålagt før mikroskopering med 40-100x objektiv (Leica DM 2000, LeicaTM Microsystems GmbH). Antall larver som morfologisk stemte med A. abstrusus ble talt opp og antall larver per gram feces ble deretter regnet ut. Dersom det ikke ble funnet larver i denne prøven, fikk resten av prøven sedimentere i minst 5 minutter før en ny prøve på 200 µL fra bunnen av røret ble undersøkt. Dersom ingen larver ble funnet i prøven fra bunnen av røret, ble prøveuttaket på 200 µL gjentatt. Prøven ble klassifisert som negativ hvis det ikke ble funnet noen larver i et totalvolum på 1,0 mL. Ble det funnet larver etter den andre runden med sedimentering (i 15 mL røret), ble prøven klassifisert som positiv, men antall larver per gram feces ble ikke kalkulert. Larver funnet i prøvene ble undersøkt for morfologiske trekk forenlig med A. abstrusus larver: S-formet hale med dorsal pigg (Figur 5 og 6) og lengde på mellom 360-415 µm (A,B) ved bruk av lysfelt- og fasekontrastmikroskopi med 200x-400x forstørrelse (Leica 4000B, LeicaTM Microsystems GmbH). Lengden på larvene i de fleste prøvene ble målt ved hjelp av Leica Application Suite Software (LeicaTM Microsystems GmbH). De gjenværende larvene fra hver prøve ble overført til etanol og holdt kjølig for eventuell molekylær analyse (26, 27).
Statistikk
Et statistikkprogram (JMP, v.14.0, SAS Institute Inc, Cary, NC) ble brukt for statistiske analyser. Dataene er presentert som «total range», «median» og «interquartile range» (IQR). Signalement og kliniske variabler hos katter med og uten A abstrusus infeksjon ble sammenliknet. Den non-parametriske Kruskal-Wallis testen be brukt for testing av ”equality of medians”. Signifikansnivået var p ≤ 0,05.
Resultater
Totalt ble 79 katter, 46 (58 %) hannkatter og 33 (42 %) hunnkatter, inkludert i studien. Alderen varierte fra fire måneder til 96 måneder, med en median på 31 måneder (IQR, 11-70 måneder). Kroppsvekt varierte fra 1,5-5,6 kg, med en median på 4,0 kg (IQR 3,5-5,3 kg). Av de 79 kattene som ble inkludert i studien, var 23 (29 %) positive for A abstrusus og 56 (71 %) testet negativt. Alle de positive prøvene ble bekreftet av veterinærinstituttet. Signalement og kliniske variabler ble sammenliknet mellom gruppene (Tabell 1).
Variabel |
Antall (n) |
Aelurostrongylus test positiv (n= 23) |
Aelurostrongylus test negativ (n=56) |
P-verdi |
|---|---|---|---|---|
Alder (måneder) |
79 |
12 (4-31) |
52 (17-96) |
0.0009 |
Kjønn (hann/hunn) |
79 |
14/9 |
32/24 |
0.76 |
Kroppsvekt (kg) |
41 |
2.6 (1.5-4) |
4.5 (3.5-5.6) |
0.0084 |
Eier (privat/eierløs) |
79 |
8/15 |
40/16 |
0.0024 |
Respirasjonsfrekvens >30/min (ja/nei) |
79 |
15/8 |
24/32 |
0.07 |
Hoste (ja/nei) |
79 |
12/11 |
43/13 |
0.03 |
Økte respirasjonslyder (ja/nei) |
79 |
5/18 |
15/41 |
0.64 |
Neseflod (ja/nei) |
79 |
6/17 |
10/46 |
0.41 |
Øyeflod (ja/nei) |
79 |
7/16 |
4/52 |
0.0066 |
*IQR = Inter Quartile Range
Diskusjon
Studien vår viser en prevalens av A. abstrusus på 29 % i en populasjon med eide og eierløse katter i Bergens-området med kliniske tegn fra luftveiene. Så vidt vi vet, er det ikke gjort liknende studie før i Norge. Prevalensen i denne populasjonen er høy sammenliknet med det som er rapportert i Danmark (8,3 %) og Sverige (1 kasus), men mer sammenlignbart med det som er rapportert i Portugal (17,4 %) og Italia (25,2 %) (12, 28-30). Utendørs-temperatur, nærhet til vann og luftfuktighet påvirker utviklingen og overlevelsen av snegler og larvestadier. Dette påvirker også overlevelsen av L1 og L3 i omgivelsene, og overlevelse og antallet A. abstrusus-larver i andre arter enn snegler. Dermed kan luftfuktigheten og varmere vintre i Norge være med på å forklare denne relativt høye prevalensen i studien. En studie fra Sveits viste at katter fra områder med en gjennomsnittstemperatur på +20 ˚C i januar kombinert med en lokalisering på under 700 moh., utgjorde 99 % av de kattene som var positive for A. abstrusus (22). Bergen har et liknende klima og plassering.
Den gjennomsnittlige alderen hos de A. abstrusus positive kattene i studien var signifikant lavere enn hos de ikke-infiserte kattene. Dette stemmer med flere tidligere studier (22, 24, 31). Det er sannsynlig at A. abstrusus smitter gjennom melken til kattungene, eller kattungene blir infisert utendørs når de begynner å spise fast føde (13, 26). Unge katter kan ha et mindre effektivt immunforsvar og kan dermed være mer mottakelig for infeksjon. Den yngste katten i studien som testet positivt var 4 måneder gammel, og den eldste var 31 måneder. Det faktum at katter kan reinfiseres med A. abstrusus og at eldre katter gjerne har vært eksponert lenger, kan bidra til den store aldersvariasjonen i gruppen med infiserte katter (15).
Kroppsvekten var signifikant lavere hos infiserte katter sammenliknet med ikke-infiserte katter. Dette kan mest sannsynlig forklares med at de infiserte kattene var yngre enn de ikke-infiserte kattene. Lav kroppsvekt kan også indikere tilstedeværelse av andre samtidige sykdommer, eller kan muligens øke mottakeligheten for parasittinfeksjon. Det var ingen signifikant forskjell mellom hunnkatter og hannkatter. Dette stemmer med funn i andre studier (12, 22, 31).
I vår studie hadde de privateide kattene lavere forekomst av infeksjon med A. abstrusus sammenliknet med de eierløse kattene. Det kan skyldes flere faktorer, blant annet at privateide katter har større sannsynlighet for å ha mottatt ormekur. Det kan også antas at disse kattene er mer robuste til å stå imot infeksjon, da de får mat og stell. I tillegg er som regel privateide katter kastrert slik at de ikke streifer og jakter over store områder i like stor grad som intakte katter. Dette kan igjen redusere eksponeringen for parasitter. En studie rapporterte om at intakte katter hadde høyere risiko for infeksjon (16 %) enn kastrerte katter (6 %) (22). Forekomsten av A. abstrusus positive katter kan tenkes å påvirkes av at intakte katter streifer over større områder og er ofte borte i lengre perioder under paringssesongen som korrelerer med varmt vær og økende eksponering for parasitten. Streifende hjemløse katter jakter i større grad på parateniske verter som mus og fugler sammenliknet med privateide katter.
I vår studie var hoste signifikant assosiert med A. abstrusus infeksjon, noe som støttes av tidligere publikasjoner (7, 12, 19-21). Fecesundersøkelse bør derfor inkluderes ved utredning av hoste hos katt.
Øyeflod var også signifikant assosiert med A. abstrusus infeksjon, selv om dette bare ble observert hos 14 % av kattene i denne studien. Så vidt vi vet, er det kun én tidligere studie som har funnet en assosiasjon mellom A. abstrusus og øyeflod (12). Siden A. abstrusus forårsaker inflammasjon i de nedre luftveiene, er den patofysiologiske mekanismen bak øyeflod uklar i denne sammenhengen. Det kan ikke utelukkes at øyefloden var forårsaket av andre samtidige patogener i disse kattene.
Forekomsten av neseflod var ikke signifikant forskjellig mellom de A. abstrusus positive og negative kattene, selv om dette ofte er sett hos katter med A. abstrusus infeksjon (7, 20, 23). Neseflod er et uspesifikt klinisk tegn som kan forårsakes av mange patogener. Siden A. abstrusus forårsaker inflammasjon i de nedre luftveiene, er det sannsynlig at de har en koinfeksjon eller sekundær infeksjon med andre patogener i de øvre luftveiene.
Det var ingen statistisk signifikant forskjell mellom gruppene i denne studien når det gjaldt økt respirasjons-rate og økte lungelyder, selv om dette er kliniske tegn som ofte er beskrevet i forbindelse med A. abstrusus infeksjon (7, 12, 19-21, 23). Økt respirasjonsrate er et uspesifikt klinisk tegn som kan forårsakes av andre nedre luftveissykdommer og stress. Sistnevnte er særlig relevant for hjemløse katter.
Begrensninger i studien
I denne studien ble kun katter med kliniske tegn som oppfylte inklusjonskriteriene inkludert i studien. A. abstrusus kan også forårsake subklinisk sykdom (12, 20, 22). Dermed gjelder vår estimering av forekomsten kun katter med respiratoriske kliniske tegn.
Selv om Baermanns metode benyttet på fecesprøver anses som en pålitelig teknikk med en sensitivitet på 85 % og en spesifisitet på 100 % (25), kan falske negative prøver forekomme på grunn av variasjon i erfaring med analysene og/eller lavt antall larver i noen prøver. Flere klinikker deltok i studien og dermed har flere personer vært involvert i screeningen av prøvene. Dette kan igjen påvirke sensitiviteten og spesifisiteten. På den annen side ble alle positive prøver bekreftet av Veterinærinstituttet.
Mange av de hjemløse kattene var for redde til å kunne håndteres, og dermed var en grundig klinisk undersøkelse ikke mulig. Disse kattene ble inkludert i studien basert på personalets observasjoner. Dette kan ha påvirket antall katter som ble inkludert, siden det kan være vanskelig å vurdere for eksempel RR hos redde katter.
En annen begrensning i studien vår er at katter infisert med lungeormen Troglostrongylus brevior kan ha de samme kliniske tegnene som ved en A. abstrusus infeksjon. Disse to lungeormene har lik livssyklus og mikroskopisk differensiering mellom L1 er vanskelig. Det er derfor nødvendig med videre diagnostikk, som for eksempel «polymerase chain reaction» (PCR)- test, for å kunne skille disse to (26). I denne studien ble det ikke utført PCR-test og T. brevior kan derfor feilaktig ha blitt diagnostisert som A. abstrusus. Det er ikke gjort noen studier på forekomsten av T. breviori Norge.
Sammendrag
Aelurostrongylus abstrususer en metastrongyloid nematode som infiserer lungene hos katter i mange land. Katter med A. abstrusus infeksjon kan være uten kliniske tegn eller ha milde til alvorlige kliniske tegn som for eksempel økte lungelyder, hoste, neseflod, økt respirasjonsfrekvens og dyspne. Både de kliniske tegnene og røntgenforandringene er de samme som ses ved andre bronkopulmonære sykdommer hos katt. Lungeorm er dermed en viktig differensialdiagnose hos utendørskatter i endemiske områder med kliniske tegn fra luftveiene. Formålet med studien var å undersøke i hvilken grad katter med kliniske tegn fra luftveiene i Bergensområdet var infisert med A. abstrusus. Kattene som ble inkludert i studien gjennomgikk en klinisk undersøkelse, og ble inkludert i studien dersom de hadde ett eller flere av fire kliniske tegn: økt respirasjonsfrekvens, neseflod, økte lungelyder og hoste. Det ble samlet avføring fra tre påfølgende dager fra kattene som ble inkludert i studiet, og fecesprøvene ble analysert med Baermanns metode. Positive prøver ble bekreftet av Veterinærinstituttet. Fecesprøver fra 79 katter med kliniske tegn ble undersøkt, og 29 % (23/79) var positive og ble bekreftet å være positive for A. abstrusus. Ung alder, lav kroppsvekt, hoste og øyeflod var signifikant vanligere hos infiserte katter sammenliknet med ikke-infiserte katter. Det var ingen statistisk signifikant forskjell mellom infiserte katter og ikke-infiserte katter når det gjaldt kjønn, respirasjonsfrekvens, økte respirasjonslyder eller neseflod. Fecesundersøkelse bør derfor inkluderes ved utredning av hoste hos katt.
Summary
Prevalence of Aelurostrongylus abstrusus in a Norwegian population privately owned and shelter cats with clinical signs related to the airways
Aelurostrongylus abstrususis a metastrongyloid nematode that infects the lungs of cats in many countries. Cats with A. abstrusus infection can be without clinical signs or have mild to severe clinical signs such as increased lung sounds, cough, nasal discharge, increased respiratory rate and dyspnea. Both the clinical signs and changes seen on x-rays are comparable to other bronchopulmonary diseases in cats. Lungworm is therefore an important differential diagnosis when outdoor cats present with clinical signs related to the airways in endemic areas.
The aim of the study was to examine to what degree cats with clinical signs related to the lower airways in the Bergen area in Western Norway were infected with A. abstrusus. The cats were included in the study based on the presence of one or more of 4 clinical signs; increased respiratory rate, nasal discharge, increased lung sounds and coughing. Faeces from three consecutive days were collected, and the fecal samples were analysed using the Baermann technique. Positive samples were confirmed by the Norwegian Veterinary Institute. Fecal samples from 79 of the cats with clinical signs were examined, and 29 % (23/79) were found to be positive for A. abstrusus. Younge age, low body weight, cough and ocular discharge were significantly more common in cats that were infected compared to the cats that were not. There were no significant differences between infected and non-infected cats when considering sex, respiratory rate and nasal discharge. Fecal examination should be included in the investigation of coughing cats.
Etterskift
Vi vil gjerne takke Bergen Katteklinikk, Dyrebeskyttelsen Bergen, AniCura Dyresykehuset Bergen Nord og AniCura Dyreklinikken Sotra for å ha bidratt med innsamling av prøver til studien. Vi vil også gjerne takke Eirin Eikeland (Bayer) og Ingrid Heijdenberg (Bayer) for all hjelp til planlegging og gjennomføringen av studien.
Referanser
Fry W, Stewart JT. Studies on Aelurostrongylus abstrusus (Railliet 1898) Cameron 1927. J Parasitol 1931;18:34-9.
Gerdin JA, Slater MR, Makolinski KV, Looney AL, Appel LD, Martin NM et al. Post-mortem findings in 54 cases of anesthetic associated death in cats from two spay-neuter programs in New York State. J Feline Med Surg 2011;13:959-66.
Elsheikha HM, Wright I, Wang B, Schaper R. Prevalence of feline lungworm Aelurostrongylus abstrususin England. Vet Parasitol Reg Stud Rep 2019;16:100271.
Penagos-Tabares F, Lange MK, Chaparro-Gutiérrez JJ, Taubert A, Hermosilla C. Angiostrongylus vasorumand Aelurostrongylus abstrusus: neglected and underestimated parasites in South America. Parasit Vectors 2018;11:208.
Hoggard KR, Jarriel DM, Bevelock TJ, Verocai GG. Prevalence survey of gastrointestinal and respiratory parasites of shelter cats in northeastern Georgia, USA. Vet Parasitol Reg Stud Rep 2019;16:100270.
Gordon HMcL. A note on the presence of the lungworm of the cat, Ælurostrongylus abstrususxk(Railliet, 1898), in Australia. Aust Vet J 1933;9:198.
Barutzki D, Schaper R. Occurrence and regional distribution of Aelurostrongylus abstrususin cats in Germany. Parasitol Res 2013;112:855–61.
Giannelli A, Capelli G, Joachim A, Hinney B, Losson B, Kirkova Z et al. Lungworms and gastrointestinal parasites of domestic cats: a European perspective. Int J Parasitol 2017;47:517-28.
Jezewski W, Buńkowska-Gawlik K, Hildebrand J, Perec-Matysiak A, Laskowski Z. Intermediate and paratenic hosts in the life cycle of Aelurostrongylus abstrusus in natural environment. Vet Parasitol 2013;198:401-5.
Hobmaier M, Hobmaier A. Intermediate hosts of Aelurostrongylus abstrususof the cat. Proc Soc Exp Biol Med 1935;32:1641-7.
Mackerras MJ. Observations on the life history of the cat lungworm. Aelurostrongylus abstrusus (Railliet, 1898) (Nematoda: Metastrongylidae). Aust J Zool 1957;5:188-95.
Hansen AP, Skarbye LK, Vinther LM, Willesen JL, Pipper CB, Olsen CS et al. Occurrence and clinical significance of Aelurostrongylus abstrusus and other endoparasites in Danish cats. Vet Parasitol 2017;234:31-9.
Giannelli A, Colella V, Abramo F, do Nascimento Ramos RA, Falsone L, Brianti E et al. Release of lungworm larvae from snails in the environment: potential for alternative transmission pathways. PLoS Negl Trop Dis 2015;9:e0003722.
Tamponi C, Varcasia A, Brianti E, Pipia AP, Frau V, Pinna Parpaglia ML et al. New insights on metastrongyloid lungworms infecting cats of Sardinia, Italy. Vet Parasitol 2014;203:222-6.
Ribeiro VM, Lima WS. Larval production of cats infected and re-infected with Aelurostrongylus abstrusus (Nematoda: Protostrongylidae). Rev Méd Vét 2001;152:815-20.
Schnyder M, Di Cesare A, Basso W, Guscetti F, Riond B, Glaus T et al. Clinical, laboratory and pathological findings in cats experimentally infected with Aelurostrongylus abstrusus.Parasitol Res 2014;113:1425-33.
de Andrade-Porto SM, de Souza KCP, Cárdenas MQ, Roque RA, Pimpão DM, Araújo CS et al. Occurrence of Aelurostrongylus abstrusus (Railliet, 1898) larvae (Nematoda: Metastrongylidae) infectingAchatina (Lissachatina) fulica Bowdich, 1822 (Mollusca: Gastropoda) in the Amazon region. Acta Amazon 2012;42:245–50.
Gökpinar S, Yildiz K. [The effect of different temperatures on viability of Aelurostrongylus abstrusus first stage larvae in faeces of cats]. Turkiye Parazitol Derg 2010;34:102-5.
Lacava G, Zini E, Marchesotti F, Domenech O, Romano F, Manzocchi S et al. Computed tomography, radiology and echocardiography in cats naturally infected with Aelurostrongylus abstrusus. J Feline Med Surg 2017;19:446-53.
Traversa D, Di Cesare A, Milillo P, Iorio R, Otranto D. Aelurostrongylus abstrusus in a feline colony from central Italy: clinical features, diagnostic procedures and molecular characterization. Parasitol Res 2008;103:1191-6.
Crisi PE, Aste G, Traversa D, Di Cesare A, Febo E, Vignoli M et al. Single and mixed feline lungworm infections: clinical, radiographic and therapeutic features of 26 cases (2013–2015). J Feline Med Surg 2017;19:1017-29.
Gueldner EK, Gilli U, Strube C, Schnyder M. Seroprevalence, biogeographic distribution and risk factors for Aelurostrongylus abstrusus infections in Swiss cats. Vet Parasitol 2019;266:27-33.
Hawley MM, Johnson LR, Traversa D, Bucy D, Vernau KM, Vernau W. Respiratory distress associated with lungworm infection in a kitten. J Feline Med Surg Open Rep 2016;2: doi:10.1177/2055116916675801
Cavalera MA, Schnyder M, Gueldner EK, Furlanello T, Iatta R, Brianti E et al. Serological survey and risk factors of Aelurostrongylus abstrususinfection among owned cats in Italy. Parasitol Res 2019;118:2377-82.
Lacorcia L, Gasser RB, Anderson GA, Beveridge I. Comparison of bronchoalveolar lavage fluid examination and other diagnostic techniques with the Baermann technique for detection of naturally occurring Aelurostrongylus abstrususinfection in cats. J Am Vet Med Assoc 2009;235:43-9.
Traversa D, Di Cesare A. Diagnosis and management of lungworm infections in cats: cornerstones, dilemmas and new avenues. J Feline Med Surg 2016;18:7-20.
Taylor MA, Coop RL, Wall RL. Veterinary parasitology. 3rd ed. Oxford: Blackwell Publishing, 2007.
Grandi G, Comin A, Ibrahim O, Schaper R, Forshell U, Lind EO. Prevalence of helminth and coccidian parasites in Swedish outdoor cats and the first report of Aelurostrongylus abstrusus in Sweden: a coprological investigation. Acta Vet Scand 2017;59:19
Payo-Puente P, Botelho-Dinis M, Carvaja Urueña AM, Payo-Puente M, Gonzalo-Orden JM, Rojo-Vazquez FA. Prevalence study of the lungworm Aelurostrongylus abstrusus in stray cats of Portugal. J Feline Med Surg 2008;10:242-6.
Traversa D, Lia RP, Iorio R, Boari A, Paradies P, Capelli G et al. Diagnosis and risk factors of Aelurostrongylus abstrusus (Nematoda, Strongylida) infection in cats from Italy. Vet Parasitol 2008;153:182-6.
Genchi M, Ferrari N, Fonti P, De Francesco I, Piazza C, Viglietti A. Relation between Aelurostrongylus abstrusus larvae excretion, respiratory and radiographic signs in naturally infected cats. Vet Parasitol 2014;206:182-7.