Persisterende ductus arteriosus hos katt
Persisterende ductus arteriosus (PDA) er en sjelden forekommende medfødt hjertesykdom hos katt. Det er relativt få studier som beskriver tilstanden hos denne arten. Katter med PDA presenteres ofte først for veterinær når sykdommen er langt fremskredet, da det ikke alltid lar seg påvise en kontinuerlig auskulterbar bilyd. Mange katter kan også ha flere kongenitale hjertedefekter samtidig. Det kan synes som om katt tolererer PDA langt bedre enn hva som er tilfellet for hund. I denne artikkelen beskrives kliniske tegn og utredning ved bruk av ekkokardiografi, røntgen og CT hos en katt med PDA.
Veterinær
Spesialistkandidat
AniCura Dyreklinikk Drammen
Veterinær, PhD
Spesialist i smådyrsykdommer, hund og katt
Master of Companion Animal Cardiology (MS CACS)
AniCura Dyreklinikken Telemark
Innledning
Forekomsten av kongenital hjertesykdom hos katt estimeres til å variere fra 0,2-15 % (1,2). De vanligst forekommende kongenitale hjertelidelser hos denne arten er ventrikkelseptum defekt, trikuspidal dysplasi, pulmonal stenose, atrie-septumdefekt og persisterende ductus arteriosus (PDA) (2-5). Forekomsten av PDA hos katt er rapportert å være lav sammenlignet med hos hund hvor PDA er en av de hyppigst rapporterte kongenitale hjertesydommene (6). Prevalensen for PDA hos katt varierer fra 3-11 % og hos hund fra 11-30 % av de kongenitale hjertesykdommene (1,6).
Det meste av veterinærlitteraturen om PDA beskriver PDA hos hund, svært lite informasjon foreligger om tilstanden hos katt. I den litteraturen som finnes om PDA hos katt, går det frem at det er betydelige forskjeller mellom hund og katt når det gjelder patofysiologi, klinisk manifestasjon og progresjon. Hos hund er det mest åpenbare kliniske funnet i de fleste tilfeller tilstedeværelsen av en karakteristisk kontinuerlig hjertebilyd, men dette er ikke alltid tilfelle hos katt. Kontinuerlig bilyd ble hørt kun hos 55 %, 35 % og 32 % av kattene med PDA i tre studier (7-9). Det viser seg også at katter oftere kan ha flere kongenitale hjertedefekter samtidig, til forskjell fra hva som er tilfellet hos hund (7,8). I en undersøkelse ble det rapportert at 54,5 % av katter med kongenitale hjertesykdom hadde multiple hjertedefekter (8). En annen studie viste en prevalens på 26 % (7). Høy prevalens av multiple hjertedefekter hos katt gjør diagnostikk og behandling av PDA spesielt utfordrende sammenlignet med hos hund. Katters relativt sedate natur og lave forekomst av kliniske tegn assosiert med preklinisk PDA, kan føre til at katter med PDA først presenteres for veterinær når langt fremskreden sykdom foreligger.
PDA er en kongenital defekt hvor ductus arteriosus ikke lukkes som den skal etter fødsel (9). Dette fører til at blodet shuntes fra aorta til pulmonalarterien og kalles derfor ofte en venstre til høyre shunt. Denne resirkuleringen av blod fra aorta til den pulmonale sirkulasjonen kan resultere i oversirkulasjon av pulmonal vaskulatur, noe som over tid vil føre til overbelastning av venstre forkammer og hovedkammer, og senere utvikling av venstresidig hjertesvikt. PDA kan også føre til utvikling av pulmonal arteriell hypertensjon (PAH) og hypertrofi av høyre hovedkammer. I en slik situasjon kan trykket i den pulmonale arterielle sirkulasjonen etter hvert utligne eller overgå trykket i aorta. Blodet vil da shuntes i motsatt retning, fra pulmonalarterien til aorta, og kalles reversert PDA eller en høyre til venstre shunt. I den situasjonen vil venøst blod blande seg med oksygenert blod i aorta. Den patofysiologiske prosessen som fører til PAH og shuntreversering er kjent som Eisenmengers syndrom.
Hos hund er ubehandlet PDA assosiert med høy mortalitet, først og fremst grunnet utvikling av venstresidig hjertesvikt. PAH og shuntreversering forekommer forholdsvis sjeldent hos hund
(1-6 %) (6). Katter utvikler PAH hyppigere enn hunder, med prevalens på 37 % i en studie og 45,7 % i en annen (8,10). Totalt 15-17 % av kattene rapporteres også å utvikle bidireksjonell og etter hvert shuntreversering av blodet i PDA (6,8)
Denne artikkelen beskriver en kasuistikk og diskuterer tilgjengelig litteratur for å belyse etiologi, patofysiologi og kliniske funn ved PDA hos katt. Kasuistikken beskriver kardiovaskulære og hemodynamiske forandringer forårsaket av ubehandlet PDA ved hjelp av ekkokardiografi, røntgen, biokjemiske analyser og CT-undersøkelse. Formålet er å presentere kunnskap om diagnostikk og behandlingsmuligheter for PDA hos katt.
Kasuistikk
Første konsultasjon
Signalement og anamnese
En ett år gammel ukastrert hunnkatt av blandingsrase ble presentert for utredning av bilyd over hjertet. Katten hadde ingen kliniske tegn på sykdom, men henvisende veterinær ønsket hjerteundersøkelse før katten skulle under anestesi for kastrering.
Klinisk undersøkelse
Katten ble vurdert som normalvektig (BCS 5/9), med kvikk og oppvakt mentalitet. Respirasjonsmønsteret ble vurdert som uanstrengt kosto-abdominalt. En kontinuerlig bilyd, grad 5/6, kunne auskulteres over kattens hjertefelt, med punkta maxima (PM) over venstre kraniale sternum. Hjertefrekvensen var >200/minutt. Femoral puls var fyldig, jevn og samsvarte med hjertefrekvens. Slimhinnene var rosa med kapillærfylningstid < 1,5 sekund. Det kunne ikke påvises distensjon eller pulsering i vena jugularis.
Diagnostisk undersøkelse
Ekkokardiografi
Standard ekkokardiografisk undersøkelse ble utført i høyre og venstre sideleie, med ultralydmaskin GE Vivid E70 og probe 12 S (4-12 MHz). Ultralydundersøkelsen viste kardiomegali med eksentrisk hypertrofi av venstre hovedkammer og mild dilatasjon av venstre forkammer (Tabell 1, Figur 1a). Pulmonalarterien var dilatert sammenlignet med aorta og det ble påvist en turbulent, kontinuerlig retrograd blodstrøm ved bruk av farge Doppler. Dette er diagnostisk for PDA. Ved bruk av Doppler ble maksimal systolisk og diastolisk hastighet målt til henholdsvis 3,63 m/s og 1,63 m/s (Figur 2a). PDA ostium og morfologi ble ikke vurdert ved denne undersøkelsen. Systolisk trykkgradient mellom aorta og pulmonalarterien ble beregnet ved bruk av modifisert Bernoulli formel til å være 53 mmHg. Det ble ikke funnet andre kongenitale hjertedefekter.
Kirurgisk lukking av PDA ble anbefalt før kastrering, men dette var ikke aktuelt for eier på daværende tidspunkt. Ingen medisinsk behandling ble iverksatt.
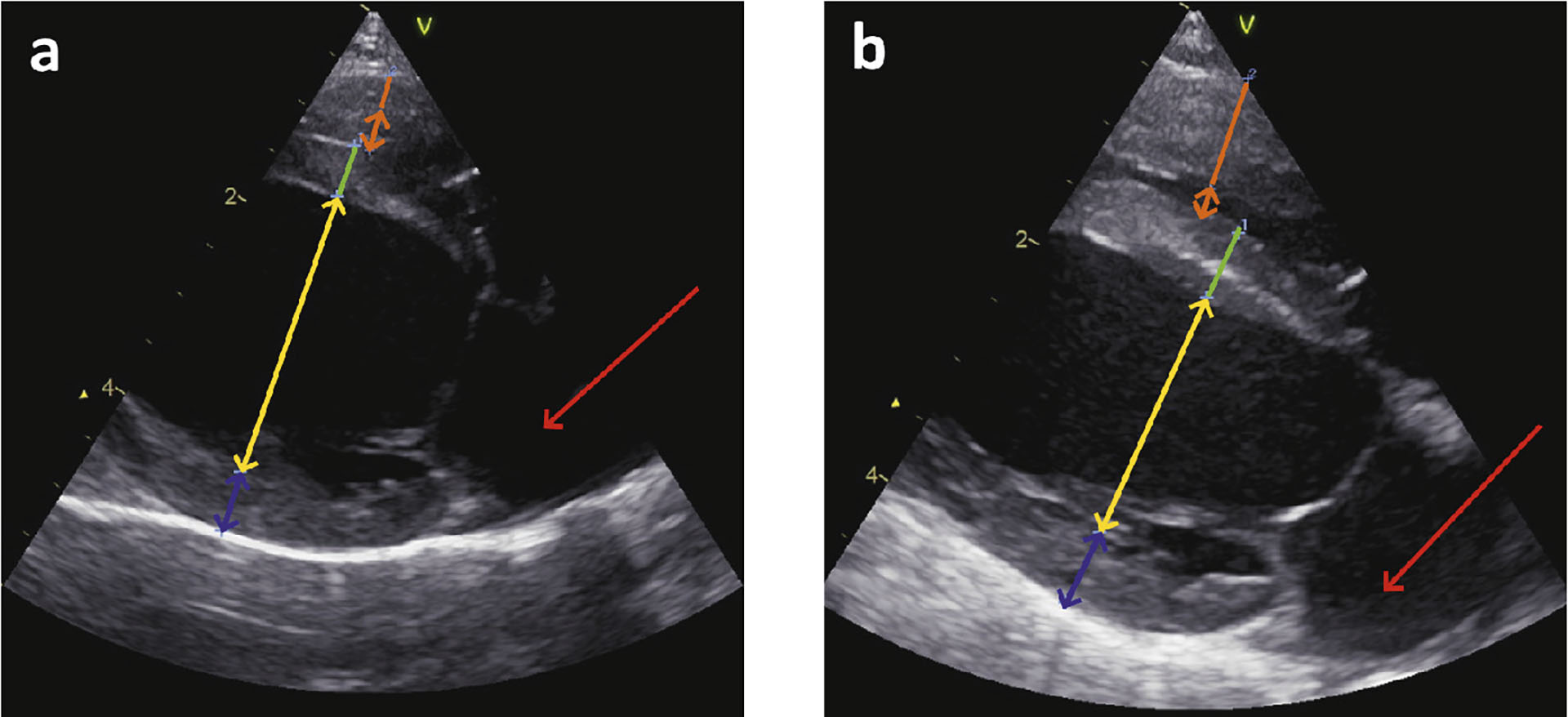
Figur 1. Mål av høyre og venstre hovedkammer tatt i høyresidig lengdeakse i slutten av diastolen.
a) Første undersøkelse viste en eksentrisk hypertrofi av venstre hovedkammer (Gul pil) og mild dilatasjon av venstre forkammer (rød pil).
b) Tre år senere ble det påvist konsentrisk hypertrofi av høyre hovedkammer (Oransje strek) med normalisering av venstre hovedkammer (Gul pil).
Blå pil: LVPWd (left ventricular posterior wall thickness in diastole)
Gul pil: LVIDd (left ventricular internal diameter in diastole)
Grønn strek: IVSd (intraventricular septum diastole)
Oransje pil: RVIDd (right ventricular internal diameter diastole)
Oransje strek: RVAWd (right ventricular anterior wall thickness in diastole)
Rød pil: LA (left atrium)
Parameter |
Verdi første undersøkelse |
Verdi 3 år senere |
Referanse (11) |
|---|---|---|---|
Bilyd grad |
5/6 |
2/6 |
0/6 |
Blodtrykk (mmHg) |
- |
130/80 |
80-140/55-75 |
Vekt (kg) |
- |
5,0 |
- |
LA/Ao |
1,65 |
1,46 |
1,13-1,68 |
LVIDd (mm) |
26,2 |
19,2 |
11,5-17,8 |
LVIDs (mm) |
16,0 |
12,5 |
2,6-10,9 |
RVAWd (mm) |
4,1 |
9,5 |
1,7-2,7 |
RVIDd (mm) |
4,7 |
2,9 |
0,9-6,7 |
RVAWd/LVPWd |
0,93 |
1.7 |
- |
PA/Ao |
1,14 |
1,18 |
1,0 |
FS (%) |
43 |
31 |
29-49 |
ET/AT |
- |
0,18 |
> 0,35 |
PDA systolisk blodstrøm (m/s) |
3,63 |
1,39 |
5-6 |
PDA diastolisk blodstrøm (m/s) |
1,63 |
0,69 |
- |
PDA ostium (mm) |
- |
4,5 |
- |
TV insuffisiens (m/s) |
- |
3,16* |
<3,00 |
Trykkgradient Ao/MPA (mmHg) |
53 |
7,7 |
- |
*Unormalt lavt grunnet at det ikke lot seg gjøre å få Doppleren parallellt med blodstrømmen.
Forkortelser: LA: left atrium, Ao: aorta, LVIDd: left ventricle internal diameter in diastole, LVIDs: left ventricle internal diameter in systole, RVAWd: right ventricle anterior wall diastole, RVIDd: right ventricle internal diameter diastole, LVPWd: left ventricular posterior wall thickness in diastole, PA: pulmonary artery, FS: fractional shortening, ET/AT: ejection time/acceleration time, PDA: patent ductus arteriosus, TV: tricuspid valves, MPA: main pulmonary artery
Ny konsultasjon
Anamnese
Tre år etter forrige undersøkelse ønsket eier en ny vurdering av hjertet med hensyn på kastrering. Eier beskrev katten som allment frisk og aktiv.
Klinisk undersøkelse
Katten hadde normal allmenntilstand og opplevdes kvikk og oppvakt. Den var mildt overvektig med en vekt på 5 kg (BCS 6/9). Ved auskultasjon hørtes en mild kontinuerlig bilyd grad 2/6, med PM ved venstre kraniale sternum. Hjertefrekvensen var jevn på 210/minutt. Femoral puls opplevdes normal i styrke, og samsvarte med auskultert hjerte-frekvens. Respirasjonsfrekvens var på 27/minutt, uanstrengt kosto-abdominal. Slimhinner var rosa og kapillærfylningstid var < 1,5 sekund. Det var ingen synlig distensjon av vena jugularis. Hydreringsstatus ble vurdert som normal. Sammenlignet med undersøkelsen for 3 år siden, var bilyden over hjertet betydelig svakere og vanskeligere å oppdage. Denne endringen i grad av bilyd gjorde at det ble ansett nødvendig å foreta ny ekkokardiografi i tillegg til røntgen og blodprøver.
Diagnostiske undersøkelser
Ekkokardiografi
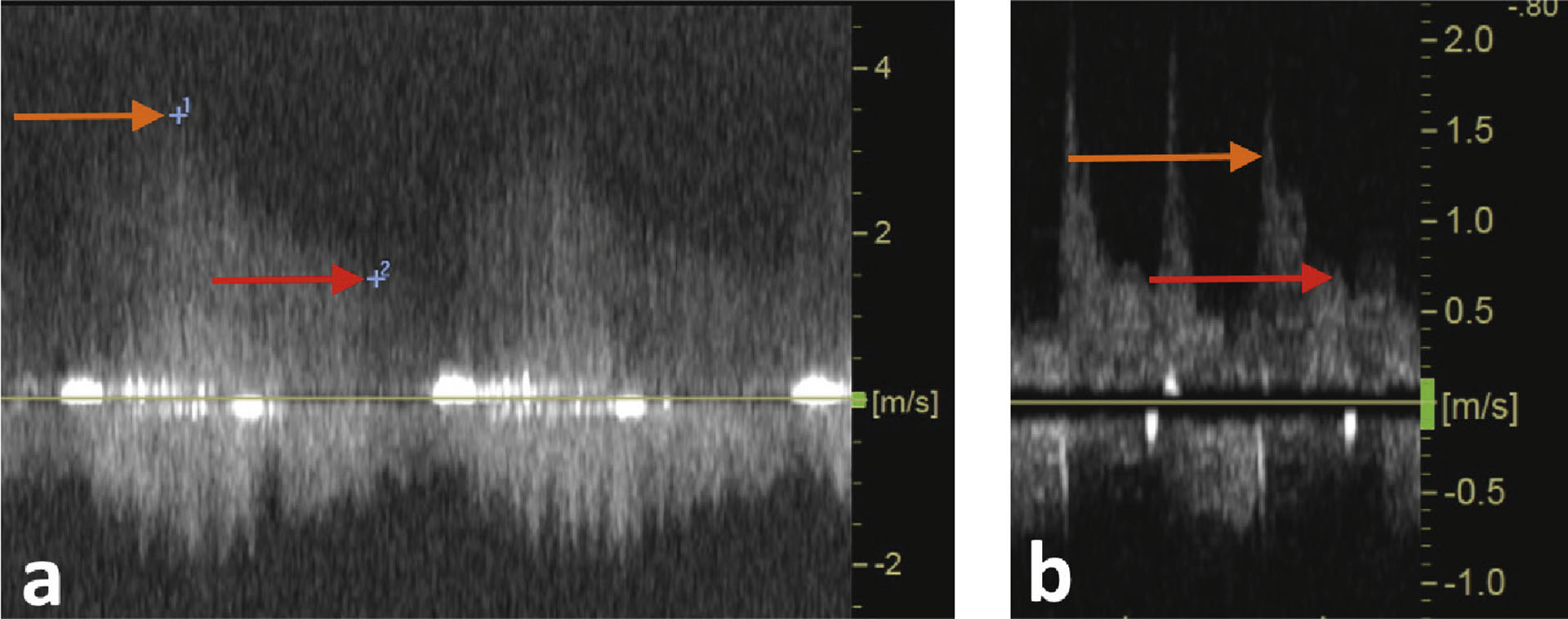
Figur 2. Doppler over PDA. a) Mål tatt ved første undersøkelse b) Mål tatt tre år senere. Obs: forskjellig skalering på figur a og b.Maksimal systolisk hastighet (oransje pil) ble målt til 3,63 m/s ved første undersøkelse og 1,39 m/s tre år senere. Maksimal diastolisk hastighet (rød pil) ble målt til 1,63 m/s ved første undersøkelse og 0,69 m/s tre år senere.
Katten ble sedert med butorphanol 0,2 mg/kg s.c. (totalt 1 mg). Likevel tolererte katten ikke elektrode-plassering for EKG. Undersøkelsen ble derfor utført uten EKG. Blodtrykk ble målt med oscillometrisk trykkmåling til et gjennomsnitt på 130/78 mmHg. Den ekkokardiografiske undersøkelsen ble utført med samme maskin som tre år tidligere.
Ekkokardiografi i høyresidig parasternal lengdeakse viste kun mildt dilatert venstre hovedkammer. Høyre hovedkammervegg viste en markert konsentrisk hypertrofi sammenlignet med funnene tre år tidligere (Tabell 1, Figur 1b). Systolisk- og i mindre grad diastolisk avflating av septum ble påvist både i høyre parasternale lengdeakse og i høyre parasternale kortakse, forenlig med økt høyreventrikulært trykk i både systole og diastole (Figur 1b,3). Mitral- (MV) og trikuspidalklaffene (TV) ble vurdert morfologisk normale. Det ble påvist trikuspidal insuffisiens målt til 3,16 m/s. Ved bruk av Doppler i pulmonalarterien ble det funnet en brattere enn normalt akselerasjonskurve, og ejeksjonstid over aksellerasjonstid (ET/AT) ble målt til 0,18 (normalt > 0,35). Forholdet mellom pulmonalarterien og aorta sine diametre var 1,18 (normalt 1,00). Det ble påvist kontinuerlig turbulent blodstrøm ved bruk av farge Doppler i pulmonalarterien med retning mot pulmonalklaff. Turbulensen fylte omtrent 30 % av pulmonalarterien, og kom fra et punkt proksimalt for bifurkasjonen av pulmonalarterien (Figur 4). Posisjon og funn var forenlig med PDA. PDA ostium ble målt til 4,5 mm, men morfologien av shunten var vanskelig å vurdere. Systolisk og diastolisk hastighet over PDA ble målt med Doppler til henholdsvis til 1,39 m/s og 0,69 m/s (Figur 2b).
Den ekkokardiografiske under-søkelsen viste nå betydelige endringer sammenlignet med undersøkelsen for tre år siden. Hypertrofi av høyre hovedkammer ga sterke indisier på at katten hadde utviklet en pulmonal arteriell hypertensjon. Reversert eller bidireksjonal PDA kunne ikke utelukkes da maksimal hastighet til den retrograde blodstrømmen i pulmonalarterien nå var på bare 1,39 m/s (tre år tidligere: 3,63 m/s). Det ble derfor besluttet å gjennomføre en boblekontraststudie for å vurdere om shunten hadde reversert. Reversert PDA kunne ikke påvises, da det ikke ble funnet bobler i abdominal aorta.
Røntgenundersøkelse thorax
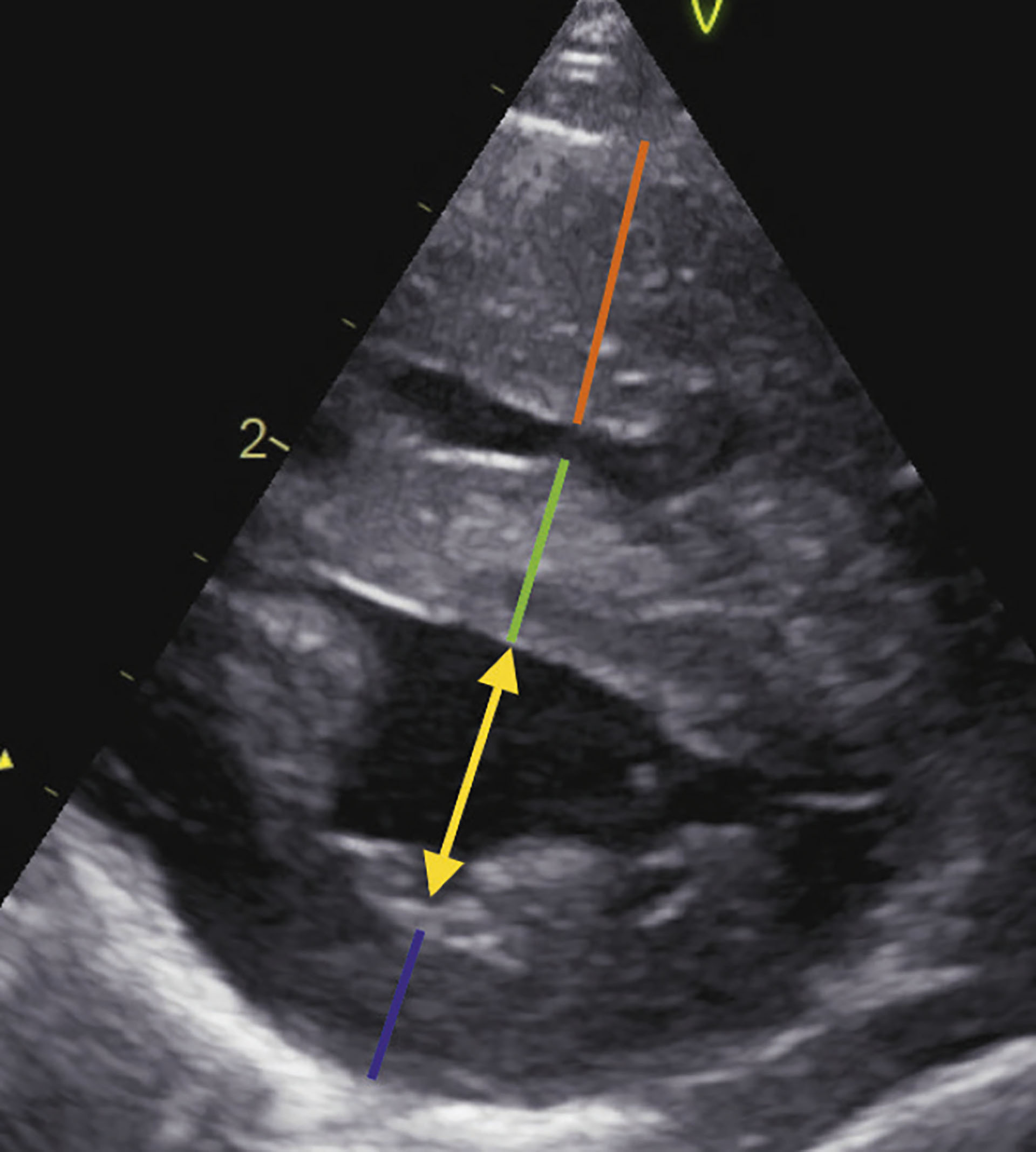
Figur 3. Figuren er fra ultralydundersøkelsen ved siste undersøkelse. Høyresidig kortakse i systolen vises avflating av septum (grønn strek) og konsentrisk hypertrofi av høyre hovedkammer (grønn og oransje strek).
Blå strek: LVPWs
Gul pil: LVIDs
Grønn strek: IVSs
Oransje strek: RVAWs
Røntgen av thorax viste kardiomegali med «vertebral heart score» (VHS) på 9,5 (normalt 6,7-8,1) (12). Høyre hovedkammer og forkammer var forstørret, og hjertet ble vurdert til å ha økt sternal kontakt. Det kunne ses en dorsal heving av trachea. I lateral og dorsoventral projeksjon kunne det observeres at den kraniale pulmonalarterien var større enn pulmonalvenen (Figur 5,6). Kaudal lobar pulmonærarterie ble vurdert som mildt forstørret. Disse funnene indikerte arteriell pulmonal hypertensjon. Kaudal vena cava var ikke synlig dilatert, noe som talte mot en reversert PDA. Det forelå ingen funn av pleural effusjon eller pulmonalt ødem.
Blodanalyser
Hematologisk undersøkelse viste en hematokrit på 38,9 % (RI: 30,3 % – 52,3 %). De andre hematologiske og biokjemiske analysene var alle innenfor referanseintervallet (undersøkelsene utført på IDEXX Catalyst, IDEXX ProCyte). Blodprøve ble også sendt til eksternt laboratorium (IDEXX Reference Laboratories) for måling av troponin og proBNP. Begge parametrene viste en markert økning. Troponin var på 0,33 ng/mL (RI: <0,06 ng/mL) og proBNP var 351 pmol/L (RI: < 100 pmol/L).
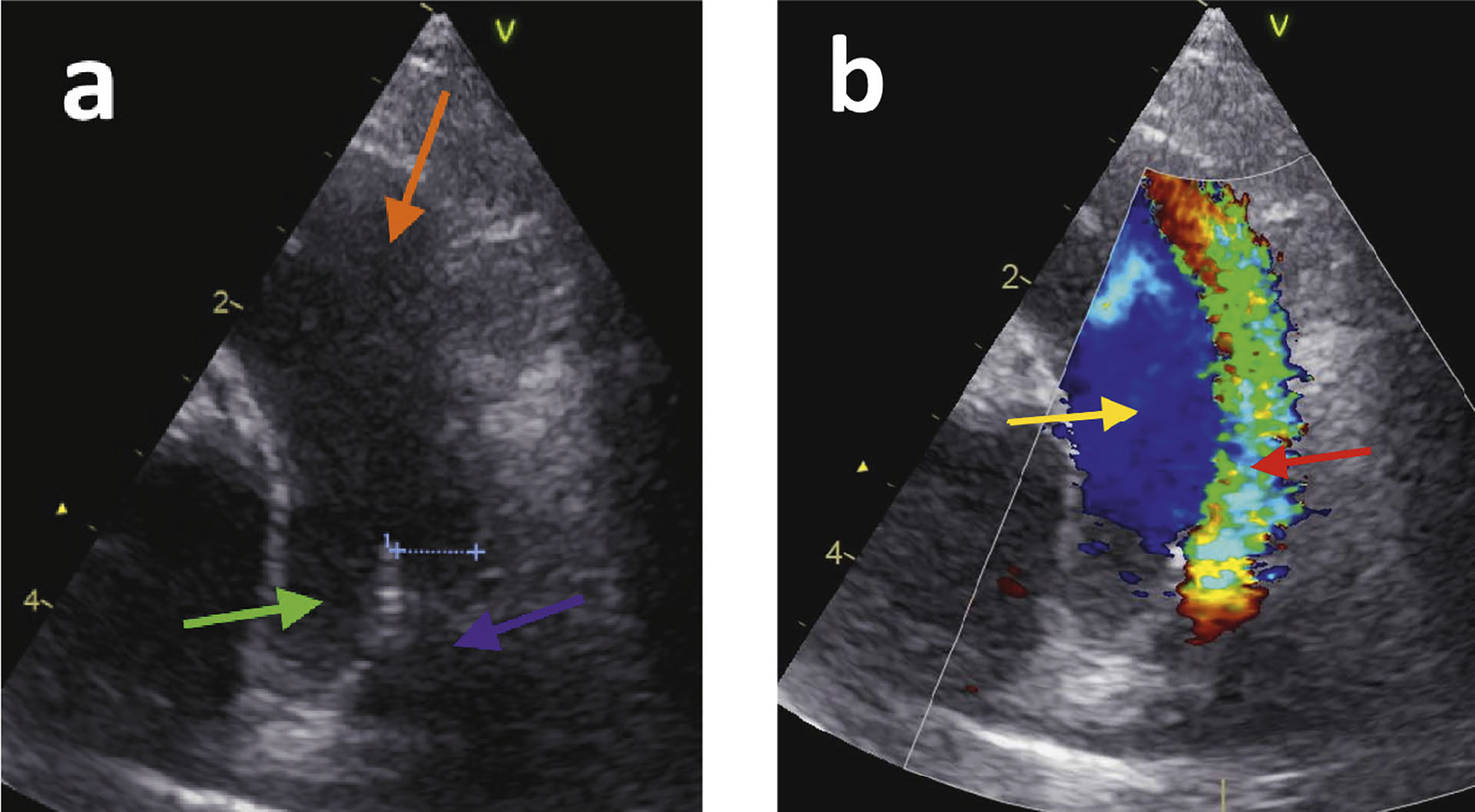
Figur 4. Figurene er fra ultralydundersøkelse ved siste undersøkelse. Høyre parasternal kortakse for optimalisering av pulmonalarterien: a) Hoved pulmonalarterien (oransje pil), PDA ostium (blå stiplet linje) og PDA ampulla (blå pil). Høyre pulmonalarterie (grønn pil).
b) Samme bilde som i Figur 4a med farge Doppler. PDA turbulent blodstrøm kan sees motstrøms (rød pil). Normal blodstrøm i pulmonalarterie (gul pil).
CT undersøkelse
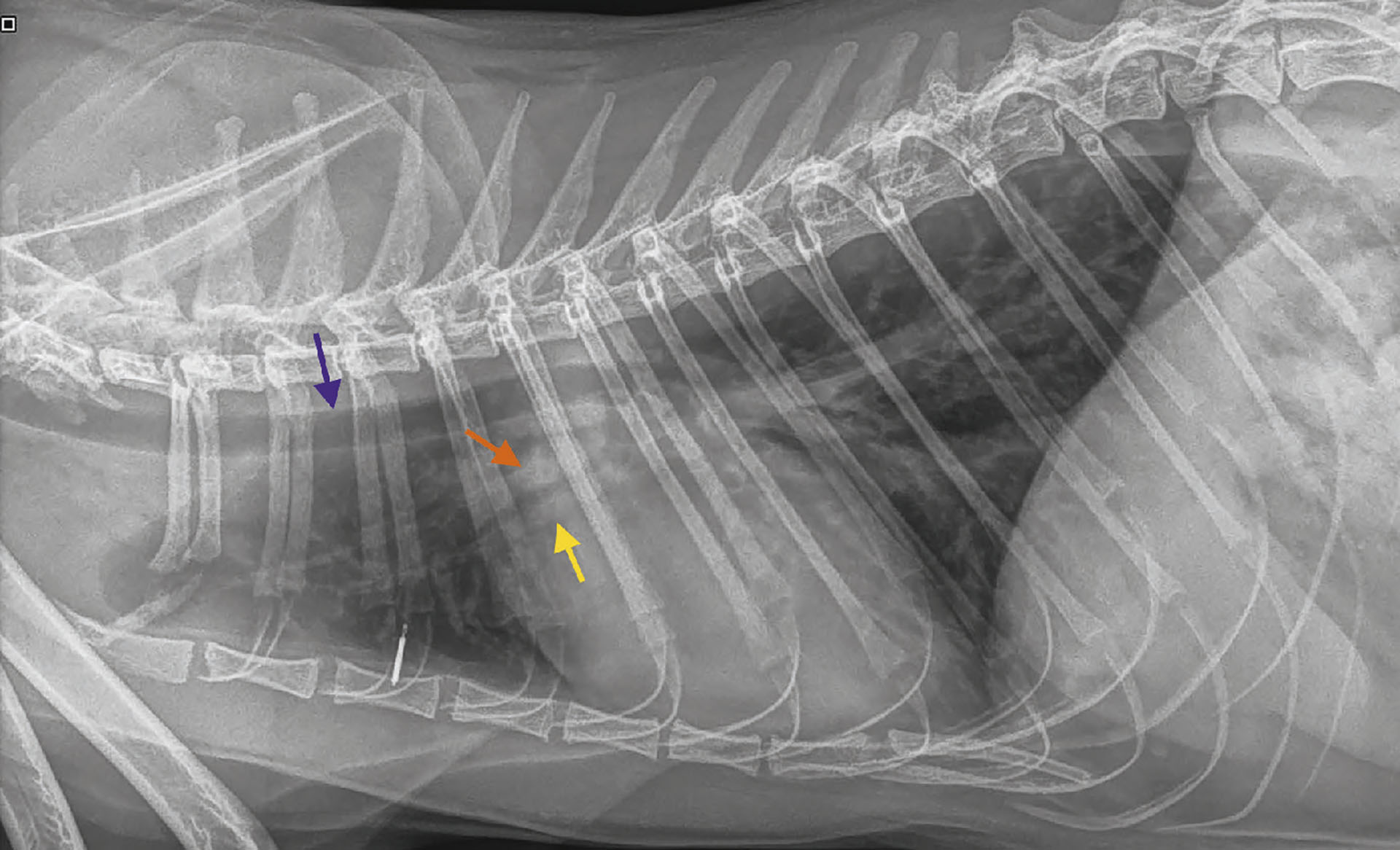
Figur 5. Høyrelateralt røntgenbilde av thorax viste ved siste undersøkelse dilatasjon av pulmonalarterie (oransje pil), sammenlignet med pulmonalvene (gul pil). Trachea er dorsalt elevert (blå pil).
Den ekkokardiografiske undersøkelsen ga ikke adekvat informasjon om PDA-morfologien. Som et ledd i kirurgisk planlegging av lukking av PDA ble det derfor besluttet å foreta en CT-undersøkelse for vurdering av PDA-morfologi og grad av pulmonal hypertensjon. Grunnet kattens alder og uttalt remodellering av hjertet påvist ved den ekkokardiografiske undersøkelsen, ble denne undersøkelsen ansett som en viktig del i vurdering av hvilken behandling som skulle anbefales.
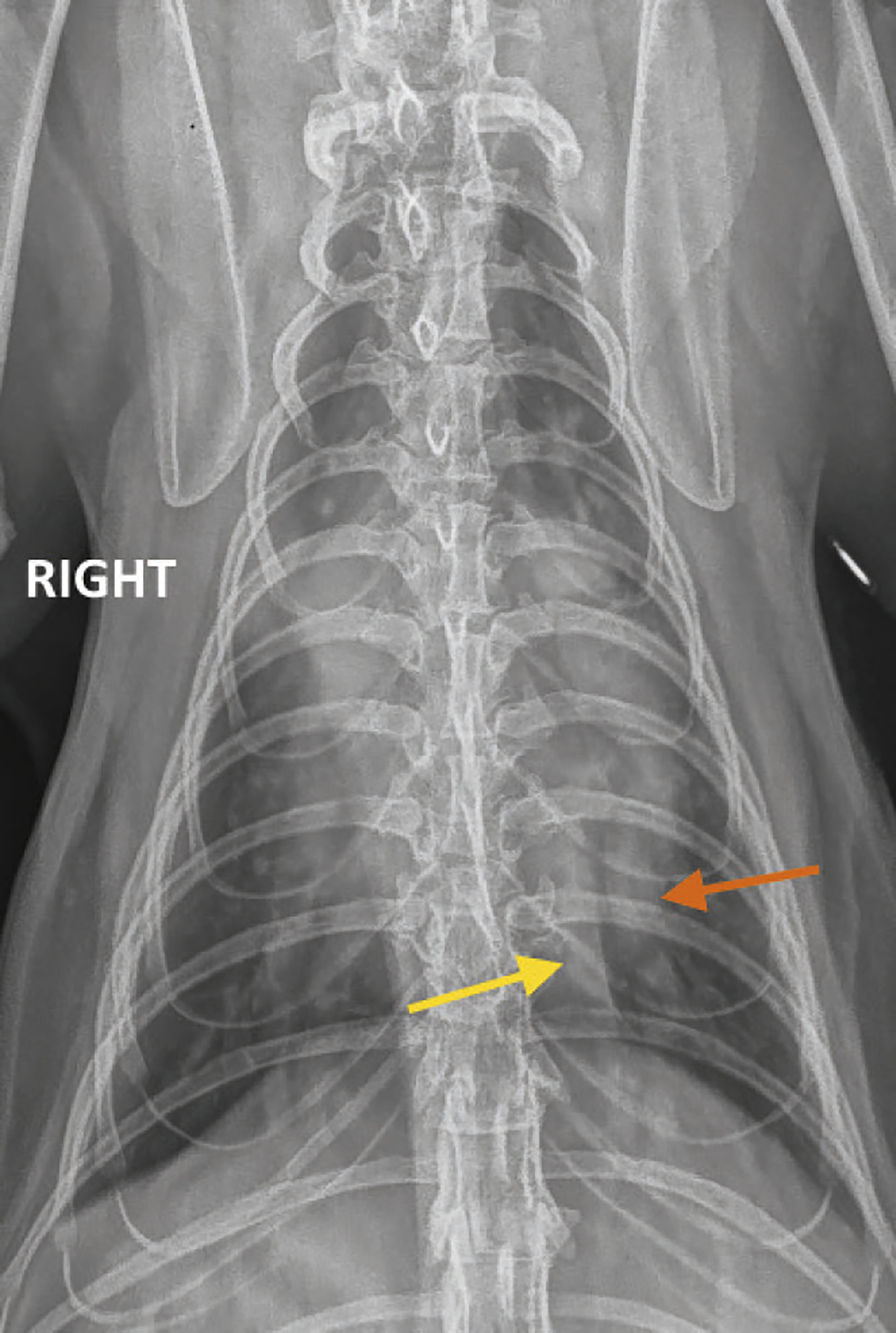
Figur 6. Dorsoventralt røntgenbilde av thorax viste ved siste undersøkelse dilatasjon av pulmonalarterie (oransje pil) sammenlignet med pulmonalvene (gul pil).
Det ble påvist kardiomegali og kommunikasjon mellom aorta og pulmonalarterien (PDA). PDA ostiumdiameter ble målt til 5 mm, som stemmer overens med mål tatt under ultralydundersøkelsen. PDA-morfologi viste lite/ingen innsnevring ved inngang til pulmonalarterien, og var mest forenlig med PDA type III hos hund (13). Kontrast var mest oppkonsentrert i venstre hovedkammer og aorta, og minst i pulmonalarterien. Høyre pulmonalarterie viste økt diameter sammenlignet med korresponderende pulmonalvene (Figur 7,8). Reversert PDA blodstrøm kunne ikke påvises, men bidireksjonell blodflyt kunne ikke utelukkes. Dette funnet er i overenstemmelse med resultatet av boblekontrast studien.
PDA-morfologi type III gjorde katten uegnet for transarteriell okklusjon. Derfor ble åpen thorax-kirurgi med ligering av ductus eller medisinsk behandling formidlet til eier som behandlingsalternativer. Katten ble i samråd med eier startet på sildenafil (0,25 mg/kg p.o. BID) for å redusere PAH før operasjon og hindre reversering av shunten.
Katten ble avlivet kort tid etter undersøkelsen av årsaker som ikke var knyttet til hjertesykdommen.
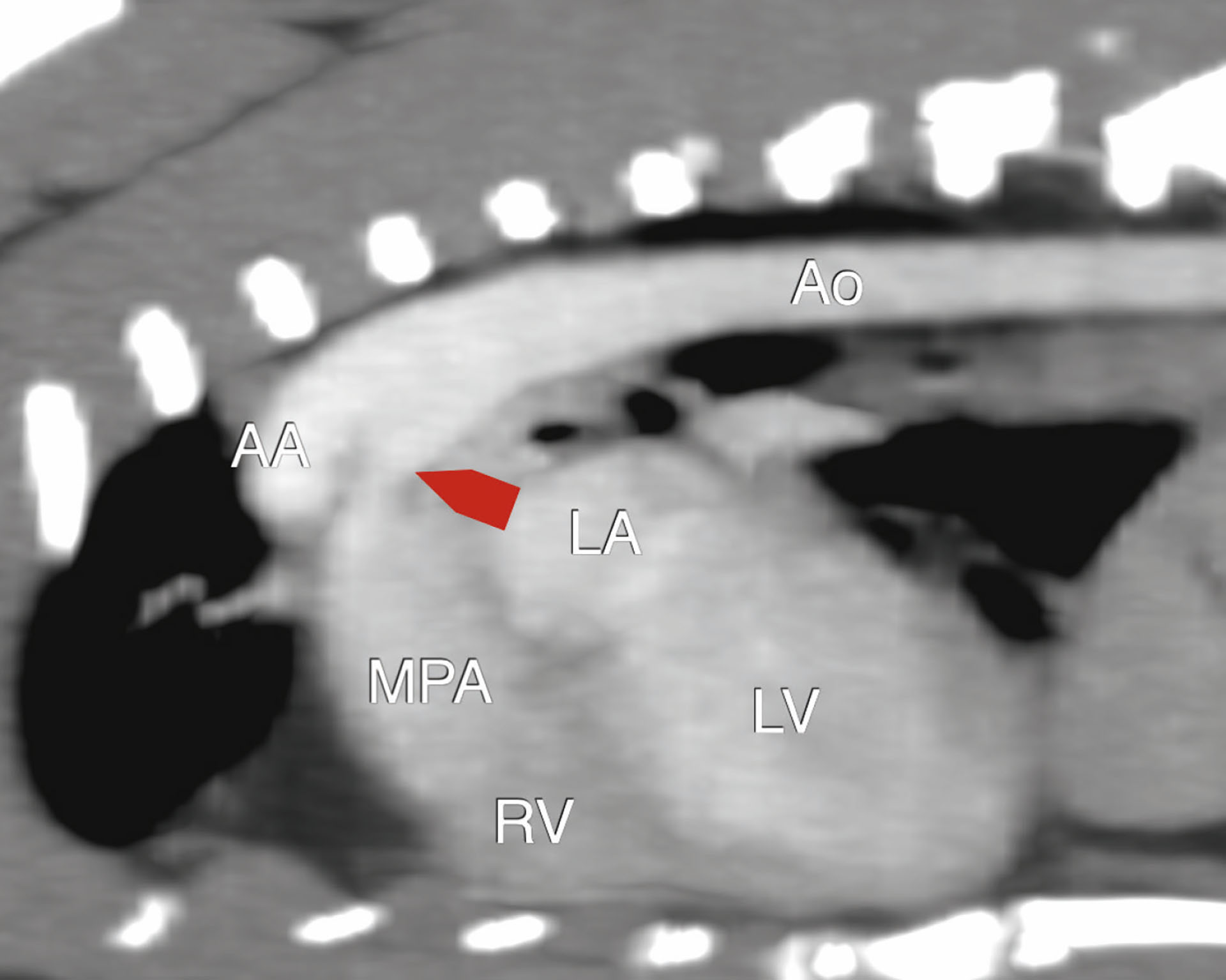
Figur 7. Sagittalplan viste PDA (rød pil) med intens kontrast i aorta (Ao og AA), og mindre intens kontrast i pulmonalarterien (MPA).
Ao: Aorta, AA: Ascending aorta, MPA: mean pulmonary artery, RV: right ventricle, LV: left ventricle, LA: left atrium.
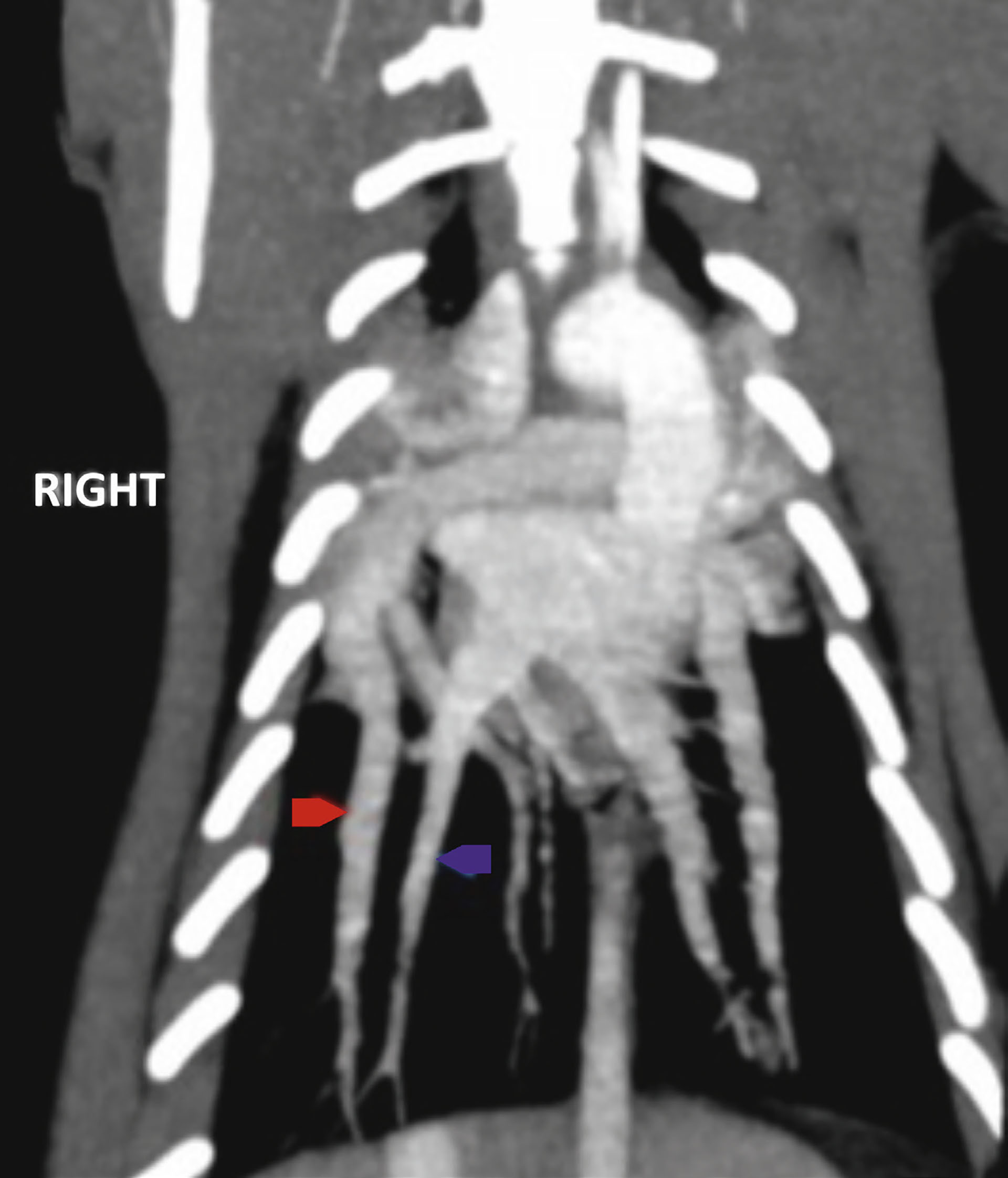
Figur 8. Dorsal plan viste økt bredde på høyre kaudal lobar arterie (rød pil) sammenlignet med korresponderende vene (blå pil). På venstre kaudale lungelobus er arterie og vene av lik bredde.
Diskusjon
Katten i denne kasuistikken ble utredet for hjertesykdom grunnet en auskulterbar kontinuerlig bilyd som ga mistanke om PDA, noe som ble bekreftet ved ekkokardiografisk undersøkelse. Pasienten hadde ingen kliniske tegn på hjerterelatert sykdom ved to konsultasjoner med tre års mellomrom. Undersøkelser tre år etter at PDA ble diagnostisert første gang viste imidlertid at katten hadde utviklet en hypertrofi av høyre hovedkammer og PAH. Katten hadde ikke reversert eller utviklet venstresidig hjertesvikt. Dette er i tråd med hvordan PDA ofte arter seg hos katt til forskjell fra hos hund (8,14).
Kliniske tegn rapportert hos katter med PDA er dårlig tilvekst, dyspné, treningsintoleranse, synkope og vekttap (8). Disse kliniske tegnene ble ikke observert hos katten i denne kasuistikken, som ble undersøkt med ultralyd på bakgrunn av en auskulterbar bilyd over hjertet. Det ble heller ikke funnet andre kongenitale hjertelidelser. Til tross for at det ble påvist det som vurderes som en alvorlig fremskreden hjertesykdom, viste katten ingen tegn til redusert livskvalitet.
Det er ikke påvist noen kjønnsforskjell for PDA hos katter. Dette i kontrast til hunder hvor tisper er overrepresentert 3:1 (9). Disse tallene kan imidlertid være misvisende da det foreligger svært få studier på katter, noe som gir tallene tvilsom statistisk verdi.
Patofysiologi
I fosterstadiet er det placenta som fungerer som fosterets “lunger”. Ved fødsel skjer det endringer i det sirkulatoriske systemet på grunn av erstatning av placenta som et oksygenutvekslende organ til funksjonelle lunger som nå skal være oksygenleverandøren til den nyfødte. Etter fødsel vil muskulaturen i veggen av ductus arteriosus kontraheres, noe som resulterer i at dette blodkaret etter hvert atrofierer og blir en binde-vevsstreng. Når lukkingen av ductus arteriosus ikke skjer som normalt, oppstår PDA. Det systolisk trykket i en normal lungearterie overstiger sjelden 25 mmHg, mens trykket i aorta viser gjennomsnittlig 120 mmHg. Denne trykkforskjellen på nesten 100 mmHg vil føre til at blodet beveger seg i høy hastighet fra aorta, gjennom ductus arteriosus og inn i pulmonalarterien. Siden trykket i aorta er høyere i både systole og diastole, vil dette føre til en kontinuerlig shunting av blod fra aorta til pulmonalarterien (15). En kontinuerlig blodstrøm gjennom ductus arterisosus ble verifisert hos katten i dette kasuset. Først ved auskultasjon av en kontinuerlig bilyd og deretter måling av en retrograd kontinuerlig blodstrøm i pulmonalarterien.
En konsekvens av venstre til høyre shuntet PDA, er at blod «resirkuleres» i lungekretsløpet. Dette fører til en oversirkulasjon av pulmonal vaskulatur. Venstre forkammer og hovedkammer vil dilateres som en respons på denne økte returen av blod fra lungene. Kronisk økt trykk i pulmonal vaskulatur kan føre til reaktiv vasokonstriksjon, progressiv hypertrofi og proliferasjon av små og medium blodkar i lungevevet. Over tid gir dette en progredierende innsnevring av pulmonal vaskulatur med resulterende PAH (6,10). Denne reaksjonen kan forstås som en beskyttelsesmekanisme, hvor lungevaskulatur forsøker å redusere mengden blod den mottar. Katten beskrevet i denne kasuistikken viste ved den andre undersøkelsen tre år etter den første tegn på å ha utviklet pulmonal hypertensjon og høyre ventrikulær hypertrofi (Figur 1b).
Hvis trykket i pulmonal arteriell sirkulasjon på et tidspunkt utligner, eller overgår trykket i aorta, kan det forekomme en bidireksjonell eller reversert shunt over ductus arteriosus. Dette er en tilstand kjent som reversert PDA, eller en høyre til venstre shuntet PDA. Ved en slik tilstand vil trykkforskjellen mellom aorta og lungearterien reduseres, og bilydens intensitet vil derfor også bli betydelig redusert eller totalt forsvinne. En begynnende reversering av PDA kan forklare at katten ved den andre og siste undersøkelsen hadde en auskulterbar bilyd med en langt lavere intensitet (2/6) enn tre år tidligere (5/6). Denne antagelsen støttes også av at maksimal hastighet målt med doppler over PDA var redusert fra 3,63 m/s ved første undersøkelse til 1,39 m/s tre år senere (Figur 2).
Påvisning av PAH kan være utfordrende, og baseres på kalkulasjon av trykkgradient mellom kamrene i hjertets høyre side og trykkgradient målt mellom pulmonalarterien og aorta. En vanlig måte å vurdere grad av PAH er ved å måle trikuspidal regurgitering. PAH er usannsynlig når regurgitering over trikuspidalklaffen er < 3 m/s. Det ble målt en trikuspidal regurgitering på 3,16 m/s hos katten i kasuistikken. Antagelig er denne verdien betydelig høyere grunnet dårlig samstilling med blodflyt på grunn av mye bevegelse og kattens stressede adferd ved undersøkelsen. Hos hund med PDA vil en trykkgradient mellom pulmonalarterien og aorta på < 50 mmHg også indikere PAH (10). Trykkgradienten mellom pulmonalarterien og aorta hos katten i denne kasuistikken ble beregnet til å være 7,7 mmHg, som er nær trykkutligning. Dette sammen med at den ekkokardiografiske undersøkelsen viste hypertrofi av RV, støtter at katten hadde utviklet PAH. Blodstrøm fra pulmonalarterien til aorta (høyre til venstre shunt), lot seg ikke påvise ved verken farge Doppler eller boblekontrast ekkokardiografi, men CT rapporten utelukket ikke at det kunne forekomme en grad av bidireksjonell blodstrøm gjennom PDA hos katten i kasuistikken.
Ved en reversert PDA vil uoksygenert blod shuntes fra pulmonalarterien til aorta, noe som fører til reaktiv erytropoiese som respons på kronisk hypoksi. Dette fører til polycytemi og hyperviskositet, og en klassisk «kaudal cyanose». Hos hunder er det rapportert muskelsvakhet og kollaps i bakben, men dette er ikke beskrevet hos katt (6,16). En mulig forklaring på dette er katters evne til en aerob sedat livsstil (6). Hematologiske analyser hos katten i kasuistikken ga ingen funn forenlig med polycytemi, som forventes ved en høyre til venstre shuntet PDA. Det spekuleres imidlertid om polycytemi hos katter med høyre til venstre shuntet hjertesykdom forekommer sjeldnere enn hos hund (17). Forskjeller i katters hemoglobin og oksygen-dissosiasjonskurve gjør at katter lettere kan frigjøre større mengder oksygen i hypoksiske tilstander (17). Dette kan muligens føre til et forlenget tidsintervall før hypoksi fører til økt produksjon av erytropoietin som gir polycytemi og hyperviskositet av blod (17). Hyperviskositet av blod hos hunder med reversert PDA er assosiert med betydelige komplikasjoner og redusert livskvalitet (6). Katten i denne kasuistikken hadde ikke utviklet polycytemi som følge av hypoksi, noe som støtter at eventuell bidireksjonell shunting ikke var av et omfang som hadde ført til reaktiv erytropoiese.
PDA morfologien lot seg vanskelig visualisere ved den ekkokardiografiske undersøkelsen. CT avdekker imidlertid en PDA type III, som karakteriseres av en kommunikasjon uten betydelig innsnevring ved overgang fra aorta til pulmonalarterien (13). Det er blitt foreslått at denne typen morfologi er assosiert med høyere mortalitet, da det foreligger minimalt med obstruksjon mot blodstrøm gjennom ductus. Dette lar seg imidlertid ikke etterprøve i de få studier som ser på morbiditet og mortalitet hos hunder og katter med PDA (6). En PDA type III er ikke egnet til transarteriell okklusjon, og åpen thoraxkirurgi med ligering av PDA ville være eneste alternativ (13). Denne behandlingsformen ble derfor anbefalt for katten i kasuistikken.
Et litt overraskende funn ved CT-undersøkelsen var at grad av synlig dilatasjon av pulmonalarteriene var langt mindre enn ved røntgen og ekkokardiografi. En mulig forklaring på dette er effekten av anestesi på systemisk og pulmonalt blodtrykk, samt den vasodilaterende effekten av oksygen som ble tilført katten under prosedyren. Vurdering av grad av hypertensjon ble oppfattet som særdeles viktig i vurdering om det var riktig å anbefale eier transtorakal kirurgisk ligering av PDA.
Behandling
Ved en venstre til høyre PDA hos hund og katt er det anbefalt kirurgisk korreksjon, mens ved en reversert eller bidireksjonell PDA anbefales medisinsk behandling (6,18). Det er få publikasjoner som beskriver forsøk på å lukke reversert eller bidireksjonell PDA. I en studie utført på både hund og katt overlevde imidlertid 3 av 6 pasienter bidireksjonell PDA. De pasientene som overlevde operasjonen viste god langtidsoverlevelse (6). 5 av 6 pasienter fikk sildenafil som behandling i forkant av operasjonen (6). Kirurgisk behandling av PDA med pulmonal hypertensjon som opprettholder en venstre til høyre shunting har vist seg å gi gode resultater (6). Humant gjøres det en vurdering om hvorvidt de vaskulære skadene i lungevevet er reversible i forkant av en operasjon. Det utføres da en lungebiopsi, en okklusjonstest for å vurdere pulmonalt arterielt trykk, og respons på vasodilaterende medisiner (18). Dette er ikke praktisert på dyr, men utgjør en potensiell fremtid i vurdering av, og behandling av dyr med reversert eller bidireksjonell PDA.
Kirurgisk behandling av venstre til høyre shuntende PDA hos katt er assosiert med gode resultater (8). Tidlig kirurgisk behandling er også anbefalt for å redusere grad av kardiell remodellering (8). En venstre til høyre PDA kan lukkes ved ligering av arterien eller ved en transarteriell okklusjon (7,8). På grunn av liten kroppsstørrelse er en interkostal thorakotomi via det 4. interkostale rommet den vanligste formen for kirurgisk behandling hos katt (19). En PDA bør lukkes så raskt som mulig, da en ubehandlet PDA kan utvikle venstresidig hjertesvikt eller pulmonal hypertensjon som en følge av Eisenmengers syndrom (19). En venstresidig hjertesvikt kan oppstå i løpet av det første leveåret hvis PDA ikke blir lukket (18). Hos små hunder er dødeligheten rundt 64 % om ikke shunten ligeres innen 1 år etter at diagnosen er stilt. Ligering av PDA hos hund er blitt utført i mer enn 40 år med høy grad av suksess (>95%), hvor det ikke foreligger komplikasjoner i form av blødning eller ligaturløsning. Den vanligste komplikasjonen ved åpen kirurgisk ligering er intraoperativ blødning. Dette er også den vanligste årsaken til perioperative dødsfall (19). Én rapport viser til kirurgisk behandling av PDA hos 3 katter uten komplikasjoner ved bruk av clips (19). Det er imidlertid rapportert høyere insidens av blødning hos katt sammenlignet med hund. Dette kan skyldes mindre kroppsstørrelse og vanskeligere intraoperative forhold sammenlignet med hund (19). Blødningen skjer vanligvis på grunn av rift i PDA i forbindelse med ligering (19).
Forandringene i pulmonal vaskulatur anses i stor grad å være irreversible på det tidspunkt reversert PDA forekommer. Dersom det skal forsøkes å lukke en PDA som har reversert, vil dette føre til at store mengder blod blir tvunget gjennom en pulmonal vaskulatur som ikke lenger er i stand til å håndtere denne belastningen. Dette kan resultere i akutt pulmonal hypertensjon, høyre hovedkammersvikt og alvorlige arytmier, med stor sannsynlighet for et dødelig utfall. Det er imidlertid flere studier som viser at en katt med PDA som viser betydelige tegn på Eisenmengers fysiologi kan ha positivt utfall så lenge shuntretningen ikke er reversert (20).
Medisinsk behandling av venstre til høyre shuntende PDA er indisert om det foreligger tegn på alvorlig volumoverbelastning av venstre hovedkammer og tegn på venstresidig hjertesvikt. Behandling inkluderer diuretika for å redusere volumbelastning relatert til hjertesykdom. Hos hund blir det ofte også benyttet pimobendan for positiv inotrop effekt, men dette er lite studert hos katter og anses som off-label bruk på individbasis. Til tross for medisinsk behandling vil sykdommen oftest progrediere til endestadium hjertesvikt dersom PDA ikke blir lukket. Medisinsk behandling av en reversert PDA har som mål å redusere det pulmonale trykket og slik lette belastningen på hjertet. Bruk av sildenafil i behandling av PAH er det eneste medikamentet som har vist å gi betydelig økt overlevelse hos hunder med påvist PAH (6). I påvente av operasjon ble også katten i denne kasuistikken behandlet med sildenafil. Dessverre ble katten avlivet grunnet forhold som ikke var relatert til hjertesykdom. Effekt av sildenafil kunne derfor ikke evalueres.
Pulmonal hypertensjon er ikke en sykdom i seg selv, men en manifestasjon av hemodynamiske og patofysiologiske endringer forårsaket av underliggende sykdommer (21). Tilstanden hos katt er lite studert, og er for det meste ekstrapolert fra studier gjort på mennesker og hund. Studier som kan forklare hvorfor katter tilsynelatende tolererer og stabiliserer en PAH i motsetning til hunder hvor tilstanden langt oftere fort forverres og ender fatalt er forfatterne av denne artikkelen ikke kjent med. En mulig forklaring kan være at katter er mindre sensitive for hypoksi, en kjent drivkraft for pulmonal hypertensjon hos mennesker og hunder (22,23).
Effekt av sildenafil i behandling av katter med PAH er heller ikke studert inngående, men er basert på små studier og enkelttilfeller. Enkelte artikler hevder i tillegg at bruk av sildenafil kan føre til akutt pulmonalt ødem, selv om dette også har best forankring i human litteratur (24). Det foreligger en ACVIM consensus statement vedrørende hypertensjon hos hund (25). Ingen lignende publikasjoner eksisterer på katt. Selv om PAH som følge av hjertesykdom er relativt sjeldent forekommende, er det rimelig å anta at et stort antall katter med kronisk obstruktiv lungesykdom kan være affisert av PAH. Grunnlaget for å studere denne lite beskrevne tilstanden videre hos katt for å bedre forstå og behandle katter med PAH er derfor til stede.
Sammendrag
I denne artikkelen beskrives kliniske tegn og utredning ved bruk av ekkokardiografi, røntgen og CT hos en katt med persisterende ductus arteriosus (PDA). Funnene i kasuistikken relateres til kjent litteratur angående denne medfødte hjertesykdommen.
PDA er en sjelden diagnose hos katt sammenlignet med hva som er tilfellet hos hund. Studier som beskriver og klassifiserer tilstanden hos denne arten er få. En ubehandlet PDA kan føre til venstresidig hjertesvikt eller pulmonal arteriell hypertensjon grunnet Eisenmengers syndrom og siden eventuell reversering av shunten. PDA behandlet med kirurgisk ligering eller transarteriell okklusjon er assosiert med god prognose hos både hund og katt. Uten kirurgisk ligering eller transarteriell okklusjon vil PDA oftest føre til høy mortalitet tidlig i livet, spesielt hos hund.
Katter med PDA presenteres ofte først for veterinæren når sykdommen er langt fremskredet, da det ikke alltid lar seg påvise en auskulterbar bilyd på et tidligere tidspunkt. Mange av de karakteristiske funnene som brukes til å diagnostisere PDA hos hund, slik som kontinuerlig bilyd, bankende puls og predileksjon for hunnkjønn er ofte ikke til stede hos katt. Katt viser også i flere studier en disposisjon for å utvikle PAH fremfor venstresidig hjertesvikt. Mange katter ser ut til å stabilisere seg i denne tilstanden i langt større grad enn hunder, der shunten ofte reverserer. Årsaken til dette er ikke kjent, selv om det spekuleres i om katters tilsynelatende toleranse for hypoksi bremser utviklingen av en alvorligere PAH. Det er også rapportert at katter har en større forekomst av multiple kongenitale hjertedefekter sammenlignet med hund. Dette er i noen studier assosiert med å være en negativ prognostisk faktor for katter med PDA.
Kasuistikken beskriver en venstre- til høyreshuntende PDA hos en ett år gammel ukastrert hunnkatt. Ekkokardiografisk undersøkelse viste eksentrisk hypertrofi av venstre hovedkammer, venstre forkammerdilatasjon og en kontinuerlig turbulent retrograd blodstrøm i pulmonalarterien. Ingen behandling ble iverksatt. Tre år senere ble katten undersøkt igjen. Den ekkokardiografiske undersøkelsen viste tilnærmet normalisering av forandringene på hjertets venstre side, men hjertets høyre hovedkammer hadde nå en betydelig konsentrisk hypertrofi. Den kontinuerlige turbulente retrograde blodstrømmen i pulmonalarterien var fortsatt til stede, men nå med en langt lavere hastighet. Disse funnene er forenlig med at det i løpet av tre år hadde utviklet seg en betydelig pulmonal hypertensjon. Dette er i tråd med hvordan PDA ofte arter seg hos katt til forskjell fra hund, hvor venstresidig hjertesvikt og reversering langt oftere er endepunktet. I påvente av operasjon ble katten i denne kasuistikken behandlet med sildenafil. Katten ble kort tid etterpå avlivet grunnet forhold som ikke var relatert hjertesykdommen.
Summary
This article describes clinical signs and assessment using echocardiography, X-ray, and CT on a cat with patent ductus arteriosus (PDA). The findings in the case report correlate to the known literature on congenital heart disease.
PDA is a rare diagnosis in cats compared to dogs. Studies adequately describing and classifying the condition in this species are few. An untreated PDA will most often lead to left-sided heart failure, pulmonary arterial hypertension (PAH) due to Eisenmenger syndrome and then potentially reversal of the shunt. PDA treated with surgical ligation or transarterial occlusion is associated with a good prognosis in both dogs and cats. Without surgical ligation or transarterial occlusion, PDA will most often lead to high mortality early in life, especially in dogs.
Cats with PDA are often first presented to the vet when the disease is advanced, as an auscultable murmur cannot always be detected. Many of the characteristic findings used to diagnose PDA in dogs, such as continuous murmur, throbbing pulse, and female predilection are often not present in cats. Cats also show in several studies a predisposition to develop PAH rather than left-sided heart failure. Many cats seem to stabilize in this state to a far greater extent than in dogs, where the shunt often reverses. The reason for this is not known, although it is speculated that cats’ apparent tolerance to hypoxia slows the progression of a more severe PAH. It has also been reported that cats have a higher incidence of multiple congenital heart defects compared to dogs. This is associated in some studies with being a negative prognostic factor for cats with PDA.
The case report describes a left-to-right shunting PDA in a one-year-old intact female cat. Echocardiographic examination revealed eccentric hypertrophy of the left ventricle, left atrium dilation and a continuous turbulent retrograde blood flow in the pulmonary artery. No treatment was initiated. Three years later, the cat was examined again. The echocardiographic examination showed almost normalisation of the changes on the left side of the heart, but the right ventricle now had considerable concentric hypertrophy. The continuous turbulent retrograde blood flow in the pulmonary artery was still present, but now at a far slower rate. These findings are consistent with the development of substantial pulmonary hypertension over three years. This is in line with how PDA often manifests in cats, unlike in dogs, where left-sided heart failure and reversal are far more often the endpoint. While awaiting surgery, the cat in this case report was treated with sildenafil. The cat was euthanized shortly afterwards due to conditions unrelated to its heart disease.
Etterskrift
Takk gis til veterinær Gunnhild Ørn som foretok den første undersøkelsen av katten i kasuistikken ved AniCura Dyresykehus Stavanger i 2018.
Referanser
Scansen BA, Schneider M, Bonagura JD. Sequential segmental classification of feline congenital heart disease. J Vet Cardiol 2015;17(Suppl 1):s10-52.
Tidholm A, Ljungvall I, Michal J, Häggström J, Höglund K. Congenital heart defects in cats: a retrospective study of 162 cats (1996–2013). J Vet Cardiol 2015;17(Suppl):s215-9.
Schrope DP. Prevalence of congenital heart disease in 76,301 mixed-breed dogs and 57,025 mixed-breed cats. J Vet Cardiol 2015;17:192-202.
Bolton GR, Liu SK. Congenital heart diseases of the cat. Vet Clin North Am 1977;7:341-53.
MacDonald KA. Congenital heart diseases of puppies and kittens. Vet Clin North Am Small Anim Pract 2006;36:503-31.
Greet V, Bode EF, Dukes‐McEwan J, Oliveira P, Connolly DJ, Sargent J. Clinical features and outcome of dogs and cats with bidirectional and continuous right‐to‐left shunting patent ductus arteriosus. J Vet Intern Med 2021;35:780-8.
Hutton JE, Steffey MA, Runge JJ, McClaran JK, Silverman SJ, Kass PH. Surgical and nonsurgical management of patent ductus arteriosus in cats: 28 cases (1991–2012). J Am Vet Med Assoc 2015;247:278-85.
Bascuñán A, Thieman Mankin KM, Saunders AB, Bright JM, Scharf V, Singh A et al. Patent ductus arteriosus in cats (Felis catus): 50 cases (2000–2015). J Vet Cardiol 2017;19:35-43.
Hajj H, Dagle JM. Genetics of patent ductus arteriosus susceptibility and treatment. Semin Perinatol 2012;36:98-104.
Wustefeld‐Janssens BG, Burrow R, Mõtsküla P, Martin M, Dukes‐McEwan J. Clinical findings and treatment outcomes for cats diagnosed with patent ductus arteriosus in the UK: a retrospective study of 19 cases (2004–2012). Vet Rec 2016;179:17.
Boon JA. Veterinary echocardiography. 2nd ed. Ames, Iowa: Wiley-Blackwell, 2011.
Litster AL, Buchanan JW. Vertebral scale system to measure heart size in radiographs of cats. J Am Vet Med Assoc 2000;216:210-4.
Miller MW, Gordon SG, Saunders AB, Arsenault WG, Meurs KM, Lehmkuhl LB et al. Angiographic classification of patent ductus arteriosus morphology in the dog. J Vet Cardiol 2006;8:109-14.
Saunders AB, Gordon SG, Boggess MM, Miller MW. Long‐term outcome in dogs with patent ductus arteriosus: 520 cases (1994–2009). J Vet Intern Med 2014;28:401-10.
McGeady TA, Quinn PJ, Fitzpatrick ES, Ryan MT, Kilroy D, Lonergan P. Veterinary embryology. 2nd ed. Chichester: Wiley-Blackwell, 2017.
Côté E, Ettinger SJ. Long‐term clinical management of right‐to‐left (“reversed”) patent ductus arteriosus in 3 dogs. J Vet Intern Med 2001;15:39-42.
Connolly DJ, Lamb CR, Boswood A. Right‐to‐left shunting patent ductus arteriosus with pulmonary hypertension in a cat. J Small Anim Pract 2003;44:184-8.
Novo-Matos J, Hurter K, Bektas R, Grest P, Glaus T. Patent ductus arteriosus in an adult cat with pulmonary hypertension and right-sided congestive heart failure: hemodynamic evaluation and clinical outcome following ductal closure. J Vet Cardiol 2014;16:197-203.
Ozai Y, Uemura A, Tanaka R, Takeuchi A, Hamabe L, Shimada K et al. Clip ligation for treatment of patent ductus arteriosus occlusion in three cats. J Vet Sci 2022;23:e39.
Aoki T, Sugimoto K, Sunahara H, Fujii Y. Patent ductus arteriosus ligation in two young cats with pulmonary hypertension. J Vet Med Sci 2013;75:199-202.
Rolph KE, Cavanaugh SM. Feline pulmonary hypertension: are we overlooking an important comorbidity? J Feline Med Surg 2022;24:e636-46.
Glaus TM, Hässig M, Baumgartner C, Reusch CE. Pulmonary hypertension induced in dogs by hypoxia at different high-altitude levels. Vet Res Commun 2003;27:661-70.
Gassmann M, Cowburn A, Gu H, Li J, Rodriguez M, Babicheva A et al. Hypoxia‐induced pulmonary hypertension: utilizing experiments of nature. Br J Pharmacol 2021;178:121-31.
Jaffey JA, Williams KJ, Masseau I, Krueger M, Reinero C. Vasoproliferative process resembling pulmonary capillary hemangiomatosis in a cat. BMC Vet Res 2017;13:72.
Reinero C, Visser LC, Kellihan HB, Masseau I, Rozanski E, Clercx C et al. ACVIM consensus statement guidelines for the diagnosis, classification, treatment, and monitoring of pulmonary hypertension in dogs. J Vet Intern Med 2020;34:549-73.