Mykobakterier med ny aktualitet
Bakterien Mycobacterium bovis fikk ny aktualitet i Norge ved det tidligere omtalte utbruddet av tuberkulose hos storfe i Rogaland i 2022. Denne artikkelen gir en oversikt over kunnskap om mykobakterier generelt og M. bovis spesielt, bakterier vi mener det er viktig at veterinærer har oppdatert kunnskap om. Til slutt i artikkelen omtales en rekke forskningsarbeider som er utført ved Veterinærhøgskolen i samarbeid med flere afrikanske universiteter, der et sentralt fokus har vært zoonotiske aspekter ved tuberkulose hos dyr.
Professor i mattrygghet, Institutt for parakliniske fag, Veterinærhøgskolen, NMBU
Professor i veterinær samfunnsmedisin, Institutt for produksjonsdyrmedisin Veterinærhøgskolen, NMBU
Førsteamanuensis i bakteriologi, Institutt for parakliniske fag, Veterinærhøgskolen, NMBU
Professor i bakteriologi, Institutt for parakliniske fag, Veterinærhøgskolen, NMBU
Innledning
I desember 2022 ble det, med utgangspunkt i mistanke om tuberkulose ved ordinær kjøttkontroll på det lokale slakteriet, påvist Mycobacterium bovis fra storfe tilhørende en gård i Rogaland. Ettersom tuberkulose er en sykdom på nasjonal liste 2-sykdommer (tidligere B-sykdommer), skal påvisning av eller mistanke om slik sykdom meldes umiddelbart til Mattilsynet for videre oppfølging. I etterkant av påvisningen i desember 2022 har Mattilsynet i samarbeid med blant annet Veterinærinstituttet, Animalia og Folkehelseinstituttet jobbet videre med diagnostikk, smittesporing og begrensende tiltak, og en oversikt over dette arbeidet er presentert i NVT i 2024 (1).
Norge er av EFTAs overvåkningsorgan ESA (EFTA Surveillance Authority) tildelt fristatus for storfetuberkulose og sykdommen har, med unntak av to besetningsutbrudd i Vestland i 1984 og 1986, ikke blitt påvist i Norge før den igjen ble påvist i 2022. Dette betyr at storfetuberkulose og M. bovis verken er en sykdom eller en bakterie norske veterinærer forventes å befatte seg med. Oppdagelsen av utbruddet i 2022 viser imidlertid tydelig hvor viktig det er at veterinærene likevel har oppdatert kunnskap om denne typen av «glemte» sykdommer. Denne gangen kan vi takke gode rutiner og oppmerksomt personale i kjøttkontrollen for at sykdommen ble gjenkjent og aksjon igangsatt.
Som undervisere i bakteriologi, mattrygghet og veterinær samfunnsmedisin er vi opptatt av at veterinærstudentene får tilstrekkelig undervisning om både uvanlige og mer vanlige dyresykdommer og zoonoser. M. bovis er en mykobakterie med zoonotisk potensiale, og kan gi alvorlig sykdom både hos dyr og mennesker. Det er derfor nødvendig å ha et helhetlig Én helseperspektiv på arbeid med forebygging og bekjempelse av M. bovis infeksjoner. Et sentralt utgangspunkt for forståelse for temaet er grunnleggende kunnskap om mykobakterier generelt og M. bovis spesielt, og vi ønsker med denne artikkelen å gi oppdatert kunnskap om dette.
M. bovis og norske forhold knyttet til sykdommen storfetuberkulose er ikke et aktivt forskningsfelt ved Veterinærhøgskolen, NMBU. I løpet av de siste 20-25 årene har imidlertid en rekke PhD-studenter fra afrikanske land som Uganda, Zambia, Eritrea og Etiopia gjennomført sine doktorgradsarbeider om ulike aspekter ved tuberkulose ved Veterinærhøgskolen, NMBU, og noen sentrale elementer fra deres arbeid presenteres også her.
Mykobakterier
Taksonomi
Genus Mycobacterium er eneste genus i familien Mycobacteriaceae (2). Genus inneholder både patogene og saprofyttære arter fra varmblodige dyr, mer enn 200 arter totalt. Mycobacterium tuberculosis, Mycobacterium africanum, M. bovis, Mycobacterium caprae, Mycobacterium pinnipedii og Mycobacterium microti omtales ofte som M. tuberculosis complex (MTBC) (3), ettersom disse artene i hovedsak er patogene for mennesker, storfe og smågnagere. De klassifiseres også som de typiske, langsomtvoksende mykobakteriene. Gruppen non-tuberkuløse mykobakterier (NTM, tidligere kalt atypiske mykobakterier), inneholder langsomtvoksende mykobakterier som Mycobacterium avium ssp. avium og M. avium ssp. paratuberculosis, også omtalt som Mycobacterium avium complex (MAC). M. avium ssp. avium er som navnet tilsier vanligste årsak til tuberkulose hos fugler, mens M. avium ssp. paratuberculosis forårsaker paratuberkulose (Johne’s disease, en tarmsykdom) hos drøvtyggere. I Norge har denne sykdommen tidligere vært mest aktuell hos geit. Infeksjon med NTM er ikke uvanlig hos gris og mennesker kan også smittes (4). Gruppen NTM inneholder også hurtigvoksende mykobakterier som stort sett er saprofytter. Noen hurtigvoksende NTM, som Mycobacterium chelonae og Mycobacterium fortuitum, og langsomtvoksende, som Mycobacterium marinum, forårsaker granulomer hos fisk og kan gi hudinfeksjoner hos mennesker i kontakt med både fersk- og saltvann (5).
Nevnes bør også Mycobacterium leprae, den første bakterien som ble identifisert som årsak til sykdom hos menneske, beskrevet av den norske legen Gerhard Armauer Hansen i 1873. Man har fortsatt ikke lykkes i å dyrke M. leprae i cellefrie medier. Sykdom forårsaket av M. leprae finnes naturlig hos blant annet armadilloer (Dasypus novemcinctus) i Mexico og sydlige USA og i dag regnes M. leprae som en zoonotisk bakterie (6). Armadilloer har lenge vært regnet som de eneste forsøksdyr som kan brukes til smittestudier.
Evolusjonsbiologiske slektskapsstudier (fylogeni) av mykobakterier er de siste tiårene utført med ulike genetiske analyser der sekvenser av konserverte gener som koder for 16S rRNA, konserverte husholdningsgener og helgenomsekvenser kan inngå (5). I store trekk viser disse ulike analysene god overensstemmelse med tidligere klassifiseringer, men gir også mer detaljer om innbyrdes slektskapsforhold. Ved hjelp av helgenom sekvensanalyser er det for eksempel beskrevet hvordan alle bakterieartene innenfor M. tuberculosis-komplekset egentlig bør regnes som en art, og tidligere arter beskrives som varianter. M. bovis vil i henhold til dette betegnes som M. tuberculosis var. bovis (3). I denne artikkelen benytter vi det tradisjonelle navnet M. bovis.
Morfologi
Mykobakterier er ubevegelige, svakt bøyde eller rette stavbakterier. En fellesnevner for alle mykobakterier er det høye innholdet av lipider i celleveggen, spesielt mykolsyrer som er langkjedede fettsyrer. Dette høye lipidinnholdet gjør bakteriene hydrofobe og langsomtvoksende, samt resistente mot syrer, desinfeksjonsmidler, uttørking og andre ugunstige miljøpåvirkninger. Celleveggen ligner i oppbygningen på Gram-positive bakterier, men den syrefaste celleveggen resulterer i at mykobakterier stort sett ikke farges av Grams fargemetode. Vanligste fargemetode for lysmikroskopering er Ziehl-Neelsens fargemetode, der syrefaste bakterier farges røde og andre bakterier grønne (Figur 1).
Som nevnt over er mange mykobakteriearter langsomtvoksende, og de vokser ikke med synlige kolonier på faste medier før etter flere døgn/ukers inkubasjon ved optimumstemperatur. Kolonimorfologi varierer i stor grad med art, noen arter kan danne gul-oransje pigmenterte kolonier på grunn av innhold av karotenoider. Koloniene kan ha både glatt og ru overflate.
Vekst og overlevelse
Mykobakterier vokser under aerobe forhold. Skillet mellom hurtigvoksende og langsomtvoksende arter går ved omtrent syv dagers inkubasjon i laboratoriet. Det er stor artsforskjell i krav til næringsfaktorer i vekstmedier, der saprofyttære arter kan vokse på svært enkle substrater. Patogene arter dyrkes ofte på spesialmedier, og den mest ekstreme arten er som nevnt M. leprae som ikke lar seg dyrke på cellefrie medier.
M. bovis og andre arter innenfor MTB-komplekset er fakultativt intracellulære patogener. I en infisert vert vil mykobakteriene leve og reprodusere seg i fagocytterende celler, men de kan også overleve og beholde sin infektivitet ganske lenge i et bredt spekter av ulike matrikser og substanser, inkludert vann, jord og bløtgjødsel (7). Bakteriene er imidlertid følsomme for UV-lys.
Patogenitet
Bakteriell patogenitet er assosiert med bakterienes evne til å infisere en vert, og til å overleve, multiplisere og forårsake sykdom hos denne. Overordnet sett er det komplekse lipider og proteiner i både bakterienes cellevegg og cytoplasma som utgjør de sentrale patogenitetsfaktorene hos bakterier i MTB-komplekset, hvorav langkjedede mykolsyrer spiller en viktig rolle. Til sammen utgjør disse molekylene et avansert apparat som gjør at bakteriene tas opp av fagocytterende celler, men ikke drepes av disse cellene eller av vertens øvrige immunforsvar. Infiserte makrofager i lymfeknuter og i stor grad lungevev tiltrekker seg andre immunceller som monocytter, lymfocytter og nøytrofile granulocytter, og dette gir opphavet til de karakteristiske granulomatøse lesjonene hos infiserte verter (Figur 2).
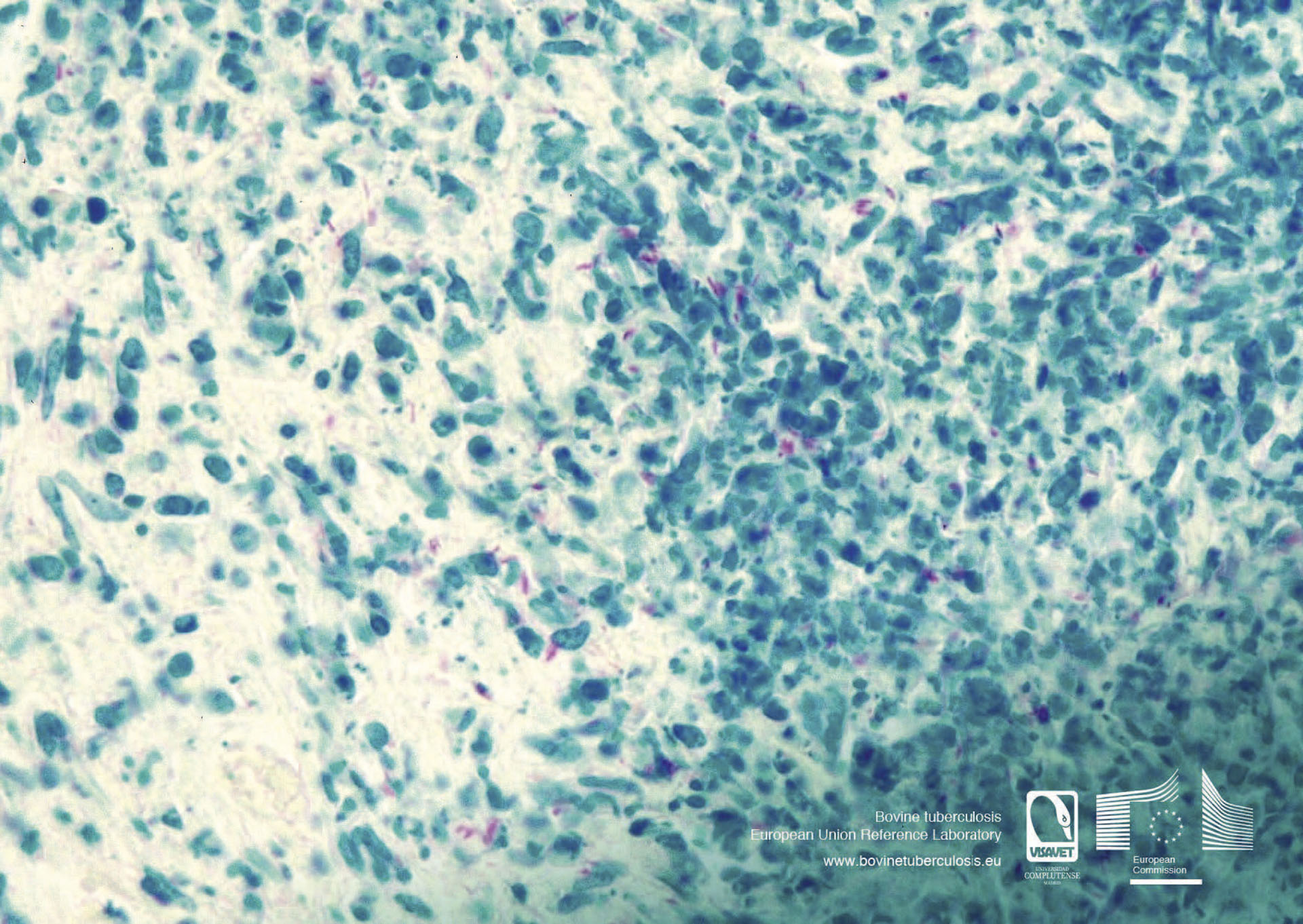
Figur 1. Ziehl-Neelson farging av Mycobacterium spp. Fra EURL Bovine tuberculosis Learning Material (visavet.es)
Antimikrobiell resistens
Multiresistente varianter av M. tuberculosis er blitt en stor helsetrussel verden over og kompliserer i stor grad behandling av human tuberkulose i svært mange land. Vanligste behandling er nå langvarig antibiotikabehandling med en kombinasjon av ulike antibiotika. Det er imidlertid rapportert om M. tuberculosis isolater som er såkalt pan-resistente, det vil si at de er resistente overfor alle antibiotika i alle antimikrobielle kategorier. Ved behandling av slike tilfeller må man gå tilbake til behandlingsmetoder fra før-antibiotisk tid, som kirurgi.
Den viktigste mekanismen for spredning av resistensegenskaper mellom bakterier antas å være horisontal genoverføring av resistensgener mellom både like og ulike bakterier. Mykobakterier ser imidlertid ikke ut til å ha evne til slik horisontal genoverføring og klonal (vertikal) spredning av resistente mutanter er derfor en sentral mekanisme som kan forklare den globale forekomsten av antibiotikaresistente M. tuberculosis. Andre faktorer av betydning er at mykobakteriene er naturlig resistente overfor en del antibiotika på grunn av deres spesielle celleveggstruktur og at bakteriene er relativt godt beskyttet for eksponering overfor antibiotika i de granulomatøse hulrommene de befinner seg i (8).
Av de 124 M. tuberculosis-isolatene som er omtalt i NORM/NORM-VET rapporten for 2021 ble 10 isolater karakterisert som multiresistente, og to av disse isolatene ble også vurdert å være ekstensivt resistente (9). Det har ikke vært på langt nær like mye oppmerksomhet knyttet til antibiotikaresistens hos M. bovis som hos M. tuberculosis. Like fullt er det beskrevet mutasjoner hos M. bovis som for eksempel gir resistens overfor isoniazid, fluoroquinoloner, streptomycin og aminoglycosider (10).
Zoonotiske og Én helse perspektiver
I en artikkel «Om storfetuberkulose i Norge» (11) skriver Eivind Liven at «Storfetuberkulosens zoonotiske karakter har gitt den særlig betydning. I 2017 meldte WHO om nærmere 150 000 tilfeller av zoonotisk human tuberkulose». Den relative betydningen av M. bovis for den totale sykdomsbyrden forårsaket av tuberkulose hos mennesker er imidlertid fortsatt omdiskutert (12). Bedre og mer spesifikke metoder, spesielt genotypebaserte metoder, for analyser av mykobakterier viser at den zoonotiske kapasiteten til M. bovis sannsynligvis er noe mindre enn tidligere antatt. Betydningen av M. bovis som humanpatogen er likevel ikke bare avhengig av bakteriens evne til å krysse artsbarrierer, men også i hvilken grad mennesker eksponeres for M. bovis. En oversiktsartikkel over den globale forekomsten av M. bovis isolert fra humane tuberkulosetilfeller konkluderer med at den zoonotiske betydningen av M. bovis fortsatt er viktig i alle deler av verden, men at den relative betydningen av M. bovis er større i områder der sannsynligheten for eksponering er større, for eksempel gjennom tett dyrekontakt eller konsum av upasteurisert melk. Konklusjonene er imidlertid usikre på grunn av stor variasjon i metodebruk i de ulike studiene som er vurdert (13).
Det er ikke mulig hos mennesker å skille mellom tuberkulosetilfeller forårsaket av M. tuberculosis eller M. bovis basert på kliniske symptomer. En utfordring med M. bovis-infeksjonene er at M. bovis er naturlig resistent overfor pyrazinamid, én av de fire standard antibiotikaene som brukes i førstelinjebehandling av tuberkulose. Sett i et bredere Én helseperspektiv er M. bovis en viktig bakterie, ikke bare fordi den gir infeksjoner både hos dyr og mennesker, men også fordi storfetuberkulose har stor betydning for livsvilkårene til mennesker som er avhengige av husdyra sine. Bedre dyrehelse gjennom å redusere forekomsten av storfetuberkulose vil forbedre både mattrygghet og folks levestandard med mange positive ringvirkninger (14).
Epidemiologi; forekomst og utbredelse, smitteveier
Tuberkulose hos mennesker
Totalt sett regner WHO med at cirka en fjerdedel av verdens befolkning er smittet av tuberkulosebakterier og anslår at cirka 10 millioner mennesker blir syke av tuberkulose hvert år (15). Etter andre verdenskrig gikk forekomsten av human tuberkulose raskt ned i den vestlige verden. Den viktigste smitteveien er spredning fra person til person via aerosoler. Bedring av sosioøkonomiske forhold, bedre ernæring og bedre levestandard er vurdert som viktige årsaker til nedgangen.
Tuberkulose hos mennesker med humant immunsvikt virus (HIV) er en spesiell utfordring. Ettersom HIV angriper immunsystemet og dermed svekker evnen til å motstå infeksjoner, er denne gruppen ekstra sårbar for infeksjon med mykobakterier. Tuberkulose er den vanligste dødsårsaken for mennesker med HIV. En tilsvarende koinfeksjon som regnes å være spesielt utfordrende er infeksjon med SARS-CoV-2 virus hos mennesker som allerede er infisert med mykobakterier (16). Sannsynligvis vil en slik koinfeksjon gi et dårligere behandlingsresultat for både tuberkulose og COVID-19.
Tuberkulose hos dyr
Aerosolsmitte gjennom direkte dyr-dyr kontakt er på samme måte vurdert som viktigste smittevei for mennesker. M. bovis sin evne til å overleve lenge i miljøet har likevel betydning for hvordan smitteveier vurderes. Storfe med tuberkulose kan skille ut M. bovis i feces, urin og melk. I nyere litteratur diskuteres det om indirekte smitte via et kontaminert miljø har større betydning for smittespredning enn tidligere antatt (7). Ettersom man bedre forstår hvordan M. bovis for eksempel kan overleve på beiteområder for storfe, ansees slik miljøsmitte i det minste å ha betydning for smitte mellom storfe og ville dyr. I Storbritannia og Irland er grevling ansett å være et viktig reservoar for M. bovis, men nærkontakt som muliggjør direkte smitte mellom grevling og storfe vurderes å forekomme svært sjelden.
Hold av lama og alpakka som hobbydyr og som eksotiske dyrearter på besøksgårder og lignende har blitt stadig mer populært. Forekomsten av tuberkulose hos disse dyreartene når de lever i sine naturlige habitater i fjellområder i Sør-Amerika er lav, men sykdomsutbrudd forårsaket av både M. bovis og M. microti er rapport i økende grad spesielt i besetninger med høy dyretetthet og i områder der det allerede er en høy prevalens av tuberkulose hos storfe (17). Det har vært spesielt fokus på dette i Storbritannia, som blant annet har innført obligatorisk tuberkulosetesting av kamelider før videre eksport til andre land.
Non-tuberkuløse mykobakterier
Denne gruppen mykobakterier inkluderer Mycobacterium avium-komplekset og Mycobacterium abscessus-komplekset og en rekke arter som er kjent for å være til stede i jord og vann. Evnen til å danne biofilm er en av de viktigste kjennetegnene for denne gruppen mykobakterier. Det viser seg at rørledninger for drikkevann til husholdninger og næringsmiddelbedrifter kan være en viktig kilde for smitte av slike mykobakterier til mennesker. Forholdet mellom fuktighet og innhold av blant annet jern i jord kan være medvirkende til ulike grader av spredning av bakteriene til ledningssystemene (18). Selv svært næringsfattig drikkevann kan gi grunnlag for biofilmdannelse i rørledninger (19). I tillegg kan jord og støv i mange miljøer være kilde til smitte til mennesker med de ikke-tuberkuløse mykobakteriene (20). Forekomsten av ikke-tuberkuløse mykobakterieinfeksjoner har doblet seg fra 1994 til 2014 i USA da frekvensen var rapportert til 16 tilfeller pr. 100.000 individer (19). Som nevnt er slike infeksjoner også vanlig hos gris i Norge.
Diagnostikk
De diagnostiske hjelpemidlene for å påvise mykobakterieinfeksjoner omfatter tradisjonell bakteriologi, molekylære metoder og serologi. Denne artikkelen fokuserer på diagnostikk av storfetuberkulose i henhold til Verdensorganisasjonen for dyrehelse (21). For en omfattende litteraturgjennomgang av bakteriologisk og molekylær diagnostikk vises det til Gormley og kollegaer (22).
Klinisk diagnostikk
Tuberkulose er vanligvis en kronisk sykdom, med diffuse kliniske tegn som kan oppstå etter flere måneder til år. Akutte eller perakutte infeksjoner forekommer sjelden hos dyr og er mer sannsynlig hos individer med en underliggende sykdom eller som er immunsupprimerte (21). Det er ingen patognomoniske, kliniske tegn assosiert med storfetuberkulose. Sykdommen har typisk en langsom start og infiserte dyr kan overføre infeksjon uten å vise noen synlige tegn. De hyppigst observerte kliniske tegnene hos storfe inkluderer vekttap, svakhet, manglende appetitt, lavgradig forhøyet kroppstemperatur, hoste og lymfadenopati. Diagnose av tuberkulose hos levende dyr kan derfor være utfordrende og World Organisation for Animal Health (WOAH) anbefaler kun intradermal tuberkulintest, som er en forsinket hypersensitivitetstest, til dette formålet. Tuberkulintesten måler graden av hevelse i huden 72 timer etter injeksjon av et antigen kalt PPD (purified protein derivate). Tuberkulintesten kan utføres som enkel tuberkulintest ved bruk av kun bovint PPD-B, eller som en komparativ tuberkulintest som måler forskjellen i hudhevelsen mellom bovin PPD og aviær PPD. Mens den enkle tuberkulintesten har større sensitivitet, har den komparative testen større spesifisitet spesielt når dyr har blitt sensibilisert mot NTMs (23).
Bakteriologisk diagnostikk
Direkte mikroskopi av vevsprøver er den raskeste, billigste og enkleste måten for påvisning av syrefaste bakterier, inkludert M. bovis, i vevsprøver. For dette formålet kan et direkte utstryk av en prøve eller et vevssnitt farges med Ziehl-Neelsens metode, slik som vist i Figur 1 (24). Alternativt kan en fluorescerende syrefast fargemetode, for eksempel med auramin, brukes for å øke følsomheten (25). Imidlertid er fargemetoder funnet å ha lav sensitivitet (25-75 %) sammenlignet med dyrkning. Tradisjonelt har mykobakterier blitt identifisert basert på fenotypiske egenskaper som kolonimorfologi, veksthastighet, veksttemperatur, pigmentering og en rekke biokjemiske tester. Dyrkning av mykobakterier av MTBC-gruppen hemmes av spesielle vekstkrav og den langsomme veksten. I tillegg til det krevende tidsaspektet ved disse testene kan de også føre til feilidentifikasjon av andre årsaker. Moderne metoder som polymerasekjedereaksjon (PCR) og MALDI-TOF (Matrix Assisted Laser Desorption/Ionisation - Time Of Flight») har nå stort sett avløst tradisjonelle metoder (26).
For å oppnå best mulig følsomhet ved primærisolasjon av bakterier ved bruk av faste medier, er det hensiktsmessig å kombinere flere dyrkningsmedier: agarbasert medium (for eksempel Middlebrook 7H10 eller 7H11) og eggbasert medium (for eksempel Stonebrinks eller Löwenstein-Jensen med pyruvat) med bruk av to eller flere rør av hvert medium og en inkubasjonstid på ≥12 uker. Aktuelle faste medier er begrenset, buljongbaserte medier (for eksempel BACTEC 460 eller MGIT 960) kan forbedre diagnostikkhastigheten (22). Prøveforberedelsen krever et dekontamineringstrinn som er avgjørende for å unngå kontaminasjon med andre bakterier som er til stede i vevsprøver og som raskt vil forstyrre påvisningen av mykobakterier (27).
Dyrkning og påvisning av DNA fra vevsprøver er ifølge WOAH de to beste metodene for å bekrefte kliniske tilfeller.
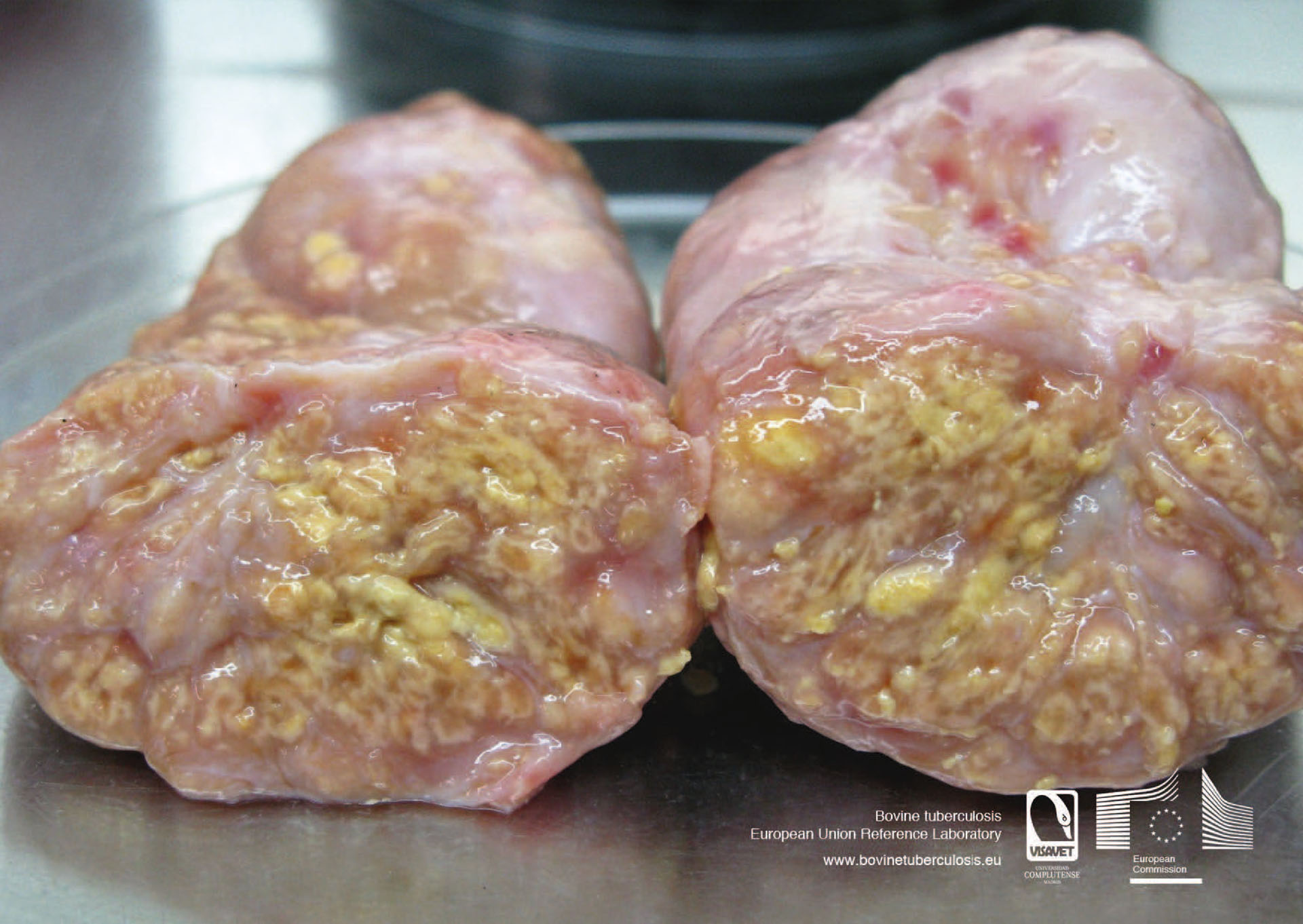
Figur 2. Synlige granulomatøse lesjoner i en lymfeknute fra storfe, forårsaket av M. bovis. Fra EURL Bovine tuberculosis Learning Material (visavet.es)
Serologi
Den eneste serologiske metoden som er anbefalt av WOAH er interferon-gammatesten (IGT), mens påvisning av antistoffer med ELISA og «lateral flow»-tester er begrenset i bruk. I IGT stimuleres blodprøver med deler av bakterien. Testen skal kunne identifisere dyr i tidlige stadier av sykdommen, men er kun anbefalt til bruk i utryddelsesprogrammer og til overvåkning og er ikke nyttig for å diagnostisere tuberkulose på enkeltdyr i Norge (www.vetinst.no/sykdom-og-agens/tuberkulose). Infeksjon med eller eksponering for andre mykobakterier kan gi falske positive resultater ved testing (28), men bruk av antigen som er spesifikt for M. bovis som ESAT-6 og CFP-10 kan øke spesifisiteten.
Molekylær diagnostikk
Rask identifikasjon av dyrkede isolater som MTBC kan utføres ved bruk av PCR rettet mot 16S–23S rRNA og andre genetiske markører som insersjonssekvensene IS6110 (29) og IS1081 (30). Artsnivåidentifikasjon av medlemmer av MTBC kan oppnås med molekylærgenetiske tilnærminger for å påvise tilstedeværelse eller fravær av «regions of deletion» (RD) (31) eller enkeltnukleotid polymorfismer. Videre identifikasjon av underarter og stammer kan oppnås ved molekylær typing som spoligotyping (32) og i økende grad helgenomsekvensanalyser. Spoligotyping og helgenomsekvensering bidrar i stor grad til epidemiologiske studier og kildeidentifisering (33). Til tross for økt bruk av helgenom-sekvensering regnes spoligotyping fortsatt som den rutinemessige molekylære karakteriseringsteknikken for medlemmer av MTBC. I 2017 ble det implementert en europeisk database kalt mycoDB.eu (www.mycodb.eu) med formål om å samle inn alle karakteriseringsdata vedrørende MTBC fra dyr i Europa. Spoligotypesøk er kun tilgjengelig for nasjonale referanselaboratorier.
Real-time PCR brukes rutinemessig for direkte påvisning av arter av MTBC i kliniske prøver (hovedsakelig sputum) hos mennesker og bruk i analyse av vevsprøver fra dyr har økt de siste årene. På grunn av celleveggens spesielle oppbygning er DNA-ekstraksjonsmetoden krevende og må inkludere både et mekanisk lyseringstrinn og kjemisk lysering (34). En rekke kommersielt tilgjengelige analyser og ulike ”in-house” metoder for påvisning av MTBC i prøver fra dyr har blitt validert og publisert (35).
Hva har vi lært av forskningssamarbeidet med afrikanske land?

Figur 3. Storhornet Ankole-kveg fra sentrale Uganda.
Foto: Eystein Skjerve
Fra 1998 til 2021 forsket Veterinærhøgskolen (NVH/Veterinærhøgskolen, NMBU) på tuberkulose og mykobakterier i samarbeid med universiteter i afrikanske land. Det meste av dette skjedde i tett samarbeid med Veterinærinstituttets spesiallaboratorier.
Et forskningsarbeid i Eritrea startet på slutten av 1990-tallet, og gikk over cirka 20 år med studier av tuberkulose hos storfe og zoonotisk tuberkulose som et hovedtema innenfor et klart definert Én Helse-perspektiv. Tuberkuloseforskningen utviklet seg med forskjellig finansiering og har omfattet samarbeid med Uganda (Makerere University), Zambia (University of Zambia), Eritrea (University of Asmara) og Etiopia (University of Mekelle og University of Hawassa).
Det er avlagt til sammen ni PhD og fire MSc grader på temaet ved Veterinærhøgskolen fra 2001 til 2022. Modellen har vært å gi afrikanske studenter muligheter til å ta en PhD eller MSc grad i Norge basert på feltstudier og epidemiologiske data i afrikanske land kombinert med opplæring, skriving og laboratorieundersøkelser i Norge. I sluttfasen av programmet ble det også avlagt grad ved afrikanske universiteter. I det følgende presenteres hovedfunn fra dette samarbeidet. Mange forskere i Norge og hos våre afrikanske partnere har bidratt, og det er valgt å ikke fokusere på navn i denne artikkelen.
De første studiene fulgte en standard tilnærming med å undersøke prevalens av tuberkulose hos storfe ved bruk av den klassiske intradermaltesten. Hos nomadiske storfe i Eritrea ble det funnet 14,5 % individuelle reaktorer (36) og i Karamoja-regionen i Uganda en lavere forekomst på 1,4 % (37), men med høye flokkprevalenser begge steder. Høye nivåer med M. bovis er koblet til store besetninger med dårlig hygiene – som det tidligere var i Norge og i resten av Europa, mens nomadiske kveg ofte lever i miljø med lite smitte (38). Intradermaltesten har sine begrensninger, og i videre studier ble det stort sett benyttet dyrking fra mennesker, dyr og miljø med påfølgende molekylærkarakterisering av isolatene. I Etiopia ble det påvist høye nivåer og mange varianter av M. bovis i mer intensive produksjonsformer omkring byene (39).
Figur 3 viser et bilde av storhornet Ankole-kveg fra sentrale Uganda. Denne storferasen er kjent for å kunne leve under krevende klimatiske forhold, og tåler godt både tørke og hete. I områdene som ble brukt til feltstudier er det svært tett smittekontakt mellom mennesker, husdyr, ville dyr og miljø via felles drikkevannskilder, og en betydelig forekomst av NTM ble påvist i miljøet hos både storfe og gris (40). I en annen studie ble også skrofula hos mennesker (halslymfekjerteltuberkulose) undersøkt, der det viste seg at dette var hyppigere forårsaket av NTM i miljøet (38), og M. bovis var mindre vanlig enn antatt. I en studie på gris i Uganda ble det funnet mange dyr med tuberkuløse lesjoner og funn av NTM (41). Interaksjon mellom husdyr og ville dyr som deler samme miljø ble undersøkt i Zambia der nærhet til nasjonalparker bidro til høye nivåer av infeksjon hos storfe med sesongbeite inne i parkene (42), selv om nivået hos antiloper var lavt (43).
Mange bakterieisolater som er brukt i studiene har kommet fra slaktedyr. Studier fra Etiopia viste høy forekomst av lesjoner forårsaket M. bovis hos slaktedyr, med delvis multiple infeksjoner med forskjellige varianter av M. bovis (44) der de fleste lesjonene ble funnet i lunger, tarm og en lavere forekomst i jur. Resultatene fra slaktedyr overdriver ofte prevalensen ved at de neglisjerer det faktum at det for eier er rasjonelt å selge tuberkuløse dyr til slakt, mens de friske blir beholdt i besetningen (39). Heldigvis er ikke kjøtt så avgjørende for smitte fra storfe til mennesker. Av interesse for Norge er studier som viser økt følsomhet av kjøttkontrollen ved intensiv snitting av lymfeknuter og vev hos slaktedyr for å finne tuberkulose (44).
Gjennom studiene er det isolert og karakterisert et stort antall isolater av M. bovis, M. tuberculosis og NTM. Disse isolatene finnes fremdeles lagret ved Veterinærinstituttet og er brukt i mange publikasjoner. Isolatene var også basis for en publikasjon om antatt spredning av viktige varianter som Africa 1 av M. bovis i beltet fra Vest- til Øst-Afrika (45).
I arbeidet med kliniske isolater fra mennesker i Uganda, Etiopia og Zambia, ble det funnet multiple infeksjoner samt antibiotikaresistente varianter av både M. bovis og M. tuberculosis, særlig hos mennesker med HIV-infeksjon. Infeksjoner med NTM forekom også hyppig hos HIV-infiserte (46). Den store skrekken er utvikling av multiresistente og til slutt panresistente M. tuberculosis, og nettopp dette var tema for det siste forskningsprosjektet gruppen gjennomførte, med studier av multiresistente varianter av M. tuberculosis isolert fra lungetuberkulose hos mennesker fra Tigray, Etiopia (47).
Et hovedspørsmål for arbeidet har vært hvor omfattende smitte av tuberkulose fra storfe til mennesker er hos de nomadiske folkegruppene i regionen. Det er særlig smitte fra storfe via melk som har vært i fokus. Studiene viser at tuberkulose hos mennesker i høyendemiske områder primært er smitte mellom mennesker og ikke via melk fra storfe. Det kan være annerledes i områder med lav forekomst av tuberkulose hos mennesker. Men i visse situasjoner er fremdeles storfetuberkulose en viktig zoonose vi ikke skal glemme.
Sammendrag
Utbruddet av tuberkulose hos storfe i Rogaland i 2022 viser hvor viktig det er at veterinærer har oppdatert kunnskap om denne typen av «glemte» infeksiøse agens og de sykdommene de forårsaker. Mycobacterium bovis inngår i Mycobacterium tuberculosis (MTB)-komplekset sammen med flere andre mykobakteriearter som alle er langsomtvoksende og i hovedsak patogene for mennesker, storfe og smågnagere. M. bovis og andre arter innenfor MTB-komplekset er fakultativt intracellulære patogener, og deres patogenitetsegenskaper er assosiert med bakterienes evne til å infisere en vert, og til å overleve, multiplisere og forårsake sykdom hos denne. I en infisert vert vil mykobakteriene leve og reprodusere seg i fagocytterende celler, men de kan også overleve og beholde sin infektivitet ganske lenge i et bredt spekter av ulike matrikser og substanser, inkludert vann, jord og bløtgjødsel.
M. bovis er en mykobakterie med zoonotisk potensiale. Den kan gi alvorlig sykdom både hos dyr og mennesker, men den relative betydningen av M. bovis for den totale sykdomsbyrden forårsaket av tuberkulose hos mennesker er fortsatt omdiskutert. I en rekke studier gjennomført i samarbeid mellom Veterinærhøgskolen og forskere ved flere afrikanske universiteter er det undersøkt omfanget av smitte av tuberkulose fra storfe til mennesker i nomadiske folkegrupper. Disse studiene viser at tuberkulose hos mennesker i høyendemiske områder primært er forårsaket av smitte mellom mennesker. Dette bildet kan likevel være annerledes i områder med lav forekomst av tuberkulose hos mennesker. Storfetuberkulose er uansett en viktig zoonose vi ikke skal glemme.
Summary
The outbreak of tuberculosis in cattle in Rogaland in 2022 highlights the importance of veterinarians having up-to-date knowledge of these types of “neglected” infectious agents and the diseases they cause. Mycobacterium bovis is part of the Mycobacterium tuberculosis (MTB) complex along with several other mycobacterial species, all of which are slow-growing and primarily pathogenic for humans, cattle, and small rodents. M. bovis and other species within the MTB complex are facultatively intracellular pathogens, and their pathogenicity is associated with the bacteria’s ability to infect a host, and to survive, multiply and cause disease in it. In an infected host, the mycobacteria will live and reproduce in phagocytic cells, but they can also survive and maintain their infectivity for a long time in a wide range of different matrices and substances, including water, soil and slurry.
M. bovis is a mycobacterium with zoonotic potential. It can cause serious disease in both animals and humans, but the relative importance of M. bovis for the total disease burden caused by tuberculosis in humans is still debated. In several studies conducted in collaboration between the Veterinary Faculty in Norway and researchers at several African universities, the extent of transmission of tuberculosis from cattle to humans among pastoral peoples has been investigated. These studies show that tuberculosis in humans in high-endemic areas is primarily caused by transmission between humans. However, this picture may be different in areas with low prevalence of tuberculosis in humans. Bovine tuberculosis is in any case an important zoonosis that we should not neglect.
Referanser
Iversen KK, Hordern-Larsen T, Jetmundsen SC, Meling S, Norheim D, Tveter BS et al. Utbrudd av storfetuberkulose i Norge. Nor Vet Tidsskr 2024;136:242–9.
Magee JG, Ward AC. Genus I. Mycobacterium. I: Goodfellow M, Kämpfer P, Busse HJ, Trujillo ME, Suzuki K, Ludwig W et al, eds. Bergey’s manual of systematic bacteriology. 2nd ed. New York: Springer, 2012:vol. 5: The Actinobacteria, Part A, 312-75.
Riojas MA, McGough KJ, Rider-Riojas CJ, Rastogi N, Hazbón MH. Phylogenomic analysis of the species of the Mycobacterium tuberculosis complex demonstrates that Mycobacterium africanum, Mycobacterium bovis, Mycobacterium caprae, Mycobacterium microti and Mycobacterium pinnipedii are later heterotypic synonyms of Mycobacterium tuberculosis. Int J Syst Evol Microbiol 2018;68:324-32.
Folkehelseinstituttet. Mykobakterieinfeksjoner (non-tuberkuløse mykobakterier, NTM) – håndbok for helsepersonell. Mykobakterieinfeksjoner (non-tuberkuløse mykobakterier, NTM) - FHI (21.05.2024).
Tortoli E. The taxonocmy of the genus Mycobacterium. I: Velayati AA, Farnia P, eds. Nontuberculous mycobacteria (NTM). Microbiological, clinical and geographical distribution. London: Academic Press, 2019;1-10.
Oliveira IVPM, Deps PD, Antunes JMAP. Armadillos and leprosy: from infection to biological model. Rev Inst Med Trop Sao Paulo 2019;61:e44.
Allen AR, Ford T, Skuce RA. Does Mycobacterium tuberculosis var. bovis survival in the environment confound bovine tuberculosis control and eradication? A literature review. Vet Med Int 2021;8812898.
Eldholm V, Balloux F. Antimicrobial resistance in Mycobacterium tuberculosis: the odd one out. Trends Microbiol 2016;24:637-48.
NORM/NORM-VET 2021. Usage of antimicrobial agents and occurrence of antimicrobial resistance in Norway. Tromsø/Oslo 2022.
Vázquez-Chacón CA, Rodríguez-Gaxiola FdJ, López-Carrera CF, Cruz-Rivera M, Martínez-Guarneros A, Parra-Unda R et al. Identification of drug resistance mutations among Mycobacterium bovis lineages in the Americas. PLoS Negl Trop Dis 2021;15:e0009145.
Liven E. Om storfetuberkulose i Norge. Nor Vet Tidsskr 2023;135:447-9.
Torgerson PR, Torgerson DJ. Public health and bovine tuberculosis: what’s all the fuss about? Trends Microbiol 2010;18:67-72.
Taye H, Alemu K, Mihret A, Wood JLN, Shkedy Z, Berg S et al. Global prevalence of Mycobacterium bovis infections among human tuberculosis cases: systematic review and meta-analysis. Zoonoses Public Health 2021;68:704-18.
Dean AS, Forcella S, Olea-Popelka F, Idrissi AE, Glaziou P, Benyahia A et al. A roadmap for zoonotic tuberculosis: a One Health approach to ending tuberculosis. Lancet Infect Dis 2018;18:137–8.
World Health Organization. Tuberculosis deaths and disease increase during the COVID-19 pandemic. https://www.who.int/news/item/27-10-2022-tuberculosis-deaths-and-disease-increase-during-the-covid-19-pandemic (21.05.2024).
Cioboata R, Biciusca V, Olteanu M, Vasile CM. COVID-19 and tuberculosis: unveiling the dual threat and shared solutions perspective. J Clin Med 2023;12:4784.
Alvarez J, Bezos J, de Juan L, Vordermeier M, Rodriguez S, Fernandez-de-Mera IG et al. Diagnosis of tuberculosis in camelids: old problems, current solutions and future challenges. Transbound Emerg Dis 2012;59:1-10.
Parsons AW, Dawrs SN, Nelson ST, Norton GJ, Virdi R, Hasan NA et al. Soil properties and moisture synergistically influence nontuberculous mycobacterial prevalence in natural environments of Hawai’i. Appl Environ Microbiol 2022;88:e0001822.
Falkinham JO. Nontuberculous mycobacteria in the environment. Tuberculosis 2022;137:102267.
Honda JR. Environmental sources and transmission of nontuberculous mycobacteria. Clin Chest Med 2023;44:661-74.
World Organisation for Animal Health. Manual of diagnostic tests and vaccines for terrestrial animals. 12th ed. Paris 2022.
Gormley E, Corner LAL, Costello E, Rodriguez-Campos S. Bacteriological diagnosis and molecular strain typing of Mycobacterium bovis and Mycobacterium caprae. Res Vet Sci 2014;97(Suppl):S30-S43.
Good M, Bakker D, Duignan A, Collins DM. The history of in vivo tuberculin testing in bovines: tuberculosis, a “One Health” issue. Front Vet Sci 2018;5:59.
Cook HC. Tinctorial methods in histology. J Clin Pathol 1997;50:716-20.
Smithwick RW. Laboratory manual for acid-fast microscopy. 2nd ed. Atlanta: US Public Health Service, 1976.
Robinne S, Saad J, Morsli M, Hamidou ZH, Tazerart F, Drancourt M et al. Rapid identification of Mycobacterium tuberculosis complex using mass spectrometry: a proof of concept. Front Microbiol 2022;13:753969.
Corner LA, Trajstman AC. An evaluation of 1-hexadecylpyridinium chloride as a decontaminant in the primary isolation of Mycobacterium bovis from bovine lesions. Vet Microbiol 1988;18:127-34.
Gomez-Buendia A, Alvarez J, Bezos J, Mourelo J, Amado J, Saez JL et al. Non-tuberculous mycobacteria: occurrence in skin test cattle reactors from official tuberculosis-free herds. Front Vet Sci 2024;11:1361788.
Thierry D, Brisson-Noël A, Vincent-Lévy-Frébault V, Nguyen S, Guesdon JL, Gicquel B. Characterization of a Mycobacterium tuberculosis insertion sequence, IS6110, and its application in diagnosis. J Clin Microbiol 1990;28:2668-73.
Collins DM, Stephens DM. Identification of an insertion sequence, IS1081, in Mycobacterium bovis. FEMS Microbiol Lett 1991;83:11-15.
Gordon SV, Brosch R, Billault A, Garnier T, Eiglmeier K, Cole ST. Identification of variable regions in the genomes of tubercle bacilli using bacterial artificial chromosome arrays. Mol Microbiol 1999;32:643-55.
Kamerbeek J, Schouls L, Kolk A, van Agterveld M, van Soolingen D, Kuijper S et al. Simultaneous detection and strain differentiation of Mycobacterium tuberculosis for diagnosis and epidemiology. J Clin Microbiol 1997;35:907-14.
Guimaraes AMS, Zimpel CK. Mycobacterium bovis: from genotyping to genome sequencing. Microorganisms 2020;8:667.
Lorente-Leal V, Liandris E, Castellanos E, Bezos J, Domínguez L, de Juan L et al. Validation of a real-time PCR for the detection of Mycobacterium tuberculosis complex members in bovine tissue samples. Front Vet Sci 2019;6:61.
Buckwalter SP, Connelly BJ, Louison LK, Kolesch JM, Herring SA, Woodliff ED et al. Description, validation, and review of a decade of experience with a laboratory-developed PCR test for detection of Mycobacterium tuberculosis complex in pulmonary and extrapulmonary specimens. J Clin Tuberc Other Mycobact Dis 2022;29:100340.
Omer MK, Skjerve E, Woldehiwet Z, Holstad G. A cross-sectional study of bovine tuberculosis in dairy farms in Asmara, Eritrea. Trop Anim Health Prod 2001;33:295-303.
Oloya J, Kazwala R, Lund A, Opuda-Asibo J, Demelash B, Skjerve E et al. Characterisation of mycobacteria isolated from slaughter cattle in pastoral regions of Uganda. BMC Microbiol 2007;7:95.
Oloya J, Opuda-Asibo J, Kazwala R, Demelash AB, Skjerve E, Lund A et al. Mycobacteria causing human cervical lymphadenitis in pastoral communities in the Karamoja region of Uganda. Epidemiol Infect 2008;136:636-43.
Biffa D, Inangolet F, Bogale A, Oloya J, Djønne B, Skjerve E. Risk factors associated with prevalence of tuberculosis-like lesions and associated mycobacteria in cattle slaughtered at public and export abattoirs in Ethiopia. Trop Anim Health Prod 2011;43:529-38.
Kankya C, Muwonge A, Djønne B, Munyeme M, Opuda-Asibo J, Skjerve E et al. Isolation of non-tuberculous mycobacteria from pastoral ecosystems of Uganda: public health significance. BMC Public Health 2011;11:320.
Muwonge A, Kankya C, Godfroid J, Djønne B, Opuda-Asibo J, Biffa D et al. Prevalence and associated risk factors of mycobacterial infections in slaughter pigs from Mubende district in Uganda. Trop Anim Health Prod 2010;42:905-13.
Munyeme M, Muma JB, Samui KL, Skjerve E, Nambota AM, Phiri IG et al. Prevalence of bovine tuberculosis and animal level risk factors for indigenous cattle under different grazing strategies in the livestock/wildlife interface areas of Zambia. Trop Anim Health Prod 2009;41:345-52.
Munyeme M, Muma JB, Munang’andu HM, Nalubamba KS, Kankya C, Skjerve E et al. Failure to detect tuberculosis in Black lechwe antelopes (Kobus leche smithemani) in Zambia. BMC Res Notes 2011;4:233.
Biffa D, Bogale A, Skjerve E. Diagnostic efficiency of abattoir meat inspection service in Ethiopia to detect carcasses infected with Mycobacterium bovis: implications for public health. BMC Public Health 2010;10:462.
Müller B, Hilty M, Berg S, Garcia-Pelayo MC, Dale J, Boschiroli ML et al. African 1, an epidemiologically important clonal complex of Mycobacterium bovis dominant in Mali, Nigeria, Cameroon, and Chad. J Bacteriol 2009;191:1951-60.
Muwonge A, Malama S, Bronsvoort BM, Biffa D, Ssengooba W, Skjerve E. A comparison of tools used for tuberculosis diagnosis in resource-limited settings: a case study at Mubende referral hospital, Uganda. PLoS One 2014;9:e100720.
Welekidan LN, Skjerve E, Dejene TA, Gebremichael MW, Brynildsrud O, Agdestein A et al. Characteristics of pulmonary multidrug-resistant tuberculosis patients in Tigray Region, Ethiopia: a cross-sectional study. PLoS One 2020;15:e0236362.